骨化三醇对糖尿病肾病患者蛋白尿及微炎症的治疗作用
2016-08-04杨海波方晓琳杨玉孙广平张一诺吉化集团公司总医院内分泌科吉林吉林30吉化集团公司总医院检验科吉林吉林30
杨海波,方晓琳,杨玉,孙广平,张一诺.吉化集团公司总医院内分泌科,吉林吉林 30;.吉化集团公司总医院检验科,吉林吉林 30
骨化三醇对糖尿病肾病患者蛋白尿及微炎症的治疗作用
杨海波1,方晓琳1,杨玉2,孙广平1,张一诺1
1.吉化集团公司总医院内分泌科,吉林吉林132021;2.吉化集团公司总医院检验科,吉林吉林132021
目的研究骨化三醇对糖尿病肾病患者蛋白尿及微炎症的治疗作用。 方法 将该院2014年6月—2015年12月确诊并收治的60例早期糖尿病肾病患者按照随机数字表法分为3组,即对照组,观察组1与观察组2,每组20人。对照组给予营养运动干预、降糖、控制血压等基础治疗,观察组1在对照组基础治疗上给予骨化三醇胶丸0.25 μg 1次/d口服,观察组2在对照组基础治疗上给予骨化三醇胶丸0.5μg1次/d口服。3组均治疗3个月。观察3组治疗3个月后的临床疗效。观察3组治疗前,治疗后1、2、3个月的空腹血糖、血钙、血磷、血清肌酐、血尿素氮、谷草转氨酶、甲状旁腺激素及24 h尿蛋白定量(24 h pro)值;观察3组治疗前及治疗3个月后的糖化血红蛋白值;观察3组治疗前,治疗后1、2、3个月的C-反应蛋白(CRP)变化情况;统计3组治疗期间不良反应。结果3组空腹血糖在治疗后均显著下降(P<0.05),治疗3个月后3组空腹血糖值差异无统计学意义(P>0.05);观察组1和观察组2治疗后血钙水平显著高于同期对照组(P<0.05),观察组2其治疗后血钙水平显著高于同期观察组1(P<0.05);3组血磷、血肌酐、尿素氮、甲状旁腺素、谷草转氨酶治疗前后差异无统计学意义(P>0.05);观察组1和观察组2治疗后24 h尿蛋白定量显著优于同期对照组(P<0.05),观察组2其治疗后血钙水平显著优于同期观察组1(P<0.05);3组治疗前糖化血红蛋白差异无统计学意义(P>0.05),治疗3个月后均比治疗前显著改善(P<0.05),但3组治疗3个月后糖化血红蛋白水平差异无统计学意义(P>0.05)。3组治疗前CRP水平差异无统计学意义(P>0.05),对照组治疗后CRP无显著变化(P>0.05),观察组1及观察组2CRP均逐渐显著改善(P<0.05),观察组2治疗后CRP水平改善幅度显著优于同期观察组1(P<0.05)。3组治疗期间均无明显不良反应发生。结论糖尿病肾病患者在常规临床干预基础上给予骨化三醇疗效确切,可显著改善蛋白尿症状,并有效地遏制患者体内微炎症反应,而应用骨化三醇胶丸0.5μg1次/d口服能够在保障用药安全性的前提下进一步获得满意的临床预期。
骨化三醇;糖尿病肾病;蛋白尿
当前,我国已经成为世界卫生组织公认的糖尿病大国。由于我国自改革开放以来国民经济不断发展,居民生活水平不断提高,低运动量和高热量饮食早已成为当前我国居民的普遍亚健康生活方式,而这也是2型糖尿病诱发的重要根源。而糖尿病一旦发展到一定程度,即可诱发一系列并发症,糖尿病肾病即为糖尿病的核心并发症之一。此类患者其肾脏功能随着糖尿病进程的加剧不断受损,直至产生蛋白尿,最终诱发肾功能衰竭。临床研究指出,肾脏在人体钙磷代谢调节过程中起到重要的生理作用,而肾功能受损无疑可诱发钙磷代谢失衡,诱使骨钙流失及骨质异常钙化[1]。同时,糖尿病肾病的恶化进程与高血糖引发的微炎症损伤也密不可分[2]。该次研究旨在于从优化钙磷代谢、遏制体内微炎症入手,遴选骨化三醇来促进人体维生素D补足、优化人体骨代谢,进而逆向地针对糖尿病病变的进程加以临床干预,最终遏制蛋白尿、改善人体微炎症水平、延缓肾功能受损的进程。现就研究全程报道如下。
1资料与方法
1.1一般资料
该次研究选取病例均为吉化集团公司总医院2014 年6月—2015年12月确诊并收治的60例早期糖尿病肾病患者。所有患者均依照世界卫生组织制定糖尿病诊断标准[3]确诊糖尿病,而糖尿病肾病的确诊则依照美国糖尿病协会制定的相关诊断标准[4]进行,均处于Mogensen分期[5]IV期,24 h尿蛋白定量不小于0.5 g。其中男34人、女26人。患者年龄41~73岁,糖尿病病程2~25年,肾病病程4~34个月。同时将以下不宜纳入研究的情况排除:①甲状旁腺功能异常;②严重心脑血管疾病、酮症酸中毒、高血糖高渗状态;③1年内应用过糖皮质激素;④3个月内应用过钙剂或维生素D制剂;⑤恶性肿瘤、精神异常、严重感染;⑥肝功能不全、高血压动脉硬化性视网膜病变、肾脏萎缩、双侧肾动脉狭窄;⑦妊娠或哺乳期妇女;⑧精神类疾病;⑨其他代谢性疾病或其他种类肾病引发的肾功能受损或蛋白尿;⑩对该次研究药物过敏。按照随机数字表法将所有患者平均分为3组,即对照组,观察组1与观察组2,每组20人。对照组男11人、女9人,平均年龄(50.2±8.6)岁,平均糖尿病病程(8.3±5.1)年,平均肾病病程(25.1±12.3)个月;观察组1男12人、女8人,平均年龄(51.0±7.9)岁,平均糖尿病病程(8.2±4.8)年,平均肾病病程(24.7± 11.8)个月;观察组2男11人、女9人,平均年龄(51.5± 7.7)岁,平均糖尿病病程(7.9±3.9)年,平均肾病病程(24.6±11.4)个月。3组患者的年龄、性别、糖尿病病程及肾病病程等一般资料差异无统计学意义(P>0.05),因而具有可比性。
[基金项目]吉林市科技计划项目,项目编号:201437061。
1.2研究方法
1.2.1基础治疗 所有患者均实施糖尿病的临床基础控制干预。3组患者按照其糖尿病病情相应遴选口服降糖药、胰岛素皮下给药或口服-皮下注射联合干预,务必使其空腹血糖低于7.0 mmol/L,餐后2 h血糖低于10.0 mmol/L,且维持2周以上。严格低盐低脂低蛋白饮食,蛋白质日摄入低于0.8 g/kg体重以下、日摄入食盐低于6 g,同时禁止剧烈运动。控制血压,给药坎地沙坦酯片4 mg/d,使其血压稳定在125/75 mmHg以下,且维持2周以上。若单用坎地沙坦酯难以血压达标可联用其他药物如二氢吡啶类钙离子拮抗剂、α-受体阻滞剂、利尿剂或中枢性降压药。
1.2.2观察组1 该组也应用对照组的全部基础治疗方案,并在这一方案之上加用骨化三醇胶丸口服治疗,服用0.25 μg/次,服药1次/d。连续治疗3个月。
1.2.3观察组2 该组也应用对照组的全部基础治疗方案,并在这一方案之上加用骨化三醇胶丸口服治疗,服用0.5 μg/次,服药1次/d。连续治疗3个月。
1.3观察指标
①观察3组治疗3个月后的临床疗效[6]。a.显效:24 h Pro低于0.6 g,空腹血糖值保持在7.5 mmol/L以下,糖尿病肾病症状体征基本消失;有效:24 h Pro与治疗前相比好转幅度大于50%,空腹血糖值保持在7.5 mmol/L以下,糖尿病肾病症状体征明显改善;无效:24 h Pro与治疗前相比好转幅度不大于50%或无减少,糖尿病肾病症状体征无显著改善,空腹血糖值无法得以理想遏制;将显效与有效纳入总有效率的评定中。②观察3组治疗前,治疗后1、2、3个月的空腹血糖、血钙、血磷、血清肌酐、血尿素氮、谷草转氨酶、甲状旁腺激素及24小时尿蛋白定量(24 h pro)值;③观察3组治疗前及治疗3个月后的糖化血红蛋白值;④观察3组治疗前,治疗后1、2、3个月的CRP变化情况;⑤统计3组治疗期间不良反应。
1.4统计方法
该次研究数据均应用SPSS 20.0统计学软件实施数据分析,计量资料用均数±标准差(±s)表示,数据对比实施方差分析,计数资料用率(%)表示,行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组临床疗效对比
观察组2总有效率为95.0%,观察组1总有效率为85.0%,对照组总有效率为70.0%。观察组1与观察组2总有效率均显著高于对照组(P<0.05),但观察组1和观察组2间总有效率差异无统计学意义(P>0.05)。见表1。

表1 3组临床疗效对比
2.2 3组治疗前后血生化指标及尿蛋白定量情况对比
3组空腹血糖在治疗后均显著下降(P<0.05),治疗3个月后3组空腹血糖值差异无统计学意义(P>0.05);观察组1和观察组2治疗后血钙水平显著高于同期对照组(P<0.05),观察组2其治疗后血钙水平显著高于同期观察组1(P<0.05);3组血磷、血肌酐、尿素氮、甲状旁腺素、谷草转氨酶治疗前后差异无统计学意义(P>0.05);观察组1和观察组2治疗后24h尿蛋白定量显著优于同期对照组(P<0.05),观察组2其治疗后血钙水平显著优于同期观察组1(P<0.05);3组治疗前糖化血红蛋白差异无统计学意义(P>0.05),治疗3个月后均比治疗前显著改善(P<0.05),但3组治疗3个月后糖化血红蛋白水平差异无统计学意义(P>0.05)。见表2。
表2 3组治疗前后血生化指标及尿蛋白定量情况对比(±s)
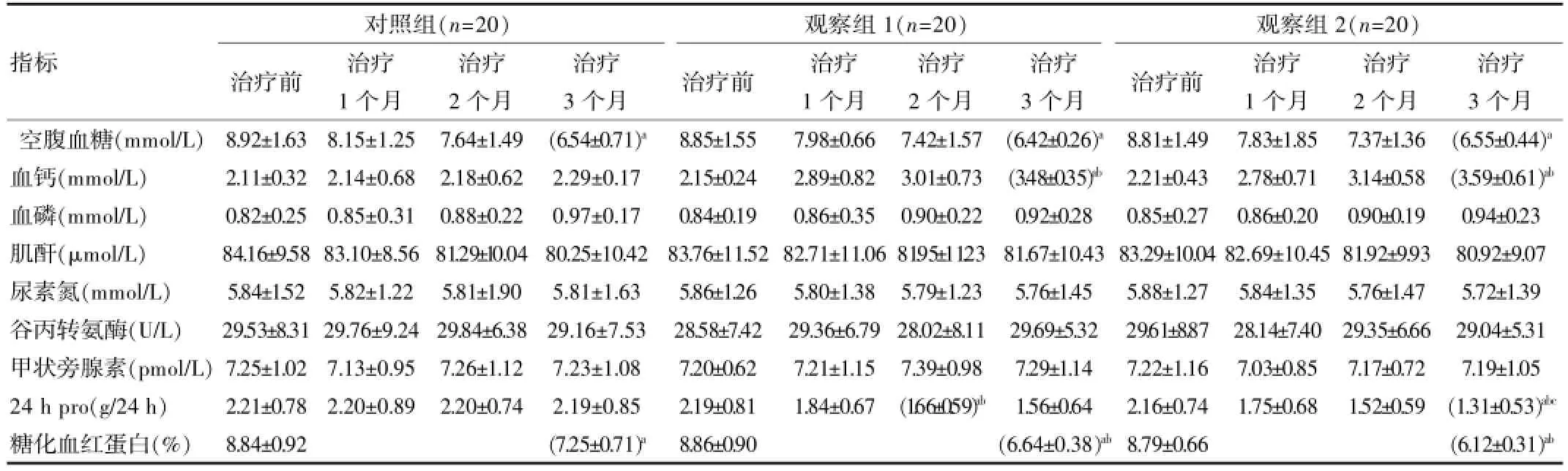
表2 3组治疗前后血生化指标及尿蛋白定量情况对比(±s)
注:与治疗前比较aP<0.05;与对照组比较,bP<0.05;与观察组1比较,cP<0.05。
对照组(n=20)治疗前 治疗1个月指标 治疗2个月治疗3个月观察组1(n=20)治疗前 治疗1个月治疗2个月治疗3个月观察组2(n=20)治疗前 治疗1个月治疗2个月治疗3个月空腹血糖(mmol/L)血钙(mmol/L)血磷(mmol/L)肌酐(μmol/L)尿素氮(mmol/L)谷丙转氨酶(U/L)甲状旁腺素(pmol/L)24 h pro(g/24 h)糖化血红蛋白(%)8.92±1.63 2.11±0.32 0.82±0.25 84.16±9.58 5.84±1.52 29.53±8.31 7.25±1.02 2.21±0.78 8.84±0.92 8.15±1.25 2.14±0.68 0.85±0.31 83.10±8.56 5.82±1.22 29.76±9.24 7.13±0.95 2.20±0.89 7.64±1.49 2.18±0.62 0.88±0.22 81.29±10.04 5.81±1.90 29.84±6.38 7.26±1.12 2.20±0.74 (6.54±0.71)a2.29±0.17 0.97±0.17 80.25±10.42 5.81±1.63 29.16±7.53 7.23±1.08 2.19±0.85 (7.25±0.71)a8.85±1.55 2.15±0.24 0.84±0.19 83.76±11.52 5.86±1.26 28.58±7.42 7.20±0.62 2.19±0.81 8.86±0.90 7.98±0.66 2.89±0.82 0.86±0.35 82.71±11.06 5.80±1.38 29.36±6.79 7.21±1.15 1.84±0.67 7.42±1.57 3.01±0.73 0.90±0.22 81.95±11.23 5.79±1.23 28.02±8.11 7.39±0.98 (1.66±0.59)ab(6.42±0.26)a(3.48±0.35)ab0.92±0.28 81.67±10.43 5.76±1.45 29.69±5.32 7.29±1.14 1.56±0.64 (6.64±0.38)ab8.81±1.49 2.21±0.43 0.85±0.27 83.29±10.04 5.88±1.27 29.61±8.87 7.22±1.16 2.16±0.74 8.79±0.66 7.83±1.85 2.78±0.71 0.86±0.20 82.69±10.45 5.84±1.35 28.14±7.40 7.03±0.85 1.75±0.68 7.37±1.36 3.14±0.58 0.90±0.19 81.92±9.93 5.76±1.47 29.35±6.66 7.17±0.72 1.52±0.59 (6.55±0.44)a(3.59±0.61)ab0.94±0.23 80.92±9.07 5.72±1.39 29.04±5.31 7.19±1.05 (1.31±0.53)abc(6.12±0.31)ab
表3 3组治疗前后CRP水平变化对比[mg/L,(±s)]
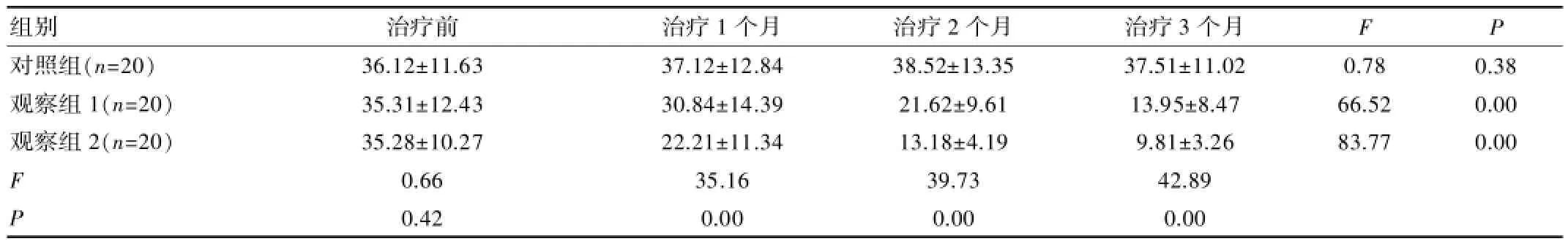
表3 3组治疗前后CRP水平变化对比[mg/L,(±s)]
组别 治疗前 治疗1个月 治疗2个月 治疗3个月F P对照组(n=20)观察组1(n=20)观察组2(n=20)0.78 66.52 83.77 0.38 0.00 0.00 F P 36.12±11.63 35.31±12.43 35.28±10.27 0.66 0.42 37.12±12.84 30.84±14.39 22.21±11.34 35.16 0.00 38.52±13.35 21.62±9.61 13.18±4.19 39.73 0.00 37.51±11.02 13.95±8.47 9.81±3.26 42.89 0.00
2.3 3组治疗前后CRP水平变化对比
3组治疗前CRP水平差异无统计学意义(P>0.05),对照组治疗后CRP无显著变化(P>0.05),观察组1及观察组2CRP均逐渐显著改善(P<0.05),观察组2治疗后CRP水平改善幅度显著优于同期观察组1(P<0.05)。见表3。
2.4 3组不良反应发生情况
3组治疗期间均无明显不良反应发生。
3讨论
临床研究指出,肾功能衰竭初期,人体内1,25-二羟维生素D3其血清浓度含量开始逐渐衰减,同时在高血糖引发的慢性刺激下,人体内的微炎症因子水平也开始逐渐上升,进而可诱发人体钙磷代谢异常,造成高磷、低钙血症。此时若不及时加以干预,随着病情的进展可诱发肾小球硬化及肾小管间质纤维化,造成肾小管重吸收功能持续衰退,引发大量蛋白尿并持续造成肾单位的代谢负荷,对此类患者的预后极其不利。因而,临床上逐渐开始着眼于对人体加以外源性维生素D3临床干预支持,以期改善糖尿病肾病患者的临床预后。
骨化三醇系人体内维生素D3的核心代谢活性物之一,该物质在肝脏内可被催化合成25-(OH)D,并进一步在肾脏内合成1,25-双羟维生素D[l,25-(OH)2D],其生物活性极强,能够有效地优化细胞增生及分化、优化人体免疫状态等[7]活性作用。活性维生素D首先能够迅速优化肾脏钙磷代谢功能,提高血液内的钙浓度同时遏制血液内磷浓度,且可进一步拮抗肾素的生理生化活性,有效地保护肾单位功能。在糖尿病患者常规对血压血糖水平进行有力控制和调节的同时,加用骨化三醇可显著保护肾小球滤过膜结构蛋白,优化肾小管的重吸收功能,减少了蛋白质通过尿蛋白路径的流失。此外,骨化三醇在人体内生成的活性维生素D能够显著遏制人体内炎症因子的过度表达、遏制细胞外基质的炎症因子沉积、拮抗免疫细胞增殖活化[8],最终极大地遏制了肾小球遭受的炎症损伤,使肾单位得到有效的保护。
该次研究即着眼于骨化三醇的以上两方面作用进行实验设计,通过观察骨化三醇对糖尿病肾病的整体疗效,观察常规糖尿病干预基础上加用骨化三醇对血糖、肝肾功能、甲状腺旁腺功能、钙磷代谢及尿蛋白5个方面的指标的影响。该次结果显示,常规糖尿病干预基础上加用骨化三醇可显著增加血钙水平、遏制血磷水平、保护肾脏功能、极大地减轻了尿蛋白症状,且不增加肝功能负担、不会造成甲状腺旁腺功能异常。同时,加用骨化三醇后,患者体内的炎症因子水平也逐渐改善,与仅接受常规治疗的对照组相比,患者体内的微炎症状态极大减轻,这也提示了加用骨化三醇对肾脏功能能起到显著的保护作用,有效地遏制了肾功能受损的进程,张巨发等[9]开展了同类研究,24 h pro治疗后降至(0.97±0.30)g/24 h,丁红等[10]同类研究发现加用骨化三醇后24 h pro降至(1.51±0.67)g/24h,该次研究与其临床预期结论基本一致。
此外,该研究还特地对骨化三醇的最佳应用剂量进行了研究,结果显示,在达到同类临床目的的前提下,单次口服0.5 μg与口服0.25 μg相比,能够在临床疗效与各个研究靶向指标方面能够获得更显著的临床效果,同时并未增加用药不良反应,故单次口服0.5μg、服药1次/d的骨化三醇给药剂量在整体上更有利于获得满意的临床预后。
综上所述,糖尿病肾病患者在常规临床干预基础上给予骨化三醇疗效确切,可显著改善蛋白尿症状,并有效地遏制患者体内微炎症反应,而应用骨化三醇胶丸0.5 μg 1次/d口服能够在保障用药安全性的前提下进一步获得满意的临床预期,使糖尿病患者争取到更为满意的预后,具有重要的临床应用推广价值。
[1]杨敏,白彝华,曾怡,等.骨化三醇冲击与每日治疗终末期肾脏病并发甲状旁腺功能亢进50例对比研究[J].陕西医学杂志,2016,36(1):51-52,83.
[2]沈英,富琳岩,丁燕琴.低浓度钙透析液联合骨化三醇胶丸冲击治疗对维持性血液透析患者继发甲状旁腺功能亢进的影响[J].中国生化药物杂志,2016,45(1):124-125.
[3]张梅英,李亚飞.骨化三醇联合缬沙坦治疗对高血压患者尿微量白蛋白的影响[J].实用临床医学,2015,16(11):1-2,6.
[4]兰凯,张光伟,常远,等.骨化三醇干预糖尿病肾病大鼠蛋白尿发生机制的研究[J].现代生物医学进展,2015,15(31):6035-6038,6094.
[5]李欣,贾强.骨化三醇对维持性血液透析患者微炎症及贫血的影响[J].中国血液净化,2015,14(11):672-675,695.
[6]王艳华.骨化三醇应用于慢性肾功能衰竭肾性骨病的临床分析[J].中国现代药物应用,2015,9(21):146-147.
[7]雷向宏,王建雄,张凤霞,等.骨化三醇对慢性肾脏病患者微炎症状态的影响[J].当代医学,2015,21(30):34-35.
[8]郭陆晋.浅析活性维生素D联合血管紧张素受体拮抗剂治疗IGA肾病有效性[J].中国卫生标准管理,2015,6(23):96-97.
[9]张巨发,朱燕妮.骨化三醇对1~2期慢性肾脏病患者微炎症状态的影响[J].中国全科医学,2012,15(22):2525-2527.
[10]丁红,湛川,王宗谦,等.骨化三醇对糖尿病肾病患者蛋白尿及高敏C反应蛋白的影响[J].山东医药,2011,51(41):80-81.
R587.1
A
1672-4062(2016)06(b)-0015-04
10.16658/j.cnki.1672-4062.2016.12.015
2016-03-22)
