43例刺五加注射液不良事件影响因素分析
2016-08-04汪慧芳汪魏平栾家杰江佳徐振宇左坚周德喜
汪慧芳 汪魏平 栾家杰 江佳 徐振宇 左坚 周德喜
(皖南医学院弋矶山医院药剂科,安徽 芜湖 241001)
43例刺五加注射液不良事件影响因素分析
汪慧芳汪魏平栾家杰江佳徐振宇左坚周德喜
(皖南医学院弋矶山医院药剂科,安徽 芜湖241001)
目的:分析我院刺五加注射液不良事件影响因素,促进临床安全用药。方法:对我院2012年1月 -2015年1月上报的43例刺五加注射液不良事件报告进行回顾性研究,分析患者性别、年龄、不良事件史、不良事件发生时间、临床表现、超说明书使用率和超说明书用药类型。结果:43例不良事件报告中,男女比例为0.95∶1;40~ 60(不含60)岁年龄段患者最多,占46.51%;既往有不良事件史者1例(2.33%);30 min以内发生不良事件36例(83.72%);不良事件主要为皮肤及附件损害,共32例(28.83%),其次为全身性损害,共24例(21.62%);超说明书用药类型主要表现为超单次剂量和超适应证,各占81.40%和13.95%;严重的不良事件10例(23.26%),其中30%为超适应证用药,80%为超单次剂量用药。结论:超说明书用药是导致我院刺五加注射液不良事件的主要影响因素,临床药师应加强刺五加注射液的医嘱审核,督促临床医师严格按照说明书用药,保障患者用药安全。
刺五加注射液;不良事件;影响因素;超说明书用药
刺五加注射液是由五加科植物刺五加的茎叶经“水煮醇沉”提取、精制而成的灭菌中药注射剂[1],虽然上市多年,但仍是一类高风险的中药注射剂,因其运用广泛,产生的不良事件(adverse drug event,ADE)越来越多,这些ADE表现各异,重者甚至危及患者生命,应当引起医务工作者特别是临床药师的重视[2]。ADE是指药物治疗过程中出现的不良临床事件,它不一定与该药有因果关系。ADE包括药品标准缺陷、药品质量问题、药品不良反应、用药失误以及药品滥用。近年来,对ADE防范的研究已引起国际上的普遍关注,国外不同的研究表明,ADE中有9%~ 58.8%可以防范。超说明书用药(off-label uses)是指药品使用的适应证、使用方法或剂量不在药品监督管理部门批准的药品说明书之内的用法[3]。流行病学调查显示,我国每年ADE导致约20万患者死亡,而中成药的药品说明书不明确、超说明书用药不合理是其重要原因[4]。为了解我院刺五加注射液ADE的具体情况,促进安全用药,本文对我院2012年1月 -2015年1月上报的43例刺五加注射液ADE报告进行了统计分析,报道如下。
1资料与方法
2012年1月 -2015年1月,我院通过国家药品不良反应监测网上报刺五加注射液ADE 43例,经因果关系评价,肯定4例,很可能15例,可能24例;利用Excel表格和手工筛选法逐项登记患者性别、年龄、ADE史、ADE发生时间、临床表现、级别、转归、超说明书使用率和超说明书用药类型,并对资料进行分类汇总和分析。
2结果
2.1 ADE一般情况
43例ADE中新的2例,严重的10例,一般的31例;好转36例,痊愈7例,未出现死亡病例。
2.2 ADE患者基本情况
在43例患者中,既往有ADE史者1例,占2.33%,不清楚自己是否有 ADE史者 15例,占34.88%,无ADE史者27例,占62.79%。男性 21例,女性 22例,男女比例为 0.95∶1;年龄分布19~ 87岁,平均年龄(52.60± 16.92)岁,40~59岁年龄段患者最多,共20例,占46.51%,具体分布见表1。
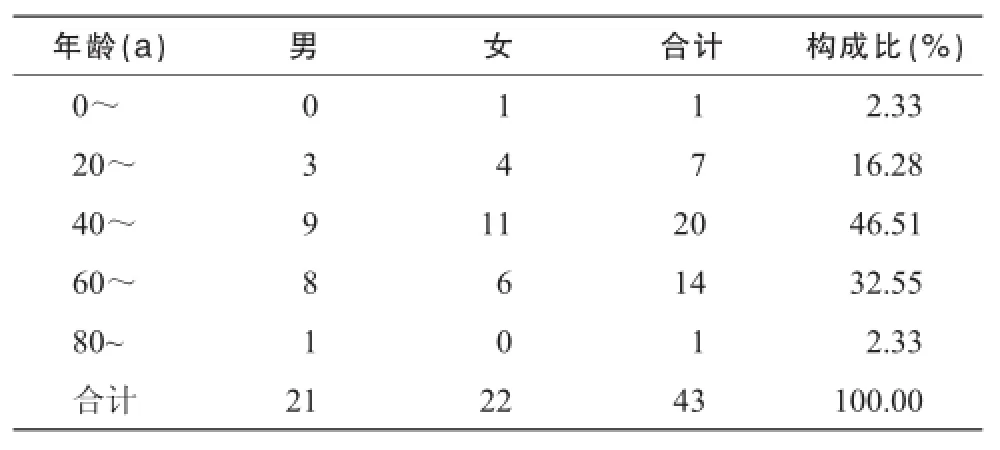
表1 ADE性别与年龄分布
2.3 ADE发生时间
43例刺五加注射液报告中,在30 min以内发生ADE 36例,占83.72%,其中5 min以内16例,占 37.21%;> 5 min且≤ 30 min者 20例,占46.51%。具体分布见表2。

表2 ADE发生时间分布
2.4 ADE累及系统或器官及主要临床表现
参考《WHO药品不良反应术语集》对ADE进行分类,ADE累及全身多个系统,以皮肤及附件损害最多,共计32例(28.83%);其次为全身性损害,共计24例(21.62%)。ADE涉及的系统或器官和主要临床表现详见表3。
2.5超说明书用药
超说明书用药类型主要表现为超单次剂量和超适应证用药。我院刺五加注射液为黑龙江乌苏里江制药有限公司生产,说明书要求一次300~500 mg,即60~100 mL,一日1~2次。43例ADE中,超说明书使用35例,其中200 mL,1日 1次34例;200 mL,1日2次1例,超单次剂量用药占81.40%。超适应证用药6例,占13.95%,诊断如下:肺结核3例,消瘦待查1例,胃炎1例,颈椎伤1例。

表3 ADE累及器官或系统及临床表现
2.6严重ADE
严重ADE 10例,占总数的23.26%。以全身性损害为主,发生 6例,占严重ADE的 60%,主要表现为过敏性休克,寒战、高热、抽搐和过敏反应。其次为呼吸系统损害,发生2例,占20%,主要表现为哮喘急性发作,胸闷和呼吸困难。其中超适应证用药占30%,超单次剂量用药占80%。详见表4。

表4 严重ADE相关情况
3讨论
3.1刺五加注射液ADE的影响因素
3.1.1 ADE与性别和年龄表1数据显示,刺五加注射液ADE与性别无明显相关性,ADE主要集中在40岁以上中老年人群。研究表明中老年人各器官功能逐渐衰退,对药物代谢与排泄能力降低,人体肾血流量在40岁以后每年递减1.5%~1.9%,65岁老年人的肾血流量仅为青年人的40%~50%[5],易发生ADE。另外,刺五加注射液的主要适应证为心脑血管疾病,此类疾病为中老年人的常见病、多发病,患者常联合用药,长期用药,甚至重复用药,这也是导致ADE发生率增高的原因[6]。
3.1.2 ADE发生时间分析由表2可看出,刺五加注射液ADE发生时间主要集中在30 min以内,共36例,占83.72%,这与黄路芬等[7]报道的中药注射剂引起的ADE多为速发型变态反应一致。而刺五加注射液使用前不做皮肤敏感试验,如果医师在使用该药之前没有充分询问过敏史及同类药物过敏情况,护士在用药30 min以内没有密切关注患者,临床药师也没有加强用药监护,那么患者发生ADE的风险就会增加。
3.1.3 ADE与患者体质和药物自身成分有关刺五加注射液所致的ADE主要为过敏反应中的Ⅰ型变态反应[7]。本研究中,严重ADE以全身性损害为主,发生6例,占60%,主要表现为过敏性休克和过敏样反应。其次为呼吸系统损害,发生2例,占20%,主要表现为过敏性哮喘急性发作,与文献报道一致[7]。刺五加注射液成分复杂,通过“水煮醇沉”法不能将植物蛋白、绿原酸等致敏性杂质完全除掉[1],当其从静脉直接进入体内,易引起过敏反应。本研究中,1例74岁男性患者因“消瘦待查”静脉输注刺五加注射液5 min时出现心慌胸闷,呼吸困难,查体:血压:194/118 mmHg,神志恍惚,口唇紫绀,血氧饱和度(SO2)30%,双肺呼吸音粗,可闻及广泛哮鸣音,心率112次/min。考虑哮喘急性发作,立即予以吸氧,心电监护,平喘,降压等处理措施,30 min后患者喘闷缓解,体温:36.4℃,心率:80次/min,呼吸:20次 /min,血压:114/60 mmHg,SO2:98.5%。追问病史得知:患哮喘病40余年,近两年来无发作。因患者没有主动告知,临床没有详细询问而引起严重的ADE。
3.1.4 ADE与超说明书使用分析本研究提示,超说明书用药是导致我院刺五加注射液ADE特别是严重ADE的主要原因。超说明书用药易引起用药风险,应该引起临床药师重视。
超说明书用药类型主要表现为超单次剂量和超适应证。对于用量问题,《中成药临床应用指导原则》指出应该严格按照说明书推荐的剂量使用,一项调研发现,60~ 89岁年龄段患者使用舒血宁注射液时,剂量越大,发生静脉炎的风险越高[8]。因此,对于刺五加注射液这类有明确使用剂量的,超剂量使用应慎重,任意超剂量或超适应证用药都可能提高ADE的发生率,增加患者的用药风险。本研究中,1例87岁男性患者因“肺部感染、高血压病”使用刺五加注射液200 mL,1日2次,在第2次静脉滴注时发生了胸闷、呼吸困难的严重ADE。对于中药注射剂的适应证,《中成药临床应用指导原则》指出:中成药应辨证用药,依据中医理论,分析、辨认疾病的证候,辨证施治,切忌混淆中医药学主治与西医适应证的概念,导致临床用药差错的发生。中医所指的“肝肾不足”,主要指肝肾阴虚,精血虚少,会出现头晕目眩,双目干涩,肢体麻木,口燥咽干,失眠多梦,双手震颤,脑卒中等现象。刺五加注射液具有平补肝肾,益精壮骨等中医中药的独特优势,在临床上主要用于肝肾不足所致的短暂性脑缺血发作,脑动脉硬化,脑血栓形成,脑栓塞等,亦用于冠心病、心绞痛合并神经衰弱和更年期综合征等的治疗。本研究中肺结核、消瘦待查、胃炎、颈椎伤患者无肝肾不足临床表现,属于超适应证用药。
一项对我院45个临床科室的医务人员(医师、护师、药师)的药品不良反应及安全用药相关知识网上问卷调查显示:医师和护师对“什么是药品不良反应”及“药品不良反应的上报期限”的知晓程度低于药师[9]。因此,我院药剂科将近一年的刺五加注射液ADE报告整理分析,向药事管理与药物治疗学委员会提交了“刺五加注射液药品不良事件临床风险提示”报告并在医院内网发布。同时组织药剂科全科开展刺五加注射液用药风险学习,加强静脉配置中心对刺五加注射液的医嘱审核,以临床药师为组长的药品不良反应小组深入病区,对监控医生和监控护师进行刺五加注射液ADE专业知识培训,明确超说明书用药属于不合理用药,督促临床医师严格按照刺五加注射液说明书开具医嘱,对于超说明书用药采取一定的惩罚措施。
4结论
综上所述,刺五加注射液用药风险较大,特别是老年、过敏体质患者更易发生严重ADE,超说明书用药是导致我院刺五加注射液ADE的主要原因,属于不合理用药。药事管理与药物治疗学委员会应加强超说明书用药管理,临床药师应加强刺五加注射液的医嘱审核,督促临床医师严格按照说明书用药,保障患者用药安全。
[1] 于风平,胡昌勤,崔生辉,等.刺五加注射液中过敏性杂质的分析[J].中国药学杂志,2008,43(5):384-387.
[2]谭子方,郭福,张万宝,等.中药注射剂的不良反应探讨及预防措施[J].中国医院药学杂志,2014,34(11):949-951.
[3] 陈孝,黄志军,侯连兵,等.关于印发《药品未注册用法专家共识》的通知[J].今日药学,2010,20(4):1-3.
[4]崔荣娜,关瑜,金锋.浅析含毒性药材中成药说明书存在的问题[J].中国药物警戒,2014,11(1):42-44.
[5] 陈新谦,金有豫,汤光.新编药物学 [M].17版.北京:人民卫生出版社,2011:19-20.
[6]刘洪玲,王路平,李红,等.中药注射剂不良反应分析及合理运用[J].中国医院药学杂志,2012,32(7):565-567.
[7] 黄路芬,王青,董燕,等.中药注射剂对免疫细胞表面分子的影响[J].药物不良反应杂志,2012,14(1):20-25.
[8] 杨薇,向永洋,谢雁鸣,等.输血宁注射液临床不良反应特征及预警信号探测研究[J].中国中药杂志,2013,38(18):3013-3018.
[9] 杨小骏,谢海棠,徐文科,等.药品不良反应及安全用药知识在某三甲医院三类医务人员中认知度研究[J].中国临床药理学与治疗学,2013,18(9):1008-1013.
◆医药快讯◆
美国FDA批准治疗高尿酸血症药物Lesinurad上市
美国FDA于2015年12月22日批准Ardea生物科学公司的Lesinurad(参考译名:来辛雷德,商品名:Zurampic)片剂上市,与黄嘌呤氧化酶抑制药合用于治疗使用黄嘌呤氧化酶抑制药单药治疗血清尿酸水平未达标患者痛风相关高尿酸血症。
本药通过抑制肾脏内参与尿酸重吸收的转运子的功能从而降低血清尿酸水平。本药可抑制尿酸盐重吸收转运子1(URAT1)和有机阴离子转运子4(OAT4)功能,URAT1负责大部分来自肾小管腔的过滤尿酸的重吸收,OAT4是利尿药诱导高尿酸血症相关尿酸转运子。本药不与尿酸重吸收转运子SLC2A9(Glut9)相互作用。
本药的有效性经3项为期12个月的多中心、随机、双盲、安慰剂对照试验证明。试验1,2结果均显示,第6个月时本药200 mg+别嘌醇组血清尿酸水平达标(< 6 mg/dL)患者比例高于别嘌醇单药组,本药200 mg+别嘌醇组血清尿酸平均水平在第1个月即小于6 mg/dL,并持续至12个月。试验3结果显示,尽管第6个月时本药200 mg+非布司他组血清尿酸水平达标(< 5 mg/dL)患者比例与非布司他单药组无统计学差异,但本药200 mg+非布司他组血清尿酸水平降低均值与试验1,2相似,且血清尿酸平均水平在第1个月即小于5 mg/dL,并持续至12个月。
本药与黄嘌呤氧化酶抑制药合用时最常见的不良反应为头痛、流感、血肌酐水平升高、胃食管反流病。
(来源:http://www.fda.gov)
欧洲药品评审局批准抗癫痫药Brivaracetam上市
欧洲药品评审局(EMA)于2016年1月14日批准优时比(UCB)公司的 Brivaracetam(参考译名:布瓦西坦,商品名:Briviact)片剂上市,用于辅助治疗16岁及以上癫痫患者的癫痫部分发作(伴或不伴继发性癫痫大发作)。
Brivaracetam对突触囊泡蛋白 2A(SV2A)具有选择性和高亲和力,SV2A为位于神经细胞和内分泌细胞突触前的一种跨膜糖蛋白,可调节神经传导物质的胞外分泌。Brivaracetam与SV2A结合为其抗痉挛作用的主要机制。
Brivaracetam的有效性通过 3项随机、双盲、安慰剂对照、固定剂量、多中心试验评估。所有试验均包括8周的基线期和随后的12周治疗期(未上调剂量)。3项试验的首要终末指标为与安慰剂相比癫痫部分发作频率降低的百分比和50%反应率(与基线相比癫痫部分发作频率降低50%)。试验结果显示,Brivaracetam 50~ 200 mg/d剂量用于辅助治疗16岁及以上癫痫患者的癫痫部分发作有效,且100 mg/d剂量与安慰剂相比,癫痫部分发作频率降低的百分比较50 mg/d剂量更高。
Brivaracetam最常见的不良反应为嗜睡、头晕,多为轻至中度。
(来源:http://www.ema.europa.eu)
An Analysis of Influencing Factors of 43 Cases of Adverse Drug Events Caused by Ciwujia Injection
Wang Huifang,Wang Weiping,Luan Jiajie,Jiang Jia,Xu Zhenyu,Zuo Jian,Zhou Dexi
(Department of Pharmacy,Yijishan Hospital of Wannan Medical College,Anhui Wuhu 241001,China)
Objective:To analyze the influencing factors of adverse drug events(ADEs)caused by ciwujia injection in our hospital so as to increase the safety of drug use in clinic.Methods:A total of 43 cases of ADEs caused by ciwujia injection,reported in this hospital from Jan.2012 to Jan.2015 were investigated retrospectively on the gender and age of patients,history of ADEs,occurrence time of ADEs,clinical manifestations,as well as the ratio and type of the off-label uses.Results:The ratio of male to female patients in 43 cases of ADEs was 0.95∶1.The patients at ages of 40~60(not including 60)years accounting for 46.51%of the total cases.Previous history of ADEs was observed in one case(2.33%).The ADEs appeared within 30 min in 36 cases(83.72%). The ADEs were mainly the harm to skin and its appendages(32 cases,28.83%)and systemic damage(24 cases,21.26%).The types of the off-label uses were mainly super single dose(81.40%)and super indication drug use(13.95%).Ten cases of severe ADEs were observed(23.26%),of which 30%were caused by super indication drug use and 80%by super single dose.Conclusion:Off-label uses is the main reason for ADEs caused by ciwujia injection in our hospital.Clinical pharmacists should strengthen the review on doctor's advice,supervise the strict application of ciwujia injection in accordance with the specifications,and ensure the safety of the drug in clinic.
Ciwujia Injection;Adverse Event;Influencing Factor;Off-label Uses
10.3969/j.issn.1672-5433.2016.04.009
汪慧芳,女,硕士,药师。研究方向:临床药学和药物不良事件。通讯作者E-mail:huifangwang123@sina.com
2015-12-09)
