“烟囱”支架技术在胸主动脉腔内修复术中保护左侧锁骨下动脉的应用
2016-08-03许福彬迟德财姜维良哈尔滨医科大学附属第二医院血管外科哈尔滨150086
许福彬 迟德财 姜维良哈尔滨医科大学附属第二医院血管外科,哈尔滨 150086
“烟囱”支架技术在胸主动脉腔内修复术中保护左侧锁骨下动脉的应用
许福彬 迟德财 姜维良*
哈尔滨医科大学附属第二医院血管外科,哈尔滨 150086
目的 评估左侧锁骨下动脉(left subclavian artery,LSA)“烟囱”支架(chimney stent implantation,CSI)在胸主动脉夹层修复术(thoracic endovascular aortic repair ,TEVAR)中短期和中期结果,并且对这项技术进行评价。方法 2013年6月到2015年10月行TEVAR手术并且进行LSACSI的患者49例,其中男性43例,女性6例。年龄为40~83岁,平均年龄为(57.4±13.3)岁。Standford B型主动脉夹层患者27例(n=27),穿透主动脉溃疡患者15例(n=15),主动脉弓动脉瘤患者3例(n=3),主动脉弓假性动脉瘤患者4例(n=4)。择期手术患者占79.6%,急诊手术患者占20.4%。分别于术后1个月、6个月和1年进行随访。结果 手术成功率为100%(49/49),共使用了55个胸主动脉支架。51个CSI,包括49个裸支架和3个覆膜支架。术中内漏概率为18.4%(9/49);9例患者发生Ⅰ型内漏。术中内漏率与病变位于主动脉弓大弯或者小弯侧,差异不具有统计学意义(4% vs 9%,P=0.121)。发生CSI狭窄3例,在第1个支架中放置第2个支架。围手术期左侧上肢缺血等并发症的发生率为零。随访时间为12个月。随访期间死亡率为6.1%(3/49)。随访期间并发症为CSI狭窄2例(4.1%),无新发内漏产生,夹层逆剥累及升主动脉1例。结论 短期和中期结果表明,在胸主动脉腔内修复过程中,对靠近LSA的胸主动脉病变应用“烟囱”技术,对保护LSA的开放可行。然而,由于出现内漏的可能性非常高,不主张对主动脉弓大弯侧病变在胸主动脉腔内修复中行LSA CSI植入技术。对首选覆膜支架还是裸支架,首选自膨式支架还是球扩型支架,尚未得出结论。
血管内;主动脉弓;左侧锁骨下动脉;“烟囱”技术
胸主动脉夹层的治疗一直是血管外科的难题。这种疾病在西方国家年发病率为10~20/百万[1],近年存在上升趋向。以往首选的治疗方式主要是人工血管置换,但是因为开胸、主动脉阻断、深低温和心脏停跳等巨大创伤,其病死率和严重并发症的发生率极高。Dake等[2,3]报道采用腔内修复技术治疗主动脉夹层的结果让人满意。之后,胸主动脉腔内修复术在胸主动脉疾病的治疗中应用不断增加。与传统手术相比,病死率和严重并发症的发生率都明显减少。近端锚定区不影响胸主动脉腔内修复术的治疗效果,而是限制其应用的主要因素之一。以往部分文献报道,对右侧椎动脉为优势动脉的病例,可以直接覆盖LSA开口,以达到延长近端锚定区的目的。但是,仍然有部分患者有颅内缺血的症状发生。对左侧椎动脉为优势动脉的患者,这种方法受限。对原有影响脑供血疾病的患者,直接覆盖LSA开口,风险更高。针对这种情况,哈尔滨医科大学附属第二医院血管外科中心在本组患者中在主动脉覆膜支架腔内隔绝主动脉病变的同时,采用LSA支架植入术,术后效果令人满意。
1 材料与方法
1.1 一般资料
2013年6月到2015年10月哈尔滨医科大学附属第二医院血管外科行胸主动脉修复术术并且进行LSA CSI植入术的患者49例,其中男性43例,女性6例。年龄为40~83岁,平均年龄为(57.4±13.3)年。Standford B型主动脉夹层患者27例(n=27),穿透性主动脉溃疡患者15例(n=15),主动脉弓动脉瘤患者3例(n=3)和主动脉弓假性动脉瘤患者4例(n=4)。择期手术患者占79.1%,急诊手术患者占21.9%。在术后1个月、6个月和1年进行随访。在这些患者中伴高血压44例,冠心病12例,糖尿病5例和脑血管疾病5例。在表1中列出这些患者的特点。
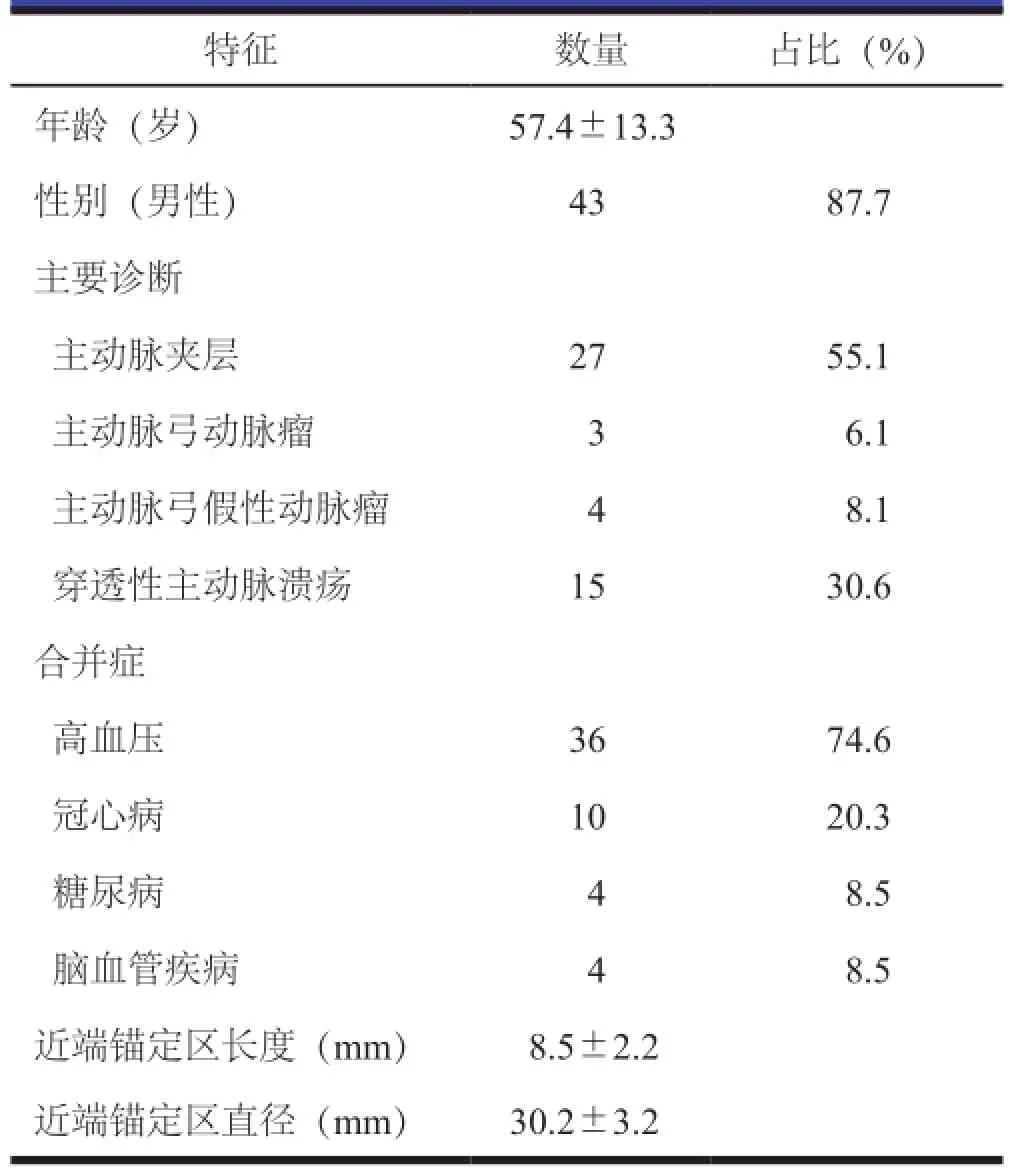
表1 49例患者的特征
1.2 概念定义
术中应用CSI技术成功的定义是:主动脉支架和LSA CSI均放置到预先指定位置,并且成功打开。内漏包括Ⅰ~Ⅳ型内漏。颅内缺血包括同侧和对侧脑梗死。脊髓缺血包括肢体感觉和(或)运动障碍、面部感觉异常和运动障碍。左侧上肢缺血包括左侧上肢缺血性坏疽、静息痛、劳力性疼痛和上举无力、苍白、麻木,不包括无症状低血压者。死亡指全因死亡。本文中近端锚定区指Standford B型主动脉夹层的原发破口近端与LSA开口之间距离,Dake和Criado等[3,4]都认为此段距离≥20 mm比较理想。
1.3 操作方法
胸主动脉腔内修复术和LSA CSI植入术:所有患者均全麻。常规穿刺左侧桡动脉或者肱动脉,置入6 F导管鞘,以6 F金标猪尾导管和超滑泥鳅导丝自桡动脉鞘置入,引入升主动脉。造影进一步明确主动脉弓的形态和各分支情况,评价主动脉弓分支动脉和双侧椎动脉的血供情况,与术前CTA相互补充。测量LSA开口主动脉管腔的直径,病变距LSA的距离,然后将CSI通过动脉鞘沿导丝送入,放置在LSA开口处。在主动脉支架释放后,将CSI平行于主动脉支架,快速释放,保证CSI超出主动脉支架覆膜区1 cm。完成后经主动脉造影导管于升主动脉血管造影评估手术效果(图1)。LSA CSI技术成功的定义为,术中主动脉造影证明近端破口被完全隔绝并且左侧锁骨下CSI形态良好,LSA血流通畅,没有发生严重的并发症,例如内漏、中风或者死亡。在造影结束后退出所有导丝导管,缝合股动脉切口或者穿刺点,桡动脉或者肱动脉穿刺点压迫止血。手术特征见表2。研究前期更倾向于选择自膨式裸支架作为CSI。然而,它存在支撑性比较差,术中释放困难,与主体支架重叠部分术后容易出现再狭窄等弊端。相反,覆膜支架具有良好的远期通畅率,并且输送系统也接近于裸支架,完全可以经皮穿刺完成。因此,在本研究后期阶段,所有病例均在LSA放置viabahin覆膜支架。
随访采用主动脉CT造影(CTA),分别在术后1个月、6个月和12个月。随访CTA可以在任何医院进行,但是均送至哈尔滨医科大学附属第二医院血管外科进行阅片。

图1 LSACSI在TEVAR中用于主动脉假性动脉瘤的急诊治疗

表2 胸主动脉腔内修复术的特点
1.4 统计学处理
应用SPSS 17.0软件进行数据分析,其中连续变量资料采用平均值±标准差,内漏率采用2×2卡方检验。P<0.05,差异具有统计学意义。
2 结果
手术成功率为100%(49/49),共使用55个胸主动脉支架。51个CSI,包括49个裸支架和3个覆膜支架。术中内漏概率为18.4%(9/49);9例患者均发生Ⅰ型内漏。术中内漏率和主动脉弓大弯与小弯曲率比较,差异具有统计学意义(35% vs 4%,P=0.018)。发生CSI狭窄3例,并且在第1个支架中放置第2个支架。围手术期左侧上肢缺血等并发症的发生率为零。随访时间为12个月。随访期间死亡率为6.1%(3/49)。随访期间并发症为CSI狭窄(n=2,4.1%),无新发内漏产生。在49例受试者中,46例(93.9%)患者成功跟进,平均时间为11.5个月。在随访期间,3例患者死亡,其中2例死于心脑血管疾病;1例死于夹层逆剥累及升主动脉,患者于随访期第4个月内再次出现胸痛症状,随后就诊于当地医院行CT造影检查,证实为夹层逆剥至升主动脉,在患者家属放弃治疗后患者死亡。2例患者出现CSI轻度狭窄,考虑植入CSI为裸支架,支架内狭窄为血管内皮再生爬行导致,均不需要处理。其他患者LSA显影均良好(图2)。在术中发生内漏9例,其中8例在1个月随访时内漏消失,1例在6个月随访时消失。2例因为患者个人因素,没有随访结果。所有参与随访的患者,在随访期间无内漏发生。

图2 B型胸主动脉夹层TEVAR术中放置LSA CSI
3 讨论
3.1 CSI技术的由来
2002年,Criado等[5]在重建主动脉分支血管中应用支架植入技术。2003年,Greenberg等[6]在腹主动脉瘤的腔内治疗中应用相同方法以保证足够的近端锚定区。在平行于主动脉支架的位置,植入另一个肾动脉支架,维持肾动脉的血流量。2007年,Criado[7]系统介绍了这项技术在主动脉血管腔内修复术中的应用要点。提及在分支血管中支架与主动脉支架近端的平行关系,在分支血管中支架被定义为CSI,这项技术被命名为“烟囱”技术[8]。本研究是本中心目前为止所有CSI技术在胸主动脉修复术中应用短期和中期结果。评估了在胸主动脉修复术中LSA CSI植入术的可用数据,总结经验。
3.2 CSI的意义
LSA为左侧上肢、脊髓和大脑提供了广泛的血液循环。因此,为了生理需求,不能故意遮挡这根血管。然而,在应用覆膜支架修复胸主动脉病变时,有时需要覆盖LSA开口以保证有一个良好的近端锚定区。为了保证LSA充足的血供,尝试了手术转流和腔内修复2种方法。血管转流术在重建LSA血供时效果良好,但是其相关并发症多,因此不建议用于高危患者(例如存在合并症、高龄和心脏功能比较差者)。开窗覆膜支架和分支支架的应用,同样可以重建LSA血供。然而,这些支架必须基于患者个体的病理特点而特殊定制,因此十分耗时,限制了在急诊手术中的应用。而“烟囱”技术作为一种微创手术,不仅可以应用于急诊手术,同样可以应用于常规的胸主动脉修复术。
脊髓缺血是胸主动脉修复术后一个严重的并发症[9]。根据以往报告,在胸主动脉修复术后脊髓缺血的风险因素包括主动脉覆盖的长度、腹主动脉瘤修复术、低血压、髂动脉损伤、肾衰竭和LSA被遮盖[10]。对主动脉支架比较长并且需要LSA受累的患者,重建LSA以维持脊髓供血十分必要。在本组研究中,没有因为脊髓缺血而发生截瘫病例。所以,建议有上述脊髓缺血高危因素的患者,在胸主动脉修复术中应该行LSA CSI植入技术。
中风是胸主动脉修复术中遮挡LSA后另一个严重并发症[11]。对左侧椎动脉非优势型患者,直接遮蔽LSA,不一定会立即出现致命性脑血管缺血并发症,但是可能会因为willis环代偿不足而引起脑部缺血症状;而左侧椎动脉为优势动脉或者右侧椎动脉重度狭窄甚至闭塞的患者,直接封堵LSA导致左侧椎动脉急性闭塞,可能会导致严重的脑缺血并发症,甚至导致患者瘫痪、死亡。本组患者均未出现脑血管缺血症状,同样证明了在胸主动脉修复术中LSA CSI技术的可行性。
3.3 LSA“烟囱”技术在胸主动脉修复术中的相关问题
3.3.1 LSA“烟囱”技术的应用指征
在胸主动脉修复术中应用LSA“烟囱”技术的指征是所有在覆膜支架植入过程中需要覆盖LSA开口的病例都可以应用。对主动脉夹层病例,LSA需要保护的指征由夹层近端第1破口的位置与LSA之间的距离决定;对动脉瘤或者假性动脉瘤病例,由瘤体的位置、大小、瘤颈与LSA之间距离决定;对穿透性溃疡病例,由溃疡与LSA之间距离决定。当破口、动脉瘤和溃疡的近端锚定区<15 mm时,为延长锚定区,需要封堵LSA。同样,当动脉瘤位于主动脉弓大弯侧或者体积很大时,主动脉夹层的破口位于主动脉弓小弯侧时,即使近端锚定区>15 mm,有时也需要封堵LSA以延长锚定区,防止支架回缩至动脉瘤或者Ⅰ型内漏的发生。对优势左侧椎动脉和右侧椎动脉严重狭窄、闭塞或者先天发育不良的患者[12],左侧上肢有透析通路和行带蒂左侧内乳移植术患者[13],LSA重建和“烟囱”支架CSI的应用是必要的。LSA“烟囱”技术作为一项单纯的腔内治疗方法,患者不需要行旁路手术即能保证LSA血供,避免了外科手术的创伤和并发症的出现,在主动脉覆膜支架对病变行腔内隔绝的同时即可以完成,具有手术时间短、操作简便、不增加造影剂用量和患者术后恢复快等特点,在处理覆膜支架近端锚定区不足又同时需要保证LSA血供时具有优势。3.3.2 LSA“烟囱”技术的局限性
当LSA迂曲严重时,植入CSI很困难。另外,如果术前或者术中造影发现LSA CSI锚定区内有明显的动脉硬化斑块时,同样不适合在1期进行CSI植入术,因为这样极易引起动脉硬化斑块脱落,导致脑血管栓塞。同时,一开始人们认为CSI技术通过延长近端锚定区可以解决内漏问题。然而,根据报道,放置CSI有可能导致主动脉支架移位甚至导致内漏[14]。在本组研究中,9例患者同样出现了在放置LSA CSI后立刻造影,存在不明显的Ⅰ型内漏的情况,但是在15 min后再次造影内漏均消失,术后1~6个月CTA中同样未发现Ⅰ型内漏。在9例患者中,破口位于小弯侧的患者8例,只有1例破口位于大弯侧,经过统计学检验,术中内漏率和病变位于主动脉弓大弯或者小弯侧比较,差异不具有统计学意义(8% vs 9%,P=0.121)。但是,在主动脉夹层破口或者假腔位于主动脉弓大弯侧,或者病变为一梭形真性动脉瘤时,不推荐应用CSI技术[15,16]。在这样的病例中,如果应用CSI技术,内漏的出现非常难以避免。对在腹主动脉修复术中出现的Ⅰ型内漏,可以应用对吻球囊技术同时对主动脉支架和CSI进行后扩张,改善甚至消除内漏[17]。但是在胸主动脉修复术中这项技术的安全性还有待于进一步研究。同样,LSA CSI和主动脉覆膜支架的植入对血流动力学的改变,也会引起血管渗血等情况发生。而且远期影响,例如颈动脉和椎动脉的血流动力学变化等情况,目前尚在探讨中。
据报道,在胸主动脉修复术后夹层逆行撕裂导致Standford A型主动脉夹层,是一个罕见但是致命的并发症,发生率为2.5%[18],本组患者术中均未出现这种情况,但是在随访中有1例患者死于夹层逆剥累及升主动脉。患者于随访第4个月内再次出现胸痛症状,随后就诊于当地医院行CT造影检查,证实为夹层逆剥至升主动脉,在患者家属放弃治疗后患者死亡。考虑为血压控制不佳导致。
3.4 LSA CSI的选择
CSI技术的成功关键是支架的选择。主动脉支架的径向支撑力和CSI的远期通畅率息息相关。没有覆膜的金属裸支架更有利于CSI释放。考虑远期通畅率,不建议主动脉支架超过LSA开口过远。LSA“烟囱”技术对主动脉支架释放后近端锚定区位于LSA开口处的病例更加合适[19]。否则,也建议应用CSI技术以外技术。在本组研究中,随访期间共出现5例CSI轻度狭窄,但是均未累及CSI和主动脉支架的重叠部分,考虑是血管内皮细胞再生爬行所致。但是,CSI通畅率应该随着主动脉支架的近端超过LSA开口距离的增加而减少。在“烟囱”技术中,覆膜支架和裸支架都可以作为选择,然而现阶段对哪种更加合适,尚未达成共识。覆膜支架有利于血流通道的重建,减少CSI周围发生内漏的风险[19,20]。然而,在主动脉支架和CSI之间仍然存在缝隙,内漏发生的风险仍然存在。另外一方面,裸支架因为输送系统更细,在外周血管中作为CSI也具有良好的远期通畅率。Zhu等[19]比较了2种类型支架应用于主动脉夹层的治疗效果,结果显示,术后即刻发生近端Ⅰ型内漏的概率,裸支架似乎相对更高。
3.5 LSA CSI的入路与释放
选择释放CSI的方法同样非常重要。覆膜支架因为输送系统比较大,必须通过左侧肱动脉植入,而裸支架可以通过桡动脉穿刺进行植入。最好先将CSI置入LSA开口处,待主动脉支架释放完毕后,再释放LSA CSI。CSI近心端应该适当超出主动脉支架近心端(1 cm左右为宜),过短容易导致开口被主动脉支架遮挡,过长容易导致血栓形成。同样,CSI在LSA中也应该有一个合适的锚定区。
本组研究主要的局限性在于没有进行脊髓缺血患者的统计和旁路(杂交)手术患者的对比。在胸主动脉修复术中LSA CSI技术的初步结果令人满意,但是仍然有必要对这项技术在LSA相关主动脉疾病治疗中是否能够改善远期效果,进行评估。
4 结论
短期和中期研究结果显示,在LSA相关胸主动脉疾病,特别是病变位于主动脉弓小弯侧的治疗中,CSI对LSA通畅率的保护有效可行。但是应该在术前和术中仔细评估所选CSI的直径和释放点,避免Ⅰ型内漏的发生。同样,对首选覆膜支架还是裸支架,首选自膨式支架还是球扩型支架,尚需要根据远期随访结果,进一步研究总结。
[1]Khan IA, Nair CK. Clinical, diagnostic, and management perspectives of aortic dissection. Chest, 2002, 122 (1): 311-328.
[2]Dake MD, Kato N, Mitchell RS, et al. Endovascular stentgraft placement for the treatment of acute aortic dissection. N Engl J Med, 1999, 340 (20):1546-1552.
[3]Dake MD, Miller DC, Mitchell RS, et al. The "first generation" of endovascular stent-grafts for patientswith aneurysms of the descending thoracic aorta. Thorac Cardiovasc Surg, 1998, 116 (5): 689-704.
[4]Criado FJ, Clark NS, Barnatan MF. Stent graft repair in the aortic arch and descending thoracic aorta: a 4-year experience. J Vasc Surg, 2002, 36 (6): 1121-1128.
[5]Criado FJ, Barnatan MF, Rizk Y, et al. Technical strategies to expand stent-graft applicability in the aortic arch and proximal descending thoracic aorta. J Endovasc Ther, 2002,9 (Suppl 2): 32-38.
[6]Greenberg RK, Clair D, Srivastava S, et al. Should patients with challenging anatomy be offered endovascular aneurysm repair? J Vasc Surg, 2003, 38 (5): 990-996.
[7]Criado FJ. A percutaneous technique for preservation of arch branch patency during thoracic endovascular aortic repair (TEVAR): retrograde catheterization and stenting. J Endovasc Ther, 2007, 14 (1): 54-58.
[8]Gehringhoff B, Torsello G, Pitoulias GA, et al. Use of chimney grafts in aortic arch pathologies involving the supra-aortic branches. J Endovasc Ther, 2011, 18 (5): 650-655.
[9]Zipfel B, Buz S, Redlin M, et al. Spinal cord ischemia after thoracic stent-grafting: causes apart from intercostal artery coverage. Ann Thorac Surg, 2013, 96 (1): 31-38.
[10]Feezor RJ, Martin TD, Hess PJ, et al.Extent of aortic coverage and incidence of spinal cord ischemia after thoracic endovascular aneurysm repair. Ann Thorac Surg, 2008, 86 (6): 1809-1814.
[11]Cooper DG, Walsh SR, Sadat U, et al. Neurological complications after left subclavian artery coverage during thoracic endovascular aortic repair: a systematic review and meta-analysis. J Vasc Surg, 2009, 49 (6): 1594-1601.
[12]Feezor RJ, Lee WA. Management of the left subclavian artery during TEVAR. Semin Vasc Surg, 2009, 22 (3): 159-164.
[13]Weigang E, Parker JA, Czerny M, et al. Should intentional endovascular stent-graft coverage of the left subclavian artery be preceded by prophylactic revascularisation? Eur J Cardiothorac Surg, 2011, 40 (4): 858-868.
[14]Ohrlander T, Sonesson B, Ivancev K, et al. The chimney graft: a technique for preserving or rescuing aortic branch vessels in stent-graft sealing zones. J Endovasc Ther, 2008,15 (4): 427-432.
[15]Sze DY, Bosch MA, Dake MD, et al. Factors portending endoleak formation after thoracic aortic stent-graft repair of complicated aortic dissection. Circ Cardiovasc Interv, 2009,2 (2): 105-112.
[16]Piffaretti G, Mariscalco G, Lomazzi C, et al. Predictive factors for endoleaks after thoracic aortic aneurysm endograft repair. J Thorac Cardiovasc Surg, 2009, 138 (4): 880-885.
[17]Jabr AB, Sonesson B, Lindblad B, et al. Chimney grafts preserve visceral fow and allow safe stenting of juxtarenal aortic occlusion. J Vasc Surg, 2013, 57 (2): 399-405.
[18]Dong ZH, Fu WG, Wang YQ, et al. Retrograde type A aortic dissection after endovascular stent graft placement for treatment of type B dissection. Circulation, 2009, 119 (5): 735-741.
[19]Zhu Y, Guo W, Liu X, et al. The single-centre experience of the supra-arch chimney technique in endovascular repair of type B aortic dissections. Eur J Vasc Endovasc Surg, 2013,45 (6): 633-638.
[20]Criado FJ. Chimney grafts and bare stents: aortic branch preservation revisited. J Endovasc Ther, 2007, 14 (6): 823-824.
Application of chimney technique for preserving the left subclavian artery in thoracic endovascular aortic repair
XU Fu-bin CHI De-cai JIANG Wei-liang*
Department of Vascular Surgery, the 2nd Affiliated Hospital of Harbin Medical University, Harbin 150086, China
Objective To evaluate short- and mid-term results of the left subclavian artery (LSA) chimney stentimplantation (CSI) during thoracic endovascular aortic repair (TEVAR), and to summarize the experience of this technique. Methods From June 2013 to October 2015, 49 patients [43 men; mean age of (57.4±13.3) years, range from 40 to 83 years]who underwent TEVAR and LSACSI were enrolled. The patients suffered from Stanford type B aortic dissection in 27 cases (n-27), 15 cases of penetrating aortic ulcer (n-15), 3 cases of aortic arch aneurysm (n-3),and 4 cases of pseudoaneurysm of the aortic arch (n-4). Elective settings were performed in 79.6% and emergent in 20.4% of all patients. Follow-up was performed at postoperative 1 month, 6 months and 1 year. Results The technical success rate was 100% (49/49), and 55 thoracic aortic stents were used. 51 chimney stents, including 49 uncovered and 3 covered stents, were implanted in 49 LSAs. The rate of overall immediate endoleak was 18.4% (9/49); type I endoleak was observed in 9 patients. The difference in the rate of immediate endoleak related to the anatomy between the outer and the inner curvature was no statistically significant (4% vs 9%, P-0.121). Chimney stent compression was observed in 3 patients and another stent was deployed inside the first one. Perioperative complications as left upper limb ischaemia and so on were zero (0%). The follow-up time was 12 months. The mortality rate during follow-up was 6.1% (3/49). Complications during follow-up included endoleak (n-0), retrograde type A aortic dissection (n-1), stenosis (n-2, 4.1%) of the chimney stent. Conclusion The short- and mid-term results showe that it is feasible to preserve the patency of LSA in TEVAR with the chimney technique for thoracic aortic pathologies close to LSA. However, TEVAR combined with LSACSI is not advocated for lesions located at the outer curve of the aortic arch due to a high possibility of endoleak. The conclusion can not be gotten on which kind of chimney stent should be the first choice between covered and bare ones, and also between self-expandable and balloon-expandable ones.
endovascular; aortic arch; left subclavian artery; chimney technique
R543.1
A
2096-0646.2016.02.03.05
姜维良,E-mail:wljiang6666@sohu.com
