内皮细胞特异性分子在肾透明细胞癌组织中的表达及意义
2016-08-03刘修恒周江桥汪志顺祝恒成
邱 涛,刘修恒,周江桥,张 龙,汪志顺,祝恒成
(武汉大学人民医院:1.器官移植科;2.泌尿外科,湖北武汉 430060)
·基础研究·
内皮细胞特异性分子在肾透明细胞癌组织中的表达及意义
邱涛1,刘修恒2,周江桥1,张龙2,汪志顺2,祝恒成2
(武汉大学人民医院:1.器官移植科;2.泌尿外科,湖北武汉430060)
University,Wuhan430060,China)
摘要:目的观察不同临床分期肾透明细胞癌的内皮细胞特异性分子(ESM-1)的表达差异,以探讨ESM-1与肿瘤发生及恶性程度的相关性。方法收集肾透明细胞癌组织、正常肾组织以及癌旁组织标本,进行免疫印迹和免疫组化染色,并根据蛋白条带的灰度值和免疫组化结果进行定量评分,同时监测患者血清中ESM-1的表达水平。结果免疫印迹显示肾透明细胞癌标本中ESM-1表达灰度为2.12±0.23,免疫组化显示肾透明细胞癌中ESM-1阳性染色评分为2.1±0.94,相比癌旁组织组和正常肾组织组,差异均有统计学意义(P<0.05);且ESM-1血清中表达量较正常组升高。结论检测ESM-1的表达有助于判断肾透明细胞癌的预后。
关键词:肾透明细胞癌;免疫组化;内皮细胞特异性分子(ESM-1)
肾癌是泌尿系统的常见肿瘤。早期局限性肾癌可以通过外科手术切除达到治愈目的,但晚期肾癌丧失手术机会,同时透明细胞癌对放疗、化疗都不敏感。近几年来出现的激酶抑制剂如索拉菲尼、舒尼替尼等靶向治疗药物可以延缓晚期肾癌患者的生存期。内皮细胞特异性分子(endothelialcell-specificmolecule1,ESM1)是血管内皮细胞上特异性表达的分子标志物,在肺和肾脏的血管内皮细胞上特异性表达,在肺癌、乳腺癌、结肠癌、黑色素瘤中也呈高表达[1-2],但在肾透明细胞癌中的表达研究不多[3]。本文收集肾透明细胞癌的组织标本检测ESM-1的表达,希望为肿瘤的预后提供新的分子标志。
1资料与方法
1.1一般资料基于纳入和排除标准收集到武汉大学人民医院2012年1月至2014年12月进行的肾切除术获取的肾透明细胞癌标本34例,统计患者的基本资料以及肿瘤的分期。肾透明细胞癌的癌旁组织标本和外伤性切除肾组织作为对照组。二喹啉甲酸(bicinchoninicacid,BCA)试剂盒购自碧云天公司,ESM-1兔抗人抗体,二抗购置SANTCRUZ公司。
纳入标准:根据病理诊断肾透明细胞癌,年龄在18岁以上。
排除标准:排除术前合并其他系统肿瘤,排除术前进行过放疗、化疗等干预肿瘤操作,排除病检合并其他来源的肾癌,排除高血压、糖尿病。
1.2标本收集与处理获得的新鲜组织,经10%甲醛固定,石蜡包埋,4~5μm厚切片,HE染色,光镜观察,经病理科医师确诊。
1.3ESM-1表达的检测方法
1.3.1免疫印迹分析取300mg标本,利用细胞裂解液冰上裂解,30min后12 000g,离心5min获得上清液,利用BCA蛋白浓度试剂盒测定蛋白浓度,-80 ℃保存。取20μg上样量电泳,转膜,洗涤,封闭,用1∶1 500的兔抗人ESM-1抗体孵育过夜,洗涤后1∶2 000的抗兔二抗孵育1h后洗涤显影,β-actin作为内参对照。用凝胶图像分析仪测量条带灰度值,计算目的蛋白与内参比值。
1.3.2免疫组化分析免疫组织化学采用SP法,DAB显色。一抗为兔抗人ESM-1。以正常肾组织标本及RCCC癌旁组织标本为对照。结果分析,ESM-1免疫组化染色以血管内皮细胞胞膜出现棕黄色颗粒为阳性,依阳性细胞所占比例不同将染色结果进行计分统计,分为4个级别,阴性(0~10%)、1(>10%~30%)、2(>30%~60%)、3(>60%)。
1.3.3ELISA分析收集肾癌患者血清和正常对照组血清,按照ELISA试剂盒进行操作检测ESM-1的表达,留存数据进行分析。1.4统计学方法采用SPSS18.0统计软件进行分析,两样本均数比较采用t检验,以P<0.05有统计意义。
2结果
2.1临床资料特征收集肾癌组织34例,患者男28例,女6例;年龄23~67岁;T1期15例,T2期10例,T3期6例,T4期3例;肾癌根治术23例,其中腹腔镜17例,开放手术6例;肾部分切除术11例,腹腔镜肾部分切除术8例,开放肾部分切除术3例。以8例切除的外伤性肾组织作为对照组,患者男7例,女1例,无肾脏相关疾病病史。
2.2WestenBlot结果在34例肾癌组织检测到ESM-1表达灰度比值为2.12±0.23,取同一患者肾癌边界1cm内的癌旁组织检测ESM-1表达,其灰度比值为1.45±0.35,对照组外伤性肾组织中ESM-1灰度比值为0.56±0.26。肾癌组织的ESM-1表达灰度比值相比癌旁组织组和正常组织明显增高,统计学上有差异性(P<0.05,表1)。
2.3免疫组织化学在肾癌组织中ESM-1大量表达于血管内皮细胞上,癌旁组织中ESM-1呈不同程度表达,对照组外伤性肾组织中ESM-1表达无2、3级(图1)。肾癌组织中ESM-1表达评分为,相比癌旁组织组和正常组织明显增高,统计学上有差异性(P<0.05,表1)。

图1免疫组化检测不同组ESM-1的表达(×200)
A:对照外伤性肾组织;B:肾癌旁组织;C:肾肿瘤组织。
表1不同组织中免疫组织化学法检测ESM-1表达的定性、定量结果
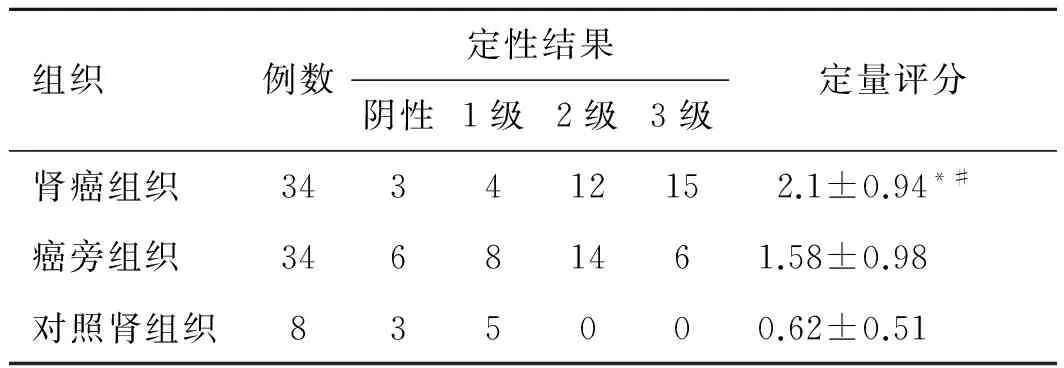
组织例数定性结果阴性1级2级3级定量评分肾癌组织343412152.1±0.94*#癌旁组织34681461.58±0.98对照肾组织835000.62±0.51
注:同癌旁组织比较,*P<0.05;同对照肾组织组比较,#P<0.01。
2.4ELISA分析结果肾癌患者中ESM-1表达量为(6.97±0.67)ng/mL, 对照组为(1.15±0.21)ng/mL。肾癌组患者血清检测ESM-1表达量显著高于正常对照组(P<0.05,图2)。
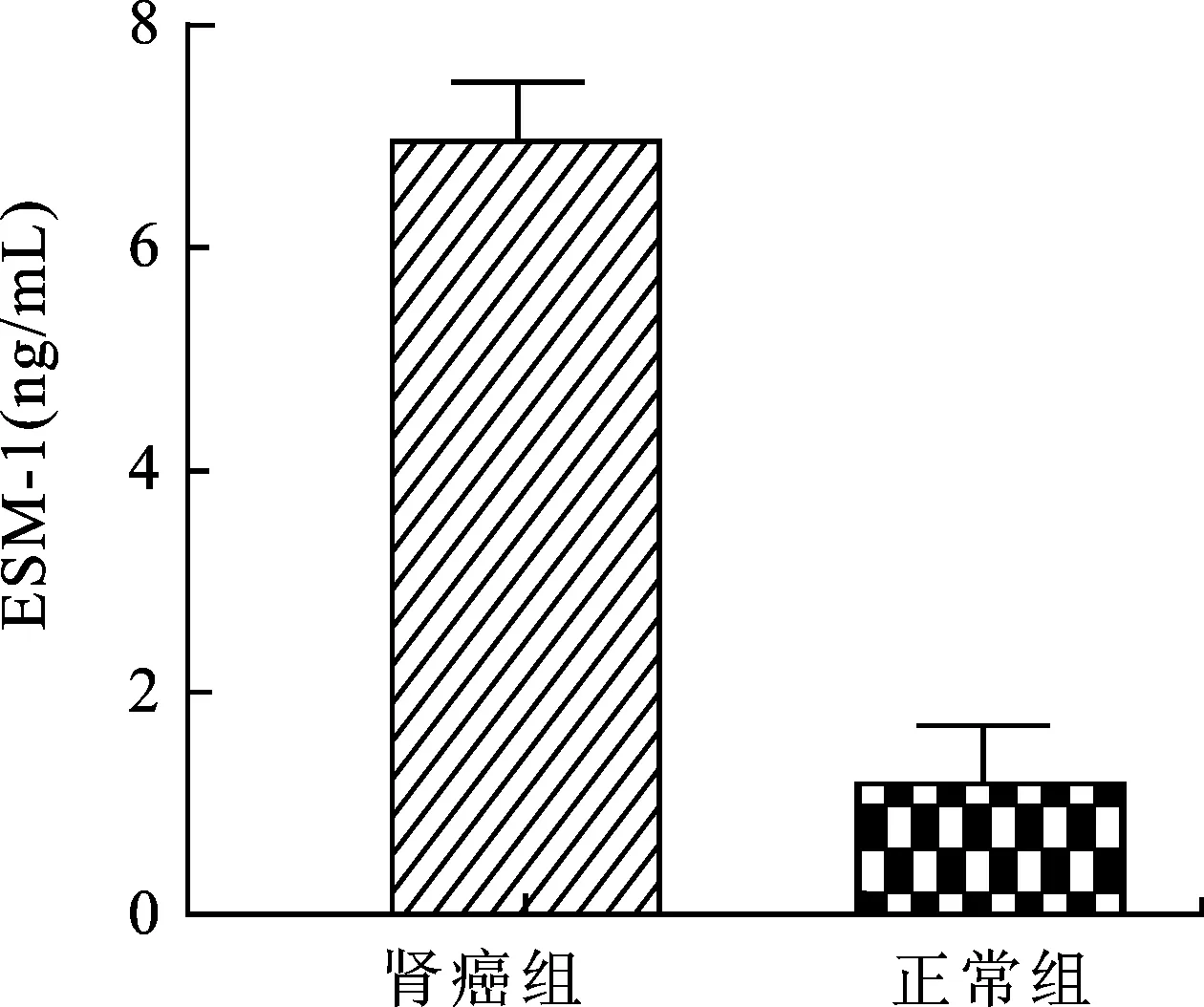
图2 ELISA检测肾癌患者和正常组患者中血清ESM-1表达
3讨论
随着近年来靶向药物的逐渐普及,晚期肾癌的生存期得到了显著延长。靶向药物索拉菲尼、舒尼替尼等可增加血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)、血小板衍生生长因子(plateletderivedgrowthfactor,PDGF)血清浓度,减少血管内皮生长因子受体(vascularendothelialgrowthfactorreceptor2,3,VEGFR-2,3)浓度,通过检测VEGFR-2的浓度可以监测靶向药物的治疗有效性。
ESM-1是1993年被发现,是血管内皮细胞分泌的一种特异性糖蛋白,分子质量为50ku,含有165个氨基酸,于137位丝氨酸位点共价连接的一条硫酸皮肤素单链。该皮肤素硫酸盐蛋白多糖是血管内皮表达的,存在于正常个体的血液中。越来越多的实验室证据显现ESM-1在细胞粘附、炎症反应以及肿瘤进展中发挥关键作用,炎症细胞因子如TNF-α,前血管源性生长因子如VEGF、成纤维细胞生长因子2(fibroblastgrowthfactor2,FGF-2)和肝细胞生长因子/散射因子(hepatocytegrowthfactor/scatterfactor,HGF/SF)均能显著增加内皮细胞ESM-1的表达合成[4]。ESM-1在肺癌患者的血清水平中呈现高表达状态,最近研究发现ESM-1mRNA水平是评估肺癌进展的极为重要的指标之一,是极具潜力的标记物、治疗靶点[3]。
在肺癌的研究中已经说明ESM-1特异性的表达,并且同肿瘤的预后密切相关。后续在肝癌,乳腺癌又得到进一步证实。而肿瘤患者血清中ESM-1的检测为肿瘤的预后提供了良好的分子标记物。因为ESM-1是血管内皮细胞分泌,因此肿瘤细胞上是无法检测到ESM-1的表达,而肿瘤血管生成是肿瘤侵袭性增强的主要特征。在我们收集的肿瘤标本中检测到ESM-1表达,而癌旁组织,正常肾组织表达量较低。肿瘤患者血清中ESM-1呈特异性升高,同肿瘤分期呈正相关。但由于收集病例数有限,同时ESM-1的表达同慢性肾脏病,其他炎症反应相关,因此尚不能完全指导监测肿瘤的预后。
在肿瘤组织中,ESM-1与血管新生关系密切。1日龄SD大鼠经缺氧处理后,在不同恢复时间段,其未成熟的视网膜中内皮细胞间紧密连接蛋白ZO-1以及Clautin-5 的mRNA和蛋白表达量均降低,而ESM-1表达显著升高[5]。在人脐静脉内皮细胞中已经发现,ESM-1能够下调ZO-1以及clautin-5,从而可能增加了单层内皮细胞的渗透性,利于单核细胞的跨内皮迁移。通过沉默ESM-1的表达,可以抑制肿瘤细胞的侵袭、转移,从而抑制肿瘤的进展[6-7],为晚期肿瘤的治疗提供新的策略。免疫组化图片显示肾癌组中ESM-1高表达在肾脏血管内皮细胞中,包括肾小球血管内皮细胞、肾间质毛细血管内皮细胞上。
本研究结果表明,肾透明细胞癌中ESM-1呈高表达,可能成为预测肿瘤预后的标志物。
参考文献:
[1]LIUN,ZHANGLH,DUH,etal.Overexpressionofendothelialcellspecificmolecule-1 (ESM-1)ingastriccancer[J].AnnSurgOncol,2010,17:2628-2639.
[2]KIMJH,PARKMY,KIMCN,etal.Expressionofendothelialcell-specificmolecule-1regulatedbyhypoxiainduciblefactor-1alphainhumancoloncarcinoma:impactofESM-1onprognosisanditscorrelationwithclinicopathologicalfeatures[J].OncolRep,2012,28:1701-1708.
[3]LEROYX,AUBERTS,ZINIL,etal.Vascularendocan(ESM-1)ismarkedlyoverexpressedinclearcellrenalcellcarcinoma[J].Histopathology, 2010,56:180-187.
[4]YANGJ,YANGQ,YUS,etal.Endocan:Anewmarkerforcancerandatargetforcancertherapy[J].BiomedRep. 2015,3:279-283.
[5]RATHNASAMYG,SIVAKUMARV,FOULDSWS,etal.Vascularchangesinthedevelopingratretinainresponsetohypoxia[J].ExperiEyeRes, 2015, 130: 73-86.
[6]KANGYH,JINY,LEECI,etal.ESM-1silencingdecreasedcellsurvival,migration,andinvasionandmodulatedcellcycleprogressioninhepatocellularcarcinoma[J].AminoAcids,2011,40:1003-1013.
[7]KANGYH,JINY,HANSR,etal.ESM-1regulatescellgrowthandmetastaticprocessthroughactivationofNF-kappaBincolorectalcancer[J].CellSignal,2012,24:1940-1949.
(编辑何宏灵)
收稿日期:2015-09-06修回日期:2015-11-13
基金项目:国家自然科学基金(No.81400753),武汉市科技局项目(No.2013062301010808)
通讯作者:刘修恒,教授.E-mail:drliuxh@hotmail.com
作者简介:邱涛(1984-),男(汉族),主治医师,博士学位,从事肾脏病研究. E-mail: mdqiutao@yahoo.com
中图分类号:R737
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.04.019
Expression and significance of ESM-1 in renal clear cell carcinoma
QIU Tao1, LIU Xiu-heng2, ZHOU Jiang-qiao1, ZHANG Long2, WANG Zhi-shun2, ZHU Heng-cheng2
(1.DepartmentofOrganTransplantation; 2.DepartmentofUrology,People’sHospitalofWuhan
ABSTRACT:Objective To explore the various expressions of ESM-1 in clinical renal clear cell carcinoma (RCCC) of different stages, in order to investigate its correlation with tumorigenesis and malignancy. MethodsRCCC specimens, para-carcinoma tissues and normal kidney tissues were obtained. The ESM-1 expressions were detected with Western blot and immunohistochemical staining. The expression of ESM-1 in serum was detected with ELISA. ResultsThe results of Western blot showed that ESM-1 expression in RCCC was 2.12±0.23, which was statistically different from that in para-carcinoma tissue and normal kidney tissue (both P<0.05). The results of immunohistochemical staining showed that the ESM-1 score in RCCC was 2.1±0.94, which was statistically different from that in para-carcinoma tissue and normal kidney tissue (both P<0.05). ESM-1 expression in the serum of RCCC patients was higher than in normal controls. ConclusionDetection of ESM-1 expression can provide evidence for the prognosis of RCCC.
KEY WORDS:renal clear cell carcinoma; immunohistochemistry; ESM-1
