8个家族性特发性基底节钙化家系患者的临床研究☆
2016-08-03黄远桃张伟邹国英李萍周高雅杨敏慧向光红周宏灏
黄远桃张伟邹国英李萍周高雅 杨敏慧 向光红周宏灏
8个家族性特发性基底节钙化家系患者的临床研究☆
黄远桃*△※张伟◎邹国英#李萍※周高雅※杨敏慧※向光红※周宏灏*△
目的探讨8个家族性特发性基底节钙化(familial idiopathic basal ganglia calcification,FIBGC)家系患者的临床特点。方法 收集8个FIBGC家系患者的临床资料,分析患者的临床检验结果、头颅CT及MRI改变、发病年龄、临床表现与患者基底节钙化体积(the volume of basal ganglia calcification,VBGC)的关系。结果家系患者和健康成员血清钙、铝、砷、钴、镁、磷、铁、甲状旁腺激素和降钙素的值比较均无显著性差异(P>0.05)。8个家系包括两个近亲结婚的家系均呈现常染色体显性遗传;运动受损患者的病情严重程度与基底节区钙化的病灶大小相关;精神症状的患者有无症状与VBGC的大小无关;运动受损与精神症状的患者间发表年龄(43.954±2.473 vs.31.319±10.156 y,t=4.438,P=0.001)和VBGC(1.748±0.622 vs.0.392±0.276 cm3,t=2.518,P=0.028)比较有统计学差异。结论 8个FIBGC家系患者呈现常染色体显性遗传的特点,运动受损的患者基底节区钙化的病灶大,发病年龄较晚;精神症状的患者基底节区钙化的病灶小,发病年龄较早。
家族性特发性基底节钙化 Fahr’s病 脑钙化 遗传 临床
【Abstract】Objective To better understand the clinical characteristics of Familial Idiopathic Basal Ganglia Calcifi⁃cation(FIBGC),including at the perspective of hereditary pattern,clinical test results,onset age,clinical heterogeneity and the volume of basal ganglia calcification(VBGC).Method 8 Eight FIBGC families were collected and draw family pedigrees were draw.Analysis of was conducted on the patient's clinical test results,head CT and MRI changes,onset ag⁃es,relationship of clinical manifestations with VBGC.Results No significant difference was found in serum calcium,alu⁃minum,arsenic,cobalt,magnesium,phosphorus,iron,parathyroid hormone and calcitonin concentration between the fam⁃ily members of patients and healthy controls(P>0.05).Family members from 8 FIBGC families including the two with consanguineous marriage manifested autosomal dominant heredity.The severity of,symptomatic s was correlated with VBGCpatients showed the same clinical manifestations in the dyskinesia family.The psychiatric symptoms was not asso⁃ciated with VBGC whereas patients with dyskinesia had a large VBGC.There was a significant difference in onset age be⁃tween patients with psychiatric symptoms and those with dyskinesia.P.atients with dyskinesia suffer larger VBGC,and is characterized by Patients with dyskinesia had relatively later onset age(43.95±2.47 y)whereas those with.psychiatric symptoms hadsymptomatic patients with early onset age(31.32±10.16y).The comparison of the onset age(43.954±2.473 vs.31.319±10.156 y,t=4.438,P=0.001)and VBGC(1.748±0.622 vs.0.392±0.276 cm3,t=2.518,P=0.028)with symptom⁃atic patients between dyskinesia and psychogenic families was significant.Conclusions Eight FIBGC families manifested autosomal dominant heredity.Patients with dyskinesia suffer have a larger VBGC and are associated with a,and is char⁃acterized by relatively later onset age.In contrast,patients with psychiatric symptomspsychogeny is not related withhave a the small VBGC and showedand their age of onset is young.earlier onset age.
【Key Words】Familial idiopathic basal ganglia calcification Fahr’s diseaseBrain calcification Hereditary pat⁃tern Clinical
家族性特发性基底节钙化(familial idiopathic basal ganglia calcification,FIBGC)又称Fahr’s病,是一种罕见的神经系统遗传疾病,首次发病年龄30岁左右,因为钙等矿物质沉积小脑齿状核和基底节区,导致一系列的神经和精神症状,主要的神经症状表现为:肢体乏力、构音障碍、肢体强直和震颤等;主要的精神症状:幻觉、妄想、焦虑、失眠和认知功能障碍等。在没有普及头颅CT检查前,流行病学调查研究发现FIBGC的发病率<1/ 1000000[1],随着CT等医学影像技术的发展和广泛使用,FIBGC的散发病例报道不断增加,家系患者的临床资料未见总结报道,本研究收集8个家系,分析总结如下。
1 资料与方法
1.1患者来源先证者均来源于湖南省脑科医院2012年1月1日至2015年5月1日住院或者门诊患者。入选病例均进行知情同意书谈话签字,本研究通过本院伦理委员会的审查,共收集8个FIBGC家系,家系图见:图1。
1.2诊断和筛查方法本研究中的所有家系均采取统一的调查方法:①:确诊先证者,参考Manyam 2005的诊断和排除标准[2];②:头颅CT筛查先证者父母;③:先证者父母有一方有阳性结果后再筛查先证者及其父母的兄弟姊妹及其子女;④:头颅CT筛查先证者年龄大于14岁的子代。所有头颅CT发现双侧基底节钙化和(或)其他脑区钙化者按照统一的检查方法:查血常规、血沉、肝功能、肾功能、电解质和微量元素(分光光度法)、化学发光法检测甲状旁腺激素(PTH)和降钙素(Ct),所有家系成员均完成病史采集:一般资料、症状、体征、既往病史、家族史及个人史的询问和记录,并行体格检查。
1.3基底节钙化体积(the volume of basal ganglia calcification,VBGC)的计算所有患者钙化体积计算都是使用CT图像数据用CT机的自带测量工具采取先分层计算体积再算总和的方法。
1.4统计学方法采用SPSS20.0进行统计分析,组间比较使用独立样本t检验,检验水准α=0.05。
2 结果
2.1 FIBGC患者常规检验结果 32例患者(患者组)和25例家系健康成员(对照组)的血钙(Ca)、铝(Al)、砷(As)、钴(Co)、镁(Mg)、磷(P)、铁(Fe)、PTH和Ct值的比较均无统计学差异(P>0.05)(见表1)。

表1家系成员患者组与对照组的血Ca、Al、As、Co、Mg、P、Fe、PTH、Ct值的比较
2.2家系图及家系患者的临床症状与头颅CT影像结果包括两个近亲结婚的FIBGC家系均呈现常染色体显性遗传规律。以运动受损的4个家系其他成员发病的症状均以运动受损为特点或者是腱反射亢进提示即将发生运动受损,患者病情严重程度与VBGC大小相关(见表2、3)。5例有精神症状的患者来源于4个家系中的20例患者,患者有无症状与VBGC的大小无关;比较运动受损和精神症状的患者间发病年龄(43.954±2.473 vs. 31.319±10.156,t=4.438,P=0.001)和VBGC(1.748± 0.622 vs.0.392±0.276 cm3,t=2.518,P=0.028),均有统计学差异。
2.3头颅CT和MRI影像特点除1例为頂叶散发病灶外其余均表现为双侧基底节区、小脑和脑叶对称性病变,头颅CT表现为高密度病灶,头颅MRI表现为T1WI、T2WI均显示低信号(见图2)。
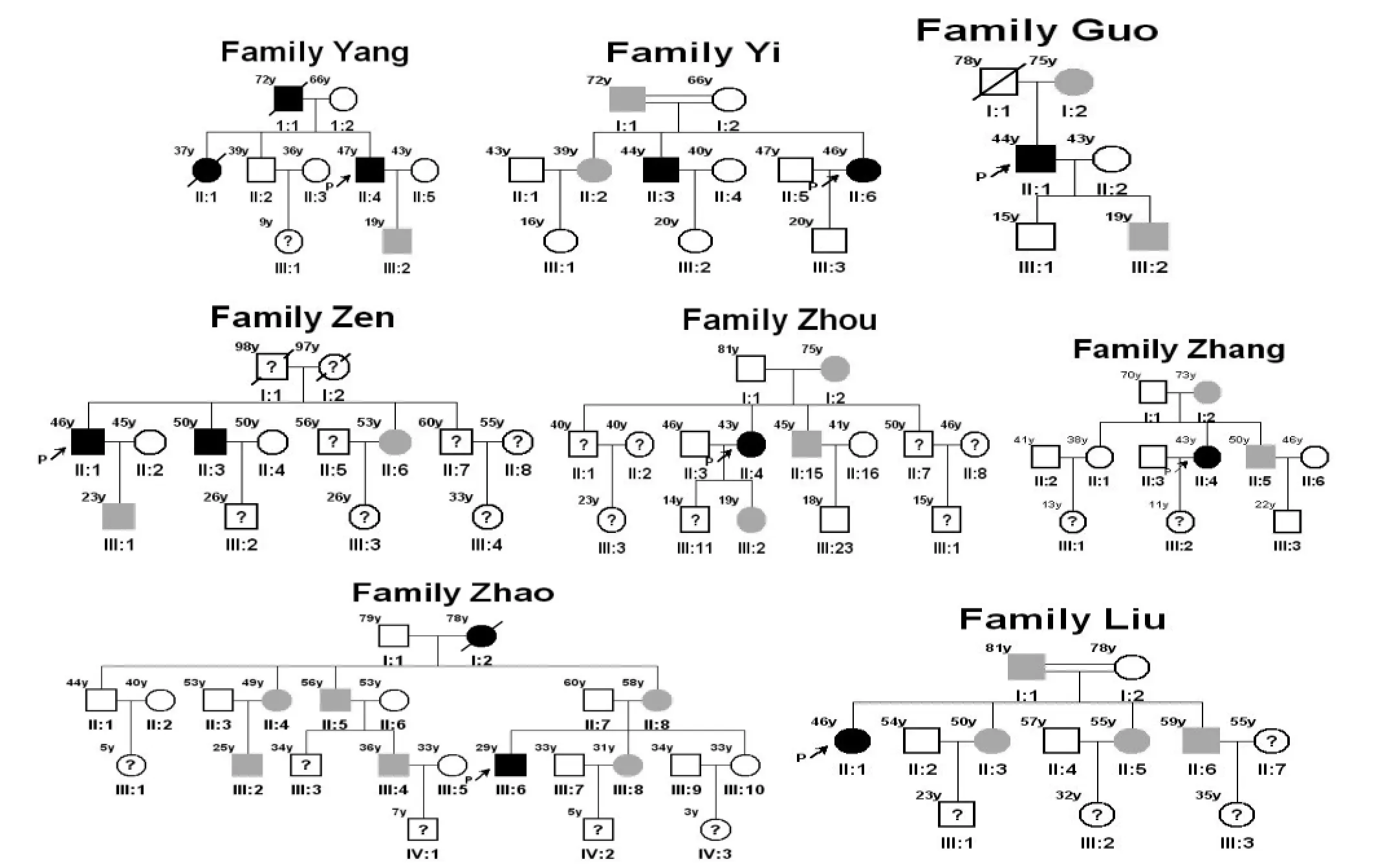
图1 8个FIBGC患者家系图。注:方框代表男性,圆圈代表女性,充填黑色代表有症状的患者,充填灰色代表无症状的患者,?代表未检查,箭头指向代表先证者,直线穿越代表离世,双线链接代表近亲结婚

图2箭头所指为FIBGC患者的颅内钙化病灶,从点状至大片状改变,头颅CT较MRI能够更加明显的显示钙化病灶,每一列的上下一组图是来源同一个患者,左起第1、2列是以精神症状为临床表现的患者,第3、4列是以运动受损症状的患者
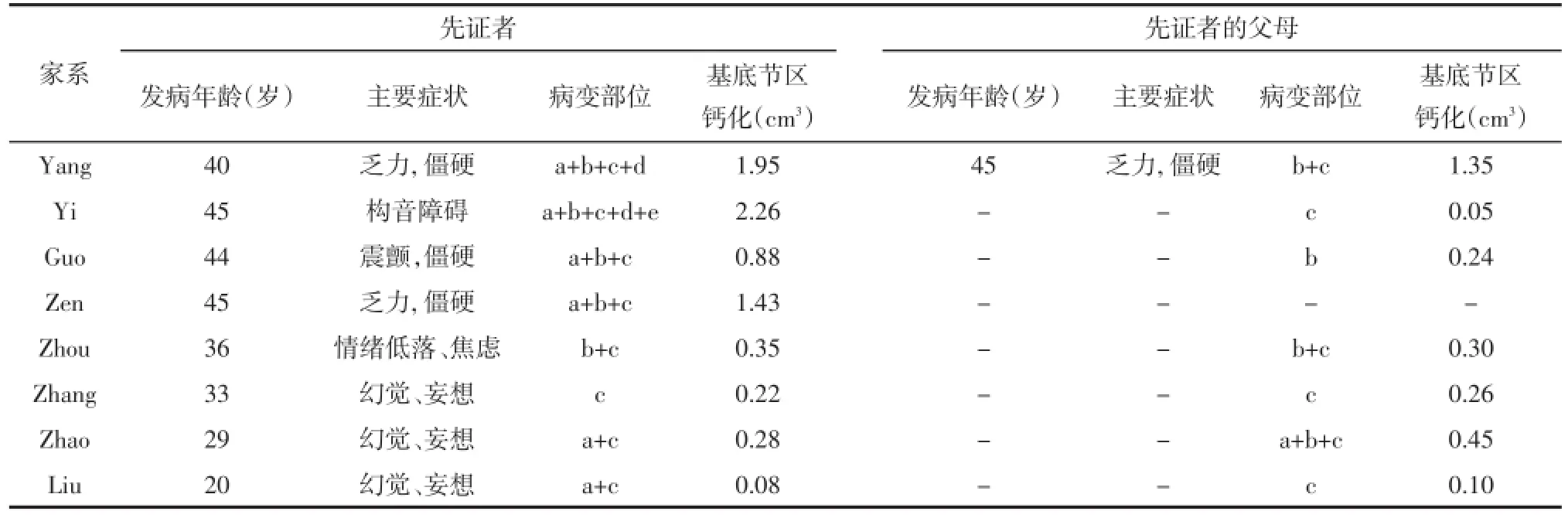
表2患者的发病年龄、主要的症状、病变的部位、基底节区钙化的体积(V)比较

表3患者的发病年龄、主要的症状、病变的部位、基底节区钙化的体积(V)比较
3 讨论
本研究比较FIBGC家系成员血清Ca、Al、As、Co、Mg、P、Fe的浓度发现患者和健康成员之间这些微量元素的血清的浓度没有差异;调节Ca、P代谢的主要激素PTH和Ct在家系成员患者和健康成员间也没有差异。由此推定并非血液中Ca、Al、As、Co、Mg、P、Fe的浓度异常或者调节Ca、P代谢的主要激素PTH和Ct水平异常造成Ca等矿物质的沉积于脑组织。据报道[1-2]FIBGC的基本病理改变的主要成分是钙、粘多糖,少量微量元素铝、砷、钴、铜、锰、镁、铁、铅等沉积在毛细血管壁,静脉血管、动脉血管周围组织;钙质沉积不仅仅是血管周边组织也包括神经细胞及神经胶质细胞钙质等浸润的主要区域是双侧基底节区、小脑齿状核等部位。那么导致FIBGC患者脑组织的异常钙等物质沉积的机制是什么,目前的研究认为是致病基因异常引起的,文献提示[3-5]:IBGC1定位于14q11.2-21.3,IBGC2定 位 于 2q37和 IBGC3定 位 于8p21.1-q11.13,最近的研究表明SLC20A2基因突变导致钙、磷的转运通道失调有关并且在敲除SLC20A2基因的大鼠动物模型中得到验证,但是仅仅在50%左右的患者中被检测验证[6-11]。PDGFRB、PDGFB、ISG15基因陆续被发现为部分FIBGC患者相关致病基因[12-16],但是均不能在所有患者中得到验证,综合文献报道,目前致病基因尚未完全确定。
本研究发现所有家系包括2个近亲结婚的家系均符合常染色体显性遗传的特点,与绝大部分研究报道一致[2,17]。然而,两个近亲结婚的家系确实与非近亲结婚的家系有不同之处,先证者Yi和Liu均为父系遗传,72岁的Yi和81岁的Liu在这次筛查才第一次查头颅CT,均为基底节区点状钙化病灶,一般来说,钙化病灶的大小随年龄增加而增加,假如他俩的头颅CT检查提前10年甚至更久,那么他俩的基底节钙化很可能是发现不了,按照一般的规律,近亲结婚的家系产生隐性遗传疾病的风险增加,那么这两个近亲结婚的家系很可能归结为隐性遗传家系,由此我们认为,FIBGC家系在划分为隐性遗传家系要非常慎重,先证者父母头颅CT的检查对确定遗传的方式十分重要。本组资料与文献报道的还有一个特别的地方,家系患者之间的症状有遗传相似性,运动症状的家系成员均为运动受损或者是腱反射亢进提示即将发生运动受损;精神症状家系患者的症状遗传相似性不大,只有一个家系有两个精神症状患者,其余家系均只有一个有精神症状,与BOWIRRAT等[18]报告的兄弟之间的症状各异而不同。
本研究发现FIBGC的临床表现多样性与钙质等沉积的脑区病灶大小和具体侵犯神经核团密切相关,但是又不完全对等的关系。本组资料统计研究发现仅仅45.83%的基底节钙化患者有临床症状也是对前者结论的有力的佐证之一,这个比例低于60%左右的基底节钙化患者有临床症状的既往研究报告[19],说明脑神经细胞在处理钙质等物质沉积时具有一定的可塑性,虽然神经核受钙质沉积的区域神经胶质增生和神经细胞损失严重,但是神经元的功能通常仍然保存[20-21],所以患者的影像显示病变严重而患者的临床症状并不明显。
本研究发现:运动受损的患者存在解剖结构破坏重和临床症状相对较轻;精神症状突出的患者存在解剖结构破坏轻而患者的临床症状相对较严重的特点。即患者的神经、精神症状与受累及的脑区解剖功能相互对应,但又难以用神经解剖部位来完全解释。如本研究发现以运动功能受损的患者均存在头颅CT或MRI提示受累及的脑区损害更为严重,而实际上患者的运动系统功能损害相对较轻,仍然是遵循精细活动、重要功能先受损的特点如本研究患者中构音障碍症状较为突出和锥体外系症状明显。也证实了受钙质等浸润的区域神经细胞损失严重,但是神经元通常仍然保存的病理现象。钙质等矿物质沉积除直接影响锥体外系的神经核团之间的神经通路传导在外,另外患者的震颤、强直等锥体外系症状的出现还与胆碱能和多巴胺能的化学通路受损有关。
本研究还发现运动功能受损的患者普遍发病年龄较晚,40岁之后,推测与钙质等沉积量变达到一定程度有关;运动受损的家系中,其它患者也是运动受损或者腱反射亢进也提示即将出现运动功能受损的症状,似乎运动受累方面更加具有遗传特征。本研究中患者的精神症状明显的4个家系中只有先证者有突出的精神症状,幻觉和妄想,甚至有伤人、毁物的阳性精神症状。颅内钙化病灶均涉及豆状核和纹状体,病灶与病情的严重程度存在不对称性即用病灶的解剖定位不能解释精神症状的严重程度,患者均存在病灶小而精神症状重的现象。从另外一种角度来说,钙质等矿物质的沉积在杏仁核、小脑齿状核、丘脑等部位直接或间接的造成了神经纤维突触之间化学通路的损害:去甲肾上腺素、肾上腺素、5-羟色胺和氨基酸能通路受到损害,从而造成了不能用头颅CT等影像结构解释的微观结构的破坏。但是新的问题同样出现了:以精神症状为主的先证者病情严重而其父母和兄弟姊妹有同样的脑区病变却没有任何症状或者仅仅是记忆力下降,这是一个值得深究的问题,原因是什么,一方面本研究认为:家系中患者的精神症状的出现与参与情绪调控的神经核团直接或间接受到钙质等矿物质沉积的影响;另一方面与个体的易感性相关,精神活动还与患者接受教育的程度、家庭和工作环境甚至社会环境、经历的重大生活事件、处理应激事件的能力等有关。
本研究还发现一个既往未曾报告过的有趣的现象,以精神症状为主的患者性别方面以女性为主,并且发病年龄早,30岁左右;运动受损的患者以男性为主,发病年龄较晚,推测在同等的结构病变的基础上年轻女性更容易出现精神紊乱,再次钙质等矿物质沉积造成与精神活动相关的化学通路的损害早于神经核团的结构损害。家系临床症状研究还提示:所有家系患者均只出现一个系统损害症状为主,运动系统受损就没有严重的精神问题,精神症状突出的就没有运动受损的问题,原因需要进一步研究。
总之,FIBGC患者临床表现具有明显的异质性,不同家系和同一家系各患者之间均存在较大差异,限于本研究样本量限制,可能存在偏差,临床需要进一步进行大样本的调查研究验证。
[1]MANYAM BV,WALTERS AS,NARLA KR.Bilateral striopalli⁃dodentate calcinosis:clinical characteristics of patients seen in a registry[J].Movement disorders,2001,16(2):258-264.
[2]MANYAM BV.What is and what is not‘Fahr’s disease’[J]. Parkinsonism Relat Disord,2005,11(2):73-80.
[3]GESCHWIND DH,LOGINOV M,STERN JM.Identifcation of a locus on chromosome 14q for idiopathic basal ganglia calcifca⁃tion(Fahr disease)[J].Am J Hum Genet,1999,65(3):764-772.
[4]DE OLIVEIRA DF,DE LEMOS RR,DE OLIVEIRA JRM.Mu⁃tations at the SLC20A2 gene and brain resilience in families with idiopathic basal ganglia calcification“(Fahr’s disease”)[J].Frontiers in Human Neuroscience,2013,5(7):420.
[5]LEMOS RR,FERREIRA JB,KEASEY MP,et al.An Update on Primary Familial Brain Calcification[J].Int Rev Neurobiol,2013,110:349-371.
[6]WANG C,LI Y,SHI L,et al.Mutations in SLC20A2 link fa⁃milial idiopathic basal ganglia calcification with phosphate ho⁃meostasis[J].Nature Genetics,2012,44(3):254-256.
[7]LEMOSA RR,OLIVEIRAB MF,OLIVEIRAA JR.Reporting a new mutation at the SLC20A2 gene in familial idiopathic basal ganglia calcification[J].Eur J Neurology,2013,20(3):e43-44.
[8]MEGUMI YAMADA,MASAKI TANAKA,MARI TAKAGI BA,et al.Evaluation of SLC20A2 mutations that cause idiopathic basal ganglia calcification in Japan[J],Neurology,2014,82(8):705-712.
[9]ELISA G,SALVATORE G.Novel mutation of SLC20A2 in an Italian patient presentingwith migraine[J].J Neurol,2014,261 (10):2019-2021.
[10]MATT B,AUDREY JS,MONICA Y,et al.SLC20A2 and THAP1 deletion in familial basal ganglia calcification with dys⁃tonia[J].Neurogenetics,2014,15(1):23-30.
[11]JENSEN N,SCHRODER HD,HEJBOL EK,et al.Loss of Function of Slc20a2 Associated with Familial Idiopathic Basal Ganglia Calcification in Humans Causes Brain Calcifications in Mice[J].J Mol Neurosci,2013,(51):994-999.
[12]TAGLIA I,BONIFATI V,MIGNARRI A,et al.Primary famil⁃ial brain calcification:update on molecular genetics[J].Neurol Sci,2015,36(5):787-794.
[13]NICOLAS G,POTTIER C,MALTETE D,et al.Mutation of the PDGFRB gene as a cause of idiopathic basal ganglia calcifica⁃tion[J].Neurology,2013,80(2):181-187.
[14]NICOLAS G,POTTIER C,CHARBONNIER C,et al.Phenotyp⁃ic spectrum of probable and genetically-confirmed idiopathic basalgangliacalcification[J].Brain,2013,136(Pt11):3395-3407.
[15]SANCHEZ-CONTRERAS M,BAKER MC,FINCH NA,et al. Genetic screening and functional characterization of PDGFRB mutations associated with basal ganglia calcication of unknown etiology[J].Hum Mutat,2014,35(8):964-971.
[16]BOGUNOVIC D,BYUN M,DURFEE LA,et al.Mycobacterial disease and impaired IFN-c immunity in humans with inherited ISG15 deficiency[J].Science,2012,337(6102):1684-1648.
[17]MUFADDEL AA,AL-HASSANI GA.Familial idiopathic basal ganglia calcification(Fahr’s disease)[J].Neurosciences(Ri⁃yadh),2014,19(3):171-177.
[18]BOWIRRAT A,YASSIN M,ARTOUL F,et al.Fahr’s disease:bilateral symmetrical striopallidodentate calcification in two brothers with two distinct presentations[J].BMJ Case Reports. 2013,6:bcr2013200462.
[19]DANYLLO F,DE OLIVEIRA,ROBERTA R,et al.Mutations at the SLC20A2 gene and brain resilience in families with idio⁃pathic basal ganglia calcification“(Fahr’s disease”)[J].Fron⁃tiers in Human Neuroscience,2013,7:1-2.
[20]DUCKETT S,GALLE P,ESCOUROLLE R,et al.Presence of zinc,aluminum,magnesium in striopallidodentate(SPD)calcifi⁃cations(Fahr’s disease):electron probe study[J].Acta Neuro⁃pathol(Berl),1977,38:7-10.
[21]SMEYERS-VERBEKE J,MICHOTTE Y,PELSMAECKERS J,et al.The chemical composition of idiopathic nonarteriosclerotic cerebral calcifications[J].Neurology,1975,25:48-57.
(责任编辑:李立)
Clinical research study of Familial Idiopathic Basal Ganglia Calcification from 8 family analysis.
HUANG Yu⁃antao,ZHANG Wei,ZOU Guoying,LI Ping,ZHOU Gaoya,YANG Minhui,XIANG Guanghong,ZHOU Honghao.De⁃partment of Clinical Pharmacology,Xiangya Hospital,Central South University,Changsha 410078,China.Tel:0731-84805380.
R743
A
10.3969/j.issn.1002-0152.2016.04.007
☆湖南省卫生计生委资助项目(编号:B2015-106)
*中南大学湘雅医院临床药理研究所(长沙410008)
△中南大学临床药理研究所;湖南遗传药理学重点实验室
※湖南省脑科医院神经内科
◎湖南省脑科医院放射科
#湖南省脑科医院检验科
(E-mail:hhzhou2003@163.com)
2015-11-01)
