液相色谱-离子淌度-四极杆/飞行时间串联质谱法快速检测烟叶中蔗糖酯
2016-08-02范若静陈秀萍郭寅龙
范若静,陈秀萍,张 芳,张 菁,郭寅龙
(中国科学院上海有机化学研究所金属有机化学国家重点实验室,上海国家有机质谱中心,上海 200032)
液相色谱-离子淌度-四极杆/飞行时间串联质谱法快速检测烟叶中蔗糖酯
范若静,陈秀萍,张芳,张菁,郭寅龙
(中国科学院上海有机化学研究所金属有机化学国家重点实验室,上海国家有机质谱中心,上海200032)
摘要:本研究利用液相色谱-离子淌度-四极杆/飞行时间串联质谱(LC-IM-Q TOF MS)技术,建立了快速检测烟叶中蔗糖酯的定性分析方法。采用甲酸-甲醇-水混合流动相系统和正离子模式下的电喷雾离子化技术,使烟叶甲醇提取液中的蔗糖酯分子形成加钠的准分子离子,然后通过离子淌度漂移管的分离,被四极杆/飞行时间串联质谱仪检测。从烟叶中共检测出6类蔗糖四酯,它们在色谱柱上的分离相差0.2~0.8 min,在漂移管中的分离相差0.4~0.5 ms,质谱检测中的离子质量相差14 u。在此基础上,利用二级质谱解析,准分子离子的元素组成测定以及碰撞截面的测定等手段,对烟叶中6类蔗糖四酯进行结构上的定性分析。结果表明,LC-IM-Q TOF MS技术可以快速检测复杂样品中的蔗糖酯,结合多维数据定性技术能够显著提高定性分析的准确性。
关键词:液相色谱-离子淌度-四极杆/飞行时间质谱(LC-IM-Q TOF MS);蔗糖酯;定性分析;烟叶
蔗糖酯(SE)全称蔗糖脂肪酸酯,是由蔗糖的一个或多个羟基与脂肪酸或芳香酸酯化产生的[1]。研究表明,烟草中的蔗糖酯是由烟叶表面腺毛分泌产生的,是烟叶表面主要的化学成分之一。近年来,蔗糖酯因其特有的化学属性和功能性,在卷烟产业中的应用受到广泛关注。蔗糖酯不仅是烟草中一种重要的致香物质[2],还可以使烟叶表面具有抗虫和抗微生物作用[3-4],此外也具有抗菌活性和调节植物生长的作用。因此,对烟叶中蔗糖酯进行检测和分析,有利于深入研究烟叶品质,可以为烟叶制品的生产和监控提供指导。
蔗糖酯的相对分子质量较大,分布在500~800 u之间,结构中含有多个游离羟基,挥发性较差。针对此类化合物的检测,早期多采用衍生化结合气相色谱(GC)[5]或气相色谱-质谱联用技术(GC/MS)[6-7],涉及到的衍生化试剂多为硅烷化试剂[8]。这些检测方法能够有效地实现蔗糖单、双、多酯异构体的分析,但必要的衍生化处理过程较繁琐。目前,液相色谱(LC)[9]和液相色谱-质谱联用技术(LC/MS)[10-12]已成为分离分析蔗糖酯的有效手段,特别是后者,不但具备LC对高沸点化合物的分离性能,避免了繁琐的衍生化过程,还能够利用MS组分鉴定能力,获取更多的蔗糖酯结构信息。除此以外,薄层色谱法[13-15]、红外光谱法[16-17]、核磁共振技术[18-20]等也被尝试用于蔗糖酯的检测分析。然而,无论采用GC或GC/MS,还是LC或LC/MS对蔗糖酯进行分析,都存在市场上没有蔗糖酯标准样品这一较大问题。因此,如何在缺失蔗糖酯标准样品的情况下提高此类化合物定性鉴别的准确性是分析烟草中蔗糖酯的关键问题之一。
离子淌度质谱(IM-MS)[21-23]是离子淌度分离(IMS)[24-25]与质谱联用的分析技术,是在传统有机质谱仪中增加离子淌度这一新的分离和测量因素,从而构成的新型二维质谱分析系统。IMS的原理是基于离子在漂移管中与缓冲气体碰撞时的碰撞截面不同,将离子按大小和形状进行分离。因此,IM-MS除了按质量和电荷数分离外,还可以根据离子的尺寸和形状提供传统质谱所不能获取的分子结构信息,如漂移时间(DT)[26]、碰撞截面积(CCS)[27]等,这在未知物[28]、大分子化合物[29-31]、同分异构体[32-33]等方面的分析具有明显优势。
本研究拟采用LC与离子淌度-四极杆/飞行时间串联质谱(LC-IM-Q TOF MS)联用技术,通过离子淌度分离和高分辨率的质量分离,实现烟叶中蔗糖酯的定性分析;并利用二级质谱解析、准分子离子的元素组成测定以及碰撞截面的测定等手段,对烟叶中6类蔗糖酯进行检测,以实现复杂样品中蔗糖酯的定性分析。
1实验部分
1.1仪器与试剂
6560离子淌度四极杆飞行时间(IM-Q TOF)液质联用系统:美国Agilent公司产品,配有双喷头喷射流电喷雾电离源,MassHunter LC/MS Data Acquisition B.07.00、MassHunter Qualitative Analysis B.07.00和MassHunter IM-MS Browser B.07.01等仪器控制及数据处理软件。
烟叶粉末:由上海烟草集团责任有限公司提供;甲酸(色谱纯):美国Sigma-Aldrich公司产品;甲醇(色谱纯):美国Fisher Scientific公司产品;超纯水:经Millipore纯水系统净化;Q TOF MS质量校正溶液和调谐溶液(含化合物甜菜碱和氟代三磷氰化物):美国Agilent公司产品。
1.2实验条件
1.2.1液相色谱条件Agilent Poroshell 120 SB-C18色谱柱(2.1 mm×100 mm×2.7 μm);流动相:0.1%甲酸甲醇溶液-0.1%甲酸水溶液(80∶20,V/V),等度洗脱;流速0.2 mL/min;进样体积5 μL。
1.2.2质谱条件ESI正离子模式检测,离子源温度325 ℃,干燥气(N2)流速12 L/min,雾化气(N2)温度350 ℃,气压2.41×105Pa,毛细管、喷嘴和碎裂电压分别为4 000、1 000和400 V,Q TOF MS采集速率为每秒0.9个谱图,一级质谱扫描范围m/z200~1 500,二级质谱扫描范围和轰击能量依据母离子进行优化,Q TOF MS在正离子模式下以调谐溶液中系列氟代三磷氰化物(HP-0321、HP-0621、HP-0921)离子进行精确质量校正。
1.2.3淌度条件漂移气为N2,漂移管内气压和温度分别为533 Pa和25 ℃;漂移管前3个离子漏斗射频电压分别为:前端100 V、捕集100 V、后端150 V;漂移管前后端的电压差为1 700 V。
1.3样品制备
称取0.5 g烟叶粉末样品,加入5 mL甲醇,超声提取10 min,以8 000 r/min离心10 min,取上清液过滤,待LC-IM-Q TOF MS分析。
2结果与讨论
2.1烟叶中蔗糖酯的LC-IM-Q TOF MS检测
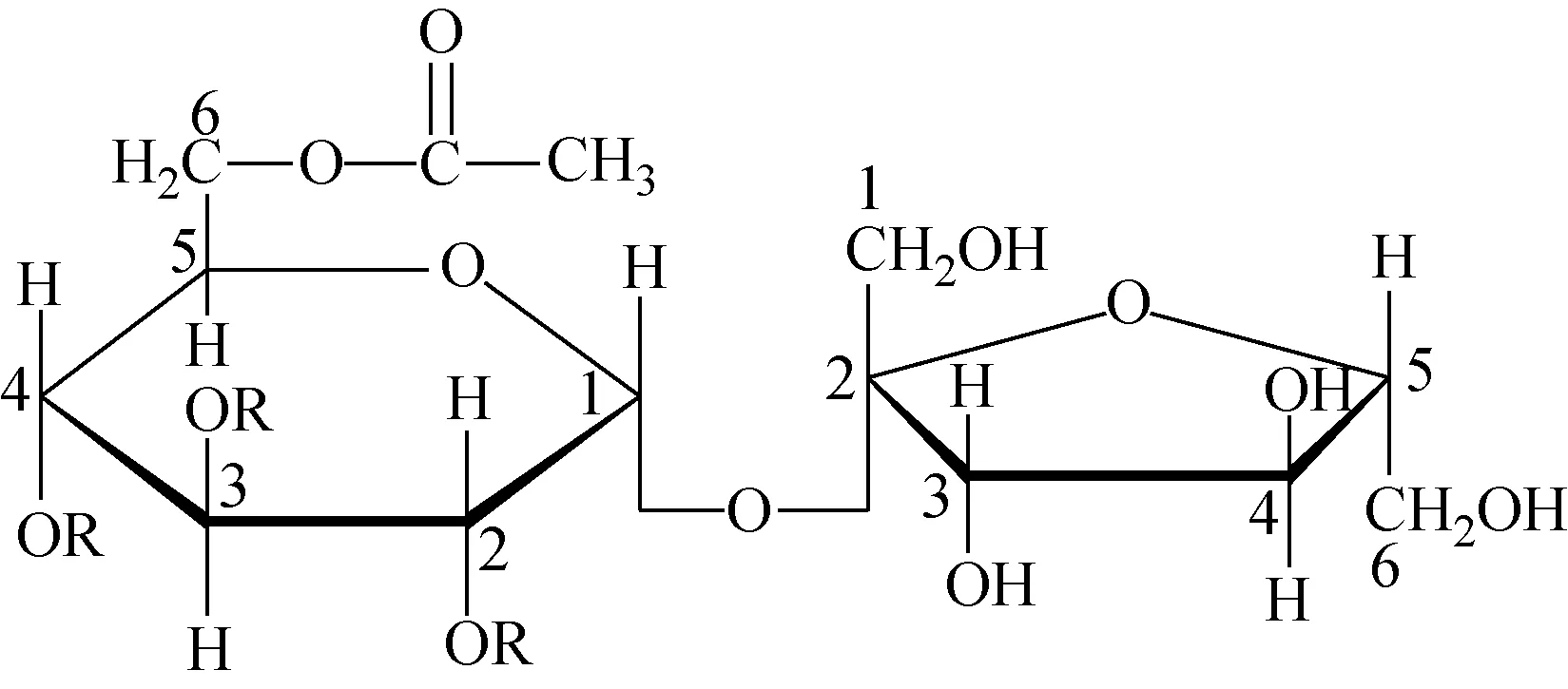
图1 烟叶中蔗糖酯的化学结构
普通烟草中的蔗糖酯在结构上具有共同特点,即蔗糖酯中葡萄糖C6位羟基被乙酸酯化,C2、C3、C4位羟基被碳链长度为C3~C8的脂肪酸酯化,而果糖上的羟基是完全游离的,其结构示于图1[2]。本实验采用LC-IM-Q TOF MS法检测烟叶提取物,在10 min分析周期内所得的总离子流色谱图(TIC)示于图2a。可见,基质干扰非常严重,导致无法明显地观察到有效的蔗糖酯信号。由于缺失蔗糖酯标准品,在查找蔗糖酯的过程中,参考相关文献数据[7,19,34],通过选择离子流图(EIC)确认保留时间为1.8、2.0、2.4、2.8、3.2、4.2 min处的系列组分峰可能为蔗糖四酯,其EIC图示于图2b~2g。同时,因蔗糖酯结构中含有多个活泼氢,在电喷雾离子化方式下,此类化合物易以加钠准分子离子的形式存在。利用飞行时间高分辨质谱进行元素组成测定时,该系列峰的分子质量相差—CH2—基团,说明与葡萄糖相连的3条脂肪酸总碳数相差1。

图2 LC-IM-Q TOF MS检测烟叶提取物的总离子流色谱图(a)和蔗糖酯选择离子流图(b~g)

图3 蔗糖酯(Ⅴ)的二级质谱图
通过碰撞诱导解离方式研究蔗糖酯类化合物的二级质谱(MS/MS)行为,以检测到的蔗糖四酯(ⅴ)为例,其二级质谱图示于图3。在二级质谱中,蔗糖四酯的O-糖苷键最易断裂,失去果糖部分的中性碎片,得到相对丰度最高的碎片离子峰[M+Na-162]+,如m/z673→511;[M+Na-162]+可进一步丢失葡萄糖上的脂肪链部分,如m/z673→511→409。此外,低丰度碎片离子m/z185来自蔗糖四酯中O-糖苷键的断裂,失去葡萄糖部分的中性碎片;信号微弱的碎片离子[M+Na-102]+,如m/z673→571,则来自蔗糖四酯的准分子离子直接丢失葡萄糖上的脂肪酸部分。
使用离子淌度分析烟草中蔗糖酯,6组蔗糖四酯在结构上的差异使它们在漂移管中的分离相差了0.4~0.5 ms,其漂移时间分离及获得的离子强度示于图4。尽管离子淌度的分辨率较常规LC的分辨能力低,使其单独分离复杂混合物变得困难,但作为一种前质量分析器,提供的二维“淌度/质荷比”(2-D IM/MS)模式能够实现对复杂混合物的高分辨分离。在2-D IM/MS中,不同离子的不同漂移时间可作为一个新的鉴定标准。此外,还可将2-D IM/MS中产生的正交分离用于谱图清理,1.5~5 min保留时间内的总离子DT与质荷比(m/z)的2-D IM/MS谱图示于图5a,在基质离子的信号强度背景下,较高信号强度的离子及其同位素斑点极易分辨。从局部放大图(图5b)可以看出,相对背景信号强度较高的6个目标组分(Ⅰ~Ⅵ)的离子及其同位素斑点更为明显,锁定目标斑点进行提取,可获得干净的单一组分的MS图、二级质谱图和IM漂移图。
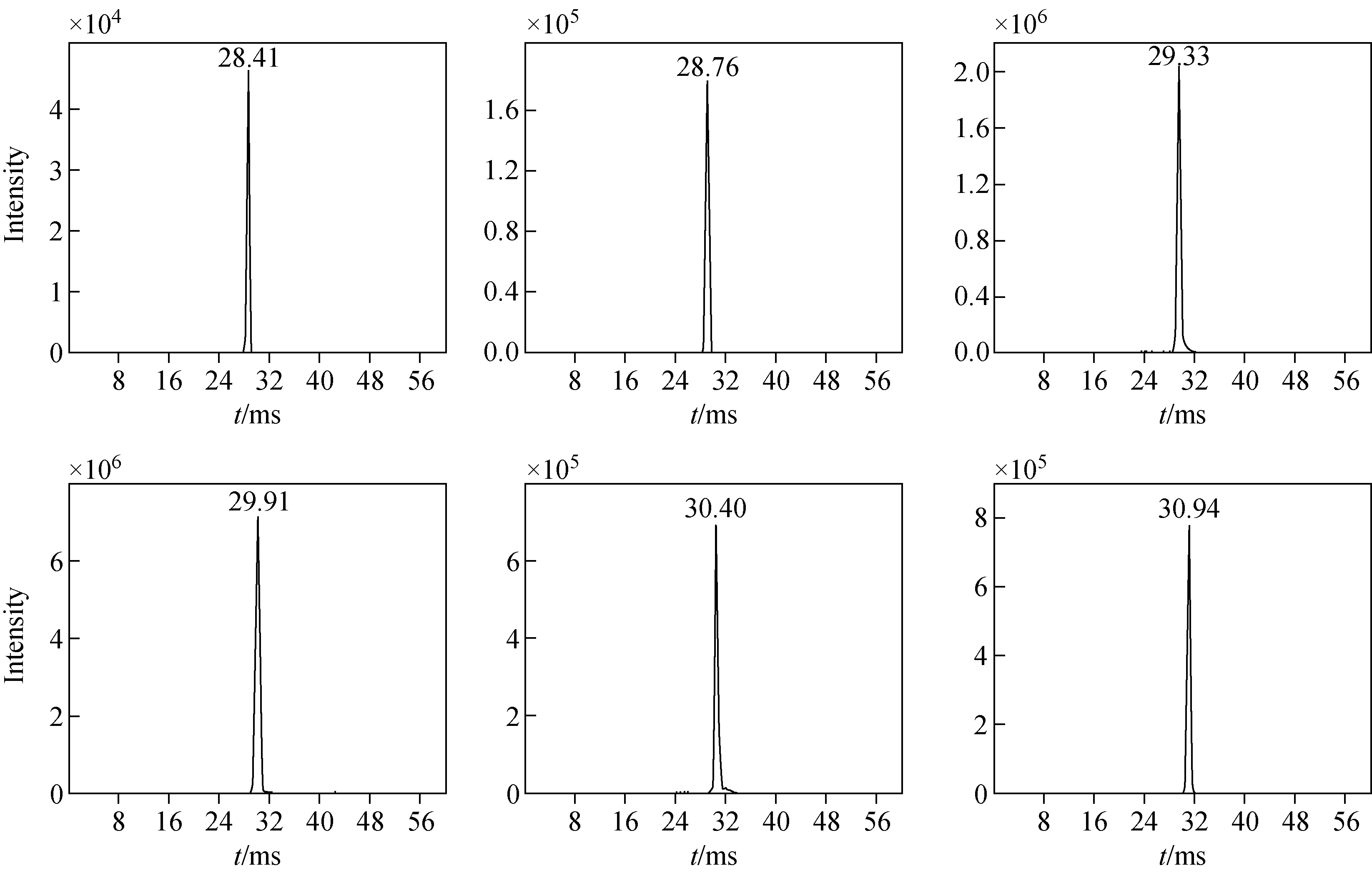
图4 蔗糖酯(Ⅰ~Ⅵ)的淌度漂移谱图
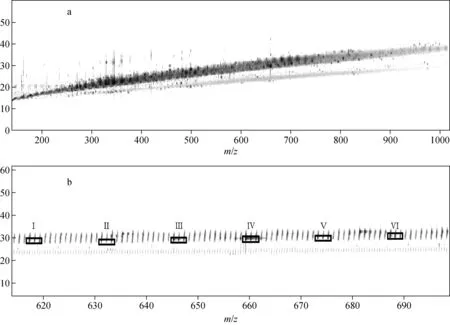
图5 蔗糖酯的2-D IM/MS全谱图(a)和局部放大图(b)
需要指出的是,图2b~2g中每个蔗糖四酯组分峰可能含有同分异构体,即分子质量相同,与葡萄糖相连的3条脂肪酸总碳数也相同,但排列组合不同。在快速分离条件下,这些可能的同分异构体无论是LC还是IM均显现出相同的保留时间和漂移时间,无法将它们有效地分离。这一问题可通过GC/MS检测结合二级特征离子提取的方法解决。依据LC-IM-Q TOF MS检测结果,归纳了烟叶提取物中可能的蔗糖酯的MS和IM信息,其结果列于表1。通过这些信息可方便快捷地对其他同系列化合物进行定性分析。

表1 烟叶提取物中蔗糖酯的分析结果
注:*参考文献[7, 27]
2.2蔗糖酯的碰撞截面积(CCS)测定
淌度分离是通过离子与漂移气体分子碰撞过程实现的,离子的碰撞截面是决定离子漂移速度的最主要因素,而漂移气体的质量数、管内气压、温度、离子质量和电荷等都直接影响分离过程。离子的碰撞截面作为离子的特征结构属性之一,如同GC中的保留指数,可以用于化合物分析中的结构判定。本研究采用IM-MS法,可以在一个分析周期中,通过设定和采集包括漂移气、离子精确质量等相关的参数,计算目标离子的CCS,原理基于Mason-Schamp公式:
(1)
其中,Ω为目标离子的CCS;e为电子的电荷;z为目标离子的电荷;kb为玻尔兹曼常数;N为漂移气体的数密度;T和P分别为漂移管内的温度和气压;V为漂移管前后端电压差;L为漂移管的长度;mgas和mion分别为漂移气和目标离子的精确质量。
利用Mason-Schamp公式计算时,环境温度、漂移气的波动、以及漂移管到检测器的距离(死长度)等都会给CCS的测定结果带来偏差。因此,本研究采用内标法,利用已知CCS的离子对相关参数进行校正,再代入式(1),从而实现蔗糖酯CCS的准确测定。整个测定过程中,只需在保留时间1.5~5 min区域内,通过喷射流电喷雾电离源的第2个喷头直接引入系列内标化合物(IS: Betaine, HP-03321, HP-0621, HP-0921),使这些内标分子与蔗糖酯同时离子化,穿过漂移管,最后被Q TOF MS检测。内标化合物及6组蔗糖酯的CCS结果列于表2。可以看出,内标化合物CCS的理论值和测定值的相对误差较小,并且其测定值的相对标准偏差(RSD)都小于0.3%,这说明内标法能够精确的校正CCS计算中的相关参数,可用于6组蔗糖酯CCS的准确测定。分析测得的蔗糖酯CCS,并结合表1可知,漂移时间长的离子,其CCS数值较大。
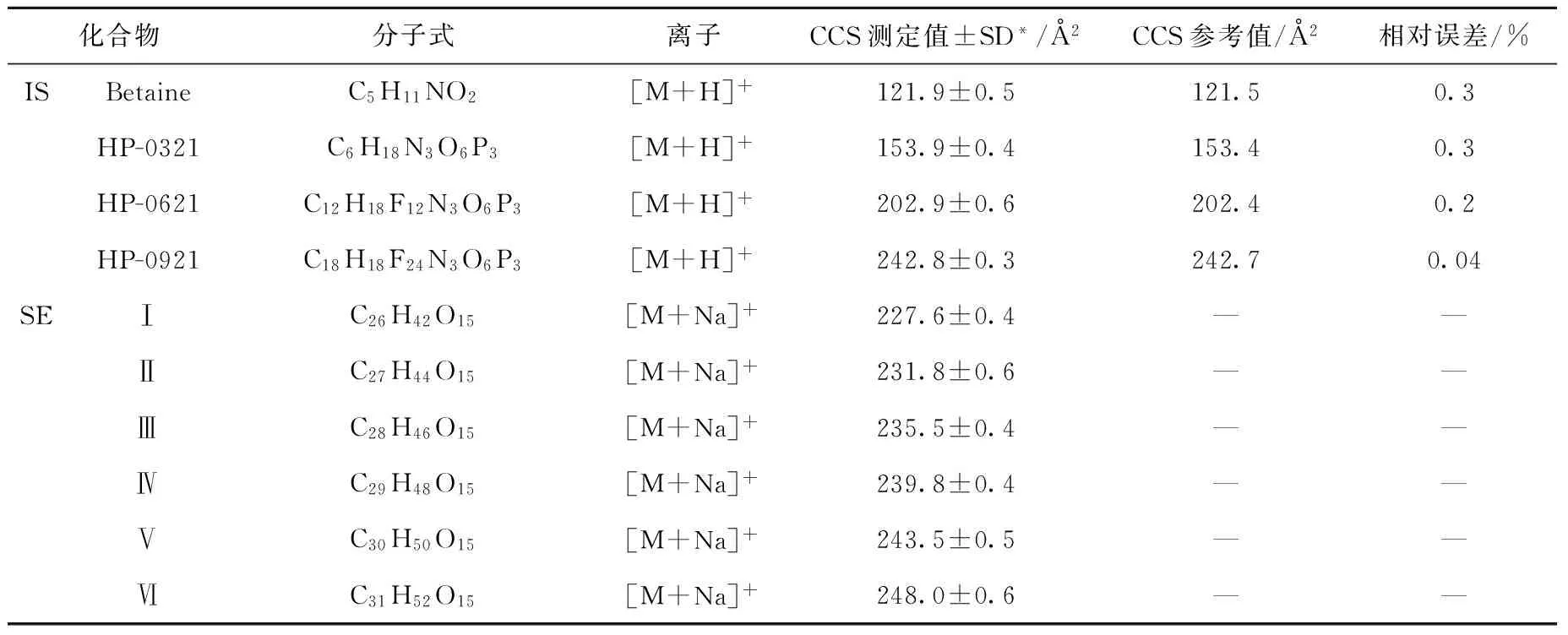
表2 烟叶中蔗糖酯的碰撞截面积测定
注:*表示平行测定3次
3结论
本研究采用LC与IM-Q TOF MS联用技术快速检测烟叶中的蔗糖酯,通过离子淌度分离和高分辨率的质量分离,共检测出烟叶中6类蔗糖四酯,它们在色谱柱上的分离相差0.2~0.8 min,在漂移管中的分离相差0.4~0.5 ms,质谱检测中的离子质量相差14 u。利用多维定性手段二级质谱解析、准分子离子的元素组成测定以及碰撞截面的测定等,可提高定性分析的准确性和效率,使定性结果更可靠。综上,LC-IM Q TOF MS法可以快速检测复杂样品中的蔗糖酯,结合多维数据定性技术能够显著提高定性分析的准确性。
参考文献:
[1]阳会兵,周清明. 烟草蔗糖酯的研究进展[J]. 作物研究,2005,(S1):370-376.
YANG Huibing, ZHOU Qingming. The research progress of sucrose ester in tobacco[J]. Crop Research, 2005, (S1): 370-376(in Chinese).
[2]王海燕,王鸿旻,刘百战,等. 烟草糖酯的分类、检测及其应用研究进展[J]. 现代食品科技,2010,26(8):866-870.
WANG Haiyan, WANG Hongmin, LIU Baizhan, et al. Advances in classification, determination and application of sucrose esters from tobacco leaves[J]. Modern Food Science and Technology, 2010, 26(8): 866-870(in Chinese).
[3]张现,程新胜,王方晓. 烟叶蔗糖酯研究进展[J]. 烟草化学,2007,(1):46-49.
ZHANG Xian, CHENG Xinsheng, WANG Fangxiao. Advances in sucrose esters in tobacco leaf[J]. Tobacco Chemistry, 2007, (1): 46-49(in Chinese).
[4]SONG Z J, LI S J,CHEN X, et al. Synthesis of insecticidal sucrose esters[J]. Forestry Studies in China, 2006, 8 (3): 26-29.
[5]KARRER R, HERBERG H. Analysis of sucrose fatty acid esters by high temperature gas chromatography[J]. Journal of High Resolution Chromatography, 1992, 15(9): 585-589.
[6]UEMATSU Y, HIRATA K, SUZUKI K, et al. Determination of sucrose esters of fatty acids in food additive premixes by gas chromatography and confirmation of identity by gas chromatography/mass spectrometry[J]. Food Composition and Additives, 2001, 84(2): 498-506.
[7]王瑞玲,王莹莹,毛多斌,等. 烟草中蔗糖四酯类化合物的GC-MS分析[J]. 化学研究与应用,2011,23(8):1 030-1 035.
WANG Ruiling, WANG Yingying, MAO Duobin, et al. Analysis of sucrose tetra-esters from tobaccos by GC-MS[J]. Chemical Research and Application, 2011, 23 (8): 1 030-1 035(in Chinese).
[8]ASHRAF-KHORASSANI M, NAZEM N, TAYLOR L T, et al. Isolation, fractionation, and identification of sucrose esters from various oriental tobaccos employing supercritical fluids[J]. Beiträge zur Tabakforschung International, 2008, 23(1): 32-45.
[9]朱金丽,李建华,孙同明,等. 蔗糖酯的HPLC-ELSD法分离与测定[J]. 精细化工,2009,26(7):633-638.
ZHU Jinli, LI Jianhua, SUN Tongming, et al. Separation and determination of sucrose esters by HPLC-ELSD[J]. Fine Chemicals, 2009, 26(7): 633-638(in Chinese).
[10]DING L, XIE F, ZHAO M, et al. Rapid characterization of the sucrose esters from oriental tobacco using liquid chromatography/ion trap mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2006, 20(19): 2 816-2 822.
[11]DING L, XIE F, ZHAO M, et al. Rapid quantification of sucrose esters in oriental tobacco by liquid chromatography-ion trap mass spectrometry[J]. Journal of Separation Science, 2007, 30(1): 35-41.
[12]MOHA M H, TANGA T S, TANB G H. Improved separation of sucrose ester isomers using gradient high performance liquid chromatography with evaporative light scattering detection[J]. Food Chemistry, 2000, 69(1): 105-110.
[13]杨勤萍,徐国梁,施邑屏,等. 高效液相色谱及薄层色谱分析蔗糖脂肪酸酯[J]. 分析测试学报,1999,18(1):28-30.
YANG Qinping, XU Guoliang, SHI Yiping, et al. Determination of sucrose fatty acid esters by HPLC and thin layer chromatography scanning[J]. Journal of Instrumental Analysis, 1999, 18(1): 28-30(in Chinese).
[14]阳会兵,周清明,杨虹琦,等. 薄层色谱扫描法测定烟叶表面蔗糖酯含量[J]. 湖南农业大学学报,2007,33(2):177-179.
YANG Huibing, ZHOU Qingming, YANG Hongqi, et al. Determination of sucrose esters on leave surface of tobacco by TLC scanning[J]. Journal of Hunan Agricultural University, 2007, 33(2): 177-179(in Chinese).
[15]李延科,张淑芬,杨锦宗. 蔗糖酯的薄层色谱分析[J]. 色谱,2002,20(5):476-478.
LI Yanke, ZHANG Shufen, YANG Jinzong. Anylysis of sucrose esters by thin-layer chromatography[J]. Chinese Journal of Chromatography, 2002, 20(5): 476-478(in Chinese).
[16]曾盔,黄才斌,黄高山,等. 油茶籽油脂肪酸蔗糖酯的合成研究[J]. 湖南农业大学学报,2006,32(3):309-312.
ZENG Kui, HUANG Caibin, HUANG Gaoshan, et al. On synthesis of sucrose esters of fatty acids of camellia oil[J]. Journal of Hunan Agricultural University, 2006, 32(3): 309-312(in Chinese).
[17]ARTAMONOV A F, ALDABERGENOVA M T, NIGMATULLINA F S, et al. Synthesis of saccharose esters[J]. Chemistry of Natural Compounds, 2000, 36(4): 345-348.
[18]FANUN M, WACHTEL E, ANTALEK B, et al. A study of the microstructure of four-component sucrose ester microemulsions by SAXS and NMR[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2001, 181(1/2): 173-186.
[19]SEVERSON R F, ARRENDALE R F, CHORTYK T, et al. Isolation and characterization of the sucrose esters of the cuticular waxes of green tobacco leaf[J]. J Agrlc Food Chem, 1985, 33(5): 870-875.
[20]MOLINIER V, FENET B, FITREMANN J, et al. PFGSE-NMR study of the self-diffusion of sucrose fatty acid monoesters in water[J]. Journal of Colloid and Interface Science, 2005, 286(1): 360-368.
[21]DAMEN C W, CHEN W, CHAKRABORTY A B, et al. Electrospray ionization quadrupole ion-mobility time-of-flight mass spectrometry as a tool to distinguish the lot-to-lot heterogeneity inN-glycosylation profile of the therapeutic monoclonal antibody trastuzumab[J]. Journal of the American Society for Mass Spectrometry, 2009, 20(11): 2 021-2 033.
[22]HOAGLUND-HYZER C S, CLEMMER D E. Ion trap/ion mobility/quadrupole/time-of-flight mass spectrometry for peptide mixture analysis[J]. Analytical Chemistry, 2001, 73(2): 177-184.
[23]GUO S, ZHANG F, WANG H Y, et al. Behaviors of leucine and isoleucine in ion mobility-quadrupole time of flight mass spectrometry[J]. Chinese Journal of Chemistry, 2015, 33(12): 1 359-1 364.
[24]姜杰,宋庆浩,林静,等. 离子淌度谱技术[J]. 科学仪器与装置,2008,(2):74-78.
JIANG Jie, SONG Qinghao, LIN Jing. Ion mobility spectrometry[J]. Scientific Instrument and Equipment, 2008, (2): 74-78(in Chinese).
[25]许峰,王海龙,关亚风. 离子迁移谱研究进展[J]. 化学进展,2005,17(3):514-522.
XU Feng, WANG Hailong, GUAN Yafeng. Progress in ion mobility spectrometry[J]. Progress in Chemistry, 2005, 17(3): 514-522(in Chinese).
[26]WANG H Y, ZHANG J T, SUN S H, et al. Study on the accelerated Gutknecht self-cyclocondensation of amino-sugars under atmospheric pressure chemical ionization conditions[J]. RSC Advances, 2015, 5(127): 105 079-105 083.
[27]ZHANG F, GUO S, ZHANG M Y, et al. Characterizing ion mobility and collision cross section of fatty acids using electrospray ion mobility mass spectrometry[J]. Journal of Mass Spectrometry, 2015, 50(7): 906-913.
[28]ZHANG W, QUERNHEIM M, RDER H J, et al. Collision-induced dissociation ion mobility mass spectrometry for the elucidation of unknown structures in strained polycyclic aromatic hydrocarbon macrocycles[J]. Analytical Chemistry, 2016, 88(1): 952-959.
[29]ALLEN S J, SCHWARTZ A M, BUSH M F. Effects of polarity on the structures and charge states of native-like proteins and protein complexes in the gas phase[J]. Analytical Chemistry, 2013, 85(24):12 055-12 061.
[30]ZHONG Y Y, FENG J, RUOTOLO B T. Robotically assisted titration coupled to ion mobility-mass spectrometry reveals the interface structures and analysis parameters critical for multiprotein topology apping[J]. Analytical Chemistry, 2013, 85(23): 11 360-11 368.
[31]VAHIDI S, STOCKS B B, KONERMANN L. Partially disordered proteins studied by ion mobility-mass spectrometry: Implications for the preservation of solution phase structure in the gas phase[J]. Analytical Chemistry, 2013, 85(21): 10 471-10 478.
[32]JIA C X, CHRISTOPHER B, LI L J, et al. Site-specific characterization of (D)-amino acid containing peptide epimers by ion mobility spectrometry[J]. Analytical Chemistry, 2013, 86(6): 2 972-2 981.
[33]GAYE M M, NAGY G, CLEMMER D E, et al. Multidimensional analysis of 16 glucose isomers by ion mobility spectrometry[J]. Analytical Chemistry, 2016, 88(4): 2 335-2 344.
[34]ASHRAF-KHORASSANI M, NAZEM N, TAYLOR L T, et al. Identification and quantification of sucrose esters in various turkish tobaccos[J]. Contributions to Tobacco Research, 2005, 21(8): 441-450.
收稿日期:2015-12-31;修回日期:2016-03-16
作者简介:范若静(1988—),女(汉族),山东菏泽人,博士研究生,有机质谱专业。E-mail: fanrj@sioc.ac.cn 通信作者:郭寅龙(1962—),男(回族),河南开封人,研究员,从事有机质谱研究。E-mail: ylguo@sioc.ac.cn
中图分类号:O657.63
文献标志码:A
文章编号:1004-2997(2016)04-0301-09
doi:10.7538/zpxb.youxian.2016.0029
Fast Detection of Sucrose Esters in Tobacco Leaf Using Liquid Chromatography Coupled with Ion Mobility-Quadrupole/Time of Flight Mass Spectrometry
FAN Ruo-jing, CHEN Xiu-ping, ZHANG Fang, ZHANG Jing, GUO Yin-long
(StateKeyLaboratoryofOrgan-metallicChemistryandNationalCenterforOrganicMassSpectrometryinShanghai,ShanghaiInstituteofOrganicChemistry,ChineseAcademyofSciences,Shanghai200032,China)
Abstract:Ion mobility spectrometry combined with mass spectrometry (IM-MS) has grown in popularity as a powerful analytical technique. IM is capable of separating ionized molecules in the gas phase based on their mobility in a carrier buffer gas, whereas MS is effective to measure the weight of these ions. It brings a two-dimensional correlation spectrum to obtain the relationship between the ratios of shape-to-charge from IM and the ratios of mass-to-charge (m/z) from MS. The ability to analyze a wide range of compounds makes IM-MS a valuable tool for an analytical research laboratory, which is often used to perform difficult qualitation that are not possible by other methods. Sucrose esters (SEs), as one of the major chemical compositions of tobacco leaves, are generated from one or more hydroxyl sucroses esterified with fatty acids. Research on SEs is paid more attention because of its responsibility for tobacco flavor. More than this, they are considered to be important in plant or insect interactions and possess both antibiotic and plant-growth regulating activities. Due to the complexity of esterification, the number and position of the acetyl groups in SE varies, there are a few of studies about the analysis of SEs that have been reported using GC/MS or LC/MS. But it is still difficult to characterize their structures in lack of the standard references. So it is valuable to improve the qualitative analysis of SEs in tobacco leaves. In this work, SEs in tobacco leaves were fast detected by liquid chromatography coupled with ion mobility-quadrupole/time of flight tandem mass spectrometry (LC-IM-Q TOF MS). The experiment was performed using an eluent of 0.1% formic acid in methanol-water (80∶20, V/V), and the electrospray ionization technique in positive ion mode was adopted. The sodium added quasi molecular ions of SEs from the extract of tobacco leaves were formed, separated in the ion mobility drift tube, and eventually detected by quadrupole/time-of-flight tandem mass spectrometry. As a result, six kinds of SEs were detected, with the difference of 0.2-0.8 min in LC retention time, the difference of 0.4-0.5 ms in IM drift time, and the difference of 14 u in MS ion mass. Furthermore, the SEs were identified using a multidimensional qualitative analysis approach consisting of MS/MS spectra, measurement of elemental composition for quasi molecular ion, and the calculation of CCS. In conclusion, LC-IM-Q TOF MS was proved to be one of the most efficient tools for the fast detection of SEs in complex matrices. It could improve the accuracy of qualitative analysis when coupled with the multidimensional qualitative approach.
Key words:liquid chromatography coupled with ion mobility-quadrupole/time of flight mass spectrometry (LC-IM-Q TOF MS); sucrose esters; qualitative analysis; tobacco leaf
网络出版时间:2016-07-05;网络出版地址:http:∥www.cnki.net/kcms/detail/11.2979.TH.20160705.1346.018.html
