电针对7月龄APP/PS1双转基因鼠行为学及海马微血管壁Ab沉积影响的研究
2016-08-01高堂珂步青云高杨王鑫高誉珊毛颖秋薛卫国北京中医药大学北京100029
高堂珂,步青云,高杨,王鑫,高誉珊,毛颖秋,薛卫国(北京中医药大学,北京 100029)
电针对7月龄APP/PS1双转基因鼠行为学及海马微血管壁Ab沉积影响的研究
高堂珂,步青云,高杨,王鑫,高誉珊,毛颖秋,薛卫国
(北京中医药大学,北京 100029)
【摘要】目的通过观察电针对APP/PS1双转基因小鼠海马微血管壁Ab沉积及学习记忆能力的影响,探讨电针治疗阿尔茨海默病(AD)的一种作用机制,即改善Ab的脑微血管清除途径。方法将24只7月龄雄性APP/PS1双转基因鼠随机分为模型组、电针治疗组,各12只,以同窝同性别的转基因阴性小鼠(12只)为空白对照组。电针治疗组电针百会、涌泉,每次15 min,隔日1次,共6星期。治疗后,以Morris水迷宫检测小鼠空间学习记忆能力,以免疫组化法检测Ab1-40、Ab1-42在海马脑微血管壁和老年斑的表达,使用Imagine Pro Plus软件对海马脑微血管壁Ab的阳性表达进行半定量分析。结果Morries水迷宫结果显示,与空白对照组相比,模型组逃避潜伏时延长(P<0.05);穿越平台次数及平台象限内游泳时间均减少(P<0.05)。与模型组相比,电针治疗组逃避潜伏时变短(P<0.05),穿越平台次数和平台象限内游泳时间均增加(P<0.05)。免疫组化结果显示,模型组海马微血管壁Ab1-42、Ab1-40积分光密度均高于空白对照组(P<0.05),且海马内出现老年斑。电针治疗组海马微血管壁Ab1-42、Ab1-40积分光密度均低于模型组(P<0.05)。结论电针改善了小鼠学习记忆损害,减轻了海马微血管壁Ab沉积,其机制可能是通过改善Ab的脑微血管清除途径,从而降低脑内Ab沉积实现的。
【关键词】电针;阿尔茨海默病;海马微血管壁;b淀粉样蛋白;APP/PS1双转基因鼠
阿尔茨海默病(Alzheimer's disease,AD)是一种以进行性认知功能障碍为特征的中枢神经系统退行性病变。Ab级联学说为当下最为认可的AD发病机制,即b-淀粉样蛋白脑内生成、聚集、沉积形成淀粉样斑块(老年斑),并产生神经毒性造成患者脑内的一系列病理学变化和临床症状[1]。
脑内Ab主要以两种结构形式存在,Ab1-40和Ab1-42,其在脑内过量沉积会造成认知功能损害[2-3]。正常状态下Ab在脑内的产生和清除之间存在着动态平衡,Ab可从脑实质内(brain interstitial fluid, ISF)不断地被清除,而在脑内保持正常水平不会出现神经毒性。
研究表明占AD发病95%左右的晚发性AD患者是以脑内Ab清除异常为主。近年来,在Ab的多种清除途径中,由于脑血管淀粉样变与AD病理变化间千丝万缕的联系,Ab的脑血管清除途径成为目前的研究热点[4-5]。在脑血管清除途径中,Ab可通过脑微血管的一种饱和转运系统(saturable efflux system)进行大量快速的转运,即跨血脑屏障转运[6]。因此脑微血管血脑屏障成为Ab脑血管清除途径机制研究的靶点[7-8]。在动物实验中,若脑微血管清除Ab的功能出现障碍,Ab将会沉积于脑微血管壁,并进一步破坏脑微血管Ab清除途径,导致脑内Ab水平升高、沉积、聚集,并在脑实质内生成淀粉样斑块(老年斑),产生神经毒性导致学习记忆能力的下降[9]。因此脑微血管壁的Ab沉积现象是Ab脑微血管清除途径障碍的重要指标。
本研究团队在过去实验中发现电针百会、涌泉能够改善APP/PS1双转基因小鼠认知功能障碍,并使用elise检测到其脑内Ab水平降低[10]。故猜测电针对AD的治疗机制可能是通过改善Ab的脑微血管清除途径,使脑内Ab水平降低实现的。因此本实验将观察电针百会、涌泉穴对AD小鼠模型学习记忆能力和海马脑微血管壁Ab1-40、Ab1-42沉积现象的影响,探讨电针治疗AD的一种作用机制,即改善Ab的脑微血管清除途径。
1 材料与方法
1.1动物模型分组及干预方法
选取24只6月龄健康的APP/PS1双转基因雄性小鼠为AD动物模型,随机分为模型组12只、电针治疗组12只。以同窝同月龄的转基因阴性鼠12只作为空白对照组。所有动物全部从南京大学模式动物研究所购入。批号为SCXK(宁)2010-000。体重(33.20±3.87)g。实验经北京中医药大学实验动物伦理委员会批准。
电针治疗组,将该组小鼠俯卧位固定于自制鼠板上(见图1),对比动物解剖及针灸图谱,两耳尖的中点取百会,在足底前、中1/3交界处取涌泉。针刺百会,电针双侧涌泉穴,平刺2~3 mm,采用疏密波,频率1/50 Hz,强度0.1 mA,电针强度以针柄微微颤动、小鼠不嘶叫挣扎为度。每次电针治疗15 min,隔日1次,共治疗6星期。模型组、正常对照组以相同方法用自制鼠袋束缚15 min,隔日1次,共束缚6星期。

图1 电针治疗方法与自制鼠袋束缚方法
1.2主要试剂和仪器
Ab1-42兔多克隆抗体(美国Abcam,货号ab10148); Ab1-40兔多克隆抗体(北京博奥森生物技术有限公司,货号bs-0877R);免疫组化超敏试剂盒(兔)(迈新生物科技,批号KIT-9706;一次性使用无菌针灸针(0.25 mm ×13 mm,中研太和牌);韩氏穴位神经刺激仪(北京华卫产业开发公司,HANs LH202H型);Morris水迷宫(BS-124S Morris型水迷宫,由北京中医药大学附属东直门中医院中药药理学实验室提供,视频分析系统为上海移动信息科技有限公司生产)等。
1.3学习记忆能力检测方法
以Morries水迷宫作为行为学检测的实验装置,在小鼠治疗6星期后开始进行水迷宫实验。水池共分为4个象限。水池第三象限内放一圆形平台,水面高出平台1 cm。水池内水温保持在(22±2)℃。实验前将各组小鼠置于平台上10 s以熟悉周围环境。第1、2、3、4天进行定位航行实验,依次按1、2、3、4象限的顺序将小鼠面避置入池中。小鼠登上平台5 s后停止计时,若未登上平台则按60 s计,记录4个象限小鼠放入池中到登上平台后所需要的时间,取其平均值为定位航行实验的逃避潜伏时。第5天进行空间探索实验,即撤去平台,直接将小鼠按1、2、3、4象限顺序依次放入池中,记录小鼠60 s内穿越平台位置的次数和在第3象限游泳时间。最后以逃避潜伏时,穿越平台次数和第3象限游泳时间作为评判小鼠学习记忆能力指标。
1.4脑组织取材及Ab1-42和Ab1-40免疫组化实验方法
每组随机取6只小鼠,以10%水合氯醛(3 mL/kg)进行腹腔注射麻醉。麻醉成功后以肝素化生理盐水和多聚甲醛各40 mL经左心室快速灌注,待小鼠尾部翘起后,开颅取脑,放入4%多聚甲醛中固定24 h。
取固定好的大脑,流水冲洗后修块,石蜡包埋,从视交叉处开始向后行片厚6mm的冠状切片,选取海马结构完整且呈水平位的切片进行Ab1-42、Ab1-40免疫组化ABC法检测。免疫组化染色的具体步骤为切片脱蜡水化;0.3%甲醇双氧水室温10 min;0.01 mol/L的枸橼酸盐缓冲液热修复抗原10 min;15%正常羊血清37℃室温下封闭30 min;滴加一抗Ab1-42、Ab1-40抗体(均以1:100稀释),4℃,36 h;PBS洗;生物素化二抗37℃,90 min;PBS洗;AB复合物37℃,90 min;PBS洗; DAB显色;脱水、透明、封片。以PBS取代一抗作为阴性对照。使用Leica系统相连接的DXM1200相机采集切片图像。
本次半定量共18只小鼠,取每只小鼠1张染色后切片,使用Leica图像采集系统,在400倍放大下采集小鼠海马内3个视野拍照,采集图片后,利用Imagine Pro Plus软件圈出图片内脑微血管,计算出每张图片脑微血管壁Ab积分光密度总和,取每只动物所有图片微血管壁Ab积分光密度的平均数,用此数据表示Ab1-40和Ab1-42在每只动物脑微血管壁的表达强度,并进行统计学分析。
1.5统计学方法
采用SPSS20.0统计学软件进行数据分析,所有数据均用均数±标准差表示。Morries水迷宫实验逃避潜伏期、穿越目标象限次数、第3象限游泳时间计算平均值后保存小数点后两位[11]。分析观察电针治疗组、模型组、空白对照组3组间逃避潜伏期在Morries水迷宫实验1~4天的变化,该数据产生条件符合被试对象在接受不同处理后,对同一因变量(即测试指标)在不同时间点上进行多次测量所得资料(重复测量资料),故采用多组重复测量设计资料方差分析(ANOVA)[12]。穿越目标象限次数、第3象限游泳时间、Ab1-40和Ab1-42积分光密度采用单因素方差分析(one-way ANOVA),使用LSD检验对各组件进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1Morries水迷宫行为学检测结果
从表1中可知,随着训练天数的增加,各组逃避潜伏时不断减少。多组重复测量设计资料方差分析可知,3组逃避潜伏时组间比较差异有统计学意义(P<0.05)。模型组逃避潜伏时长于空白对照组(P<0.05)。电针治疗组逃避潜伏时短于模型组(P<0.05)。
表1 各组小鼠Morries水迷宫逃避潜伏时比较(±s,s)

表1 各组小鼠Morries水迷宫逃避潜伏时比较(±s,s)
注:与空白对照组比较1)P<0.05;与模型组比较2)P<0.05;与同组第1天比较3)P<0.05
组别 n 第1天 第2天 第3天 第4天空白对照组 12 58.87±2.78 58.17±3.99 54.70±6.06 52.60±7.443)模型组 12 59.93±0.38 60.04±0.00 59.07±1.621)59.01±1.953)电针治疗组 12 59.81±0.59 59.26±2.69 56.12±6.072)53.15±6.273)
根据穿越平台次数和平台象限内游泳时间单因素ANOVA分析结果可知,各组间两项指标均具有统计学差异(P<0.05)。模型组穿越平台次数及第3象限游泳时间均低于空白对照组(P<0.05)。电针治疗组穿越平台次数及第3象限内游泳时间均高于模型组(P<0.05)。详见表2。
表2 各组小鼠Morries水迷宫空间探索实验第4象限入水点穿越平台次数,第3象限游泳时间比较 (±s)

表2 各组小鼠Morries水迷宫空间探索实验第4象限入水点穿越平台次数,第3象限游泳时间比较 (±s)
注:与空白对照组比较1)P<0.05;与模型组比较2)P<0.05
组别 n 穿越平台位置次数(次)平台象限游泳时间(s)空白对照组 12 1.45±0.97 14.19±5.21模型组 12 0.49±0.631) 8.24±3.731)电针治疗组 12 0.90±0.512) 11.33±3.192)
2.2Ab免疫组化检测结果
2.2.1各组海马脑微血管壁Ab1-42及其老年斑表达情况
图2所示,Ab1-42主要在海马微血管壁,锥体细胞、颗粒细胞及老年斑内呈阳性表达。模型组海马内可见老年斑,老年斑呈核心致密型。老年斑邻近的脑微血管壁Ab阳性表达更加明显;电针治疗组海马微血管壁Ab1-42阳性表达较模型组弱,且老年斑数量和面积少于模型组。空白对照组海马内未见老年斑出现,脑微血管壁周围Ab1-42仅有极其微弱的阳性表达。
由表3可知,各组间海马脑微血管壁Ab1-42积分光密度IOD具有统计学差异(P<0.05)。模型组海马脑微血管壁IOD大于空白对照组(P<0.05),电针治疗组海马脑微血管壁IOD小于模型组(P<0.05)。
表3 各组小鼠海马脑微血管壁Ab1-42积分光密度(IOD)比较(±s)
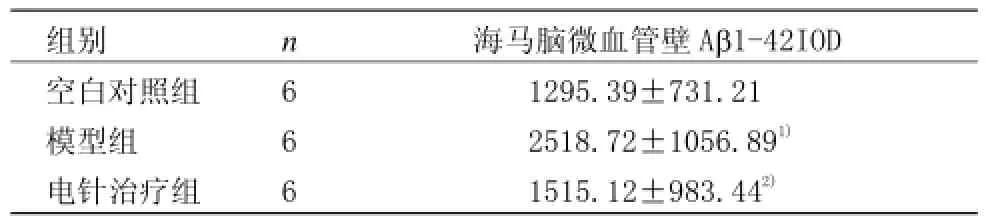
表3 各组小鼠海马脑微血管壁Ab1-42积分光密度(IOD)比较(±s)
注:与空白对照组比较1)P<0.05;与模型组比较2)P<0.05
组别 n 海马脑微血管壁Ab1-42IOD空白对照组 6 1295.39±731.21模型组 6 2518.72±1056.891)电针治疗组 6 1515.12±983.442)
2.2.2各组海马脑微血管壁Ab1-40及其老年斑表达情况
图3所示,Ab1-40在海马微血管壁表达最明显,锥体细胞、颗粒细胞及老年斑内也有阳性表达。模型组海马内出现多个老年斑,Ab1-40在老年斑内围绕着核心出现阳性表达,并在周围出现散在阳性表达;电针治疗组Ab1-40在脑微血管阳性表达降低,海马内老年斑数量及面积明显减少,核心斑块周围Ab1-40阳性表达变浅,老年斑周围微血管壁Ab1-40阳性表达亦变浅;空白对照组海马内未见老年斑,脑微血管壁Ab1-40阳性表达极其微弱。由表4可知,各组间海马脑微血管壁Ab1-40积分

图2 海马微血管壁Ab1-42及其老年斑表达情况(免疫组化Í400)
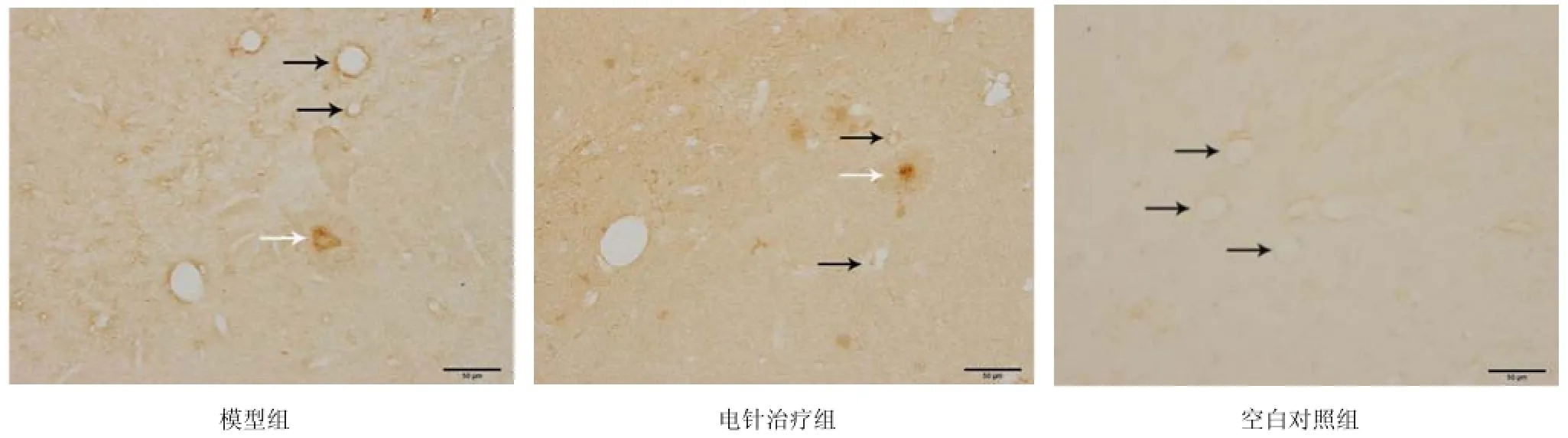
图3 海马微血管壁Ab1-40及其老年斑表达情况(免疫组化Í400)
光密度IOD具有统计学差异(P<0.05)。两两比较可知,模型组海马脑微血管壁IOD大于空白对照组(P<
0.05),电针治疗组海马脑微血管壁IOD小于模型组(P
<0.05)。
表4 各组小鼠海马脑微血管壁Ab1-40积分光密度(IOD)比较(±s)

表4 各组小鼠海马脑微血管壁Ab1-40积分光密度(IOD)比较(±s)
注:与空白对照组比较1)P<0.05;与模型组比较2)P<0.05
组别 n 海马脑微血管壁Ab1-40IOD空白对照组 6 1435.91±574.76模型组 6 5062.05±1482.021)电针治疗组 6 1954.89±1256.522)
3 讨论
在AD病理过程中,大脑神经血管功能的衰退会导致神经血管解偶联,发生血管退化,影响了血脑屏障脑微血管的功能,导致其对Ab的清除功能障碍,使脑内Ab水平不断升高,沉积形成老年斑,产生神经毒性,最终使认知功能下降。脑微血管主要通过两条途径清除脑内Ab,由血脑屏障主动转运受体介导的Ab清除途径[13]。脑血管周隙的Ab清除途径。无论哪条脑微血管Ab清除途径出现障碍,都会导致脑间质及微血管壁出现Ab沉积[14-15]。在脑内与AD病理相关的Ab主要有两种,Ab1-40与Ab1-42。脑内的Ab1-40约占80%~90%; Ab1-42约占10%~20%,二者共存于老年斑中[16]。其在脑内过量沉积、聚集时,都会导致认知功能障碍[2-3,17]。为了最真实模拟Ab在脑内的AD病理变化,本实验选用了近年来公认度较高的AD病理动物模型APP/PS1双转基因小鼠[18]。该小鼠模型导入了具有瑞典型突变位点(Swedish KM594/595NL)的人鼠嵌合型APP基因(Mo/Hu APP695)和具有第9外显子(dE9)突变的人PS1基因,这两种基因共同作用,使Ab在该小鼠脑内产生和沉积加速[19]。研究表明,6月龄双转基因小鼠海马内已经出现能够检测到的老年斑和少量脑血管淀粉样变[20-21]。故本研究选取6月龄小鼠进行实验。根据本实验免疫组化结果,两种Ab均在模型组脑微血管壁出现阳性表达,在其海马内发现老年斑,且模型组与空白对照组相比已出现学习记忆障碍,这与前述研究结果相符。本实验在空白对照组的海马椎体细胞与颗粒细胞内也发现阳性表达,这也许是由于使用的抗体存在抗鼠Ab的原因。有研究表明,Ab在脑微血管壁沉积既是微血管清除障碍的结果也可能是其诱因[22],当Ab在脑微血管壁沉积后,将会对微血管结构造成破坏,如使微血管壁变薄和管腔的狭窄与弯曲,引起周细胞、内皮细胞以及血管平滑肌细胞的死亡[23],因此Ab在海马微血管壁沉积可能加重脑微血管清除途径障碍,进一步加剧脑内Ab沉积和认知功能障碍,这可能是本实验在模型组及电针治疗组海马中可见距离淀粉样老年斑块较近的微血管壁Ab1-42和Ab1-40的阳性表达更明显的原因。
根据以往针刺对阿尔茨海默病治疗的研究结果,电针可改善APP/PS1双转基因小鼠学习记忆能力损害,降低其认知功能的损害和促进神经元的再生[24-25],本团队以前研究中也发现电针能够降低7月龄小鼠脑内Ab的水平[10]。结合本次实验结果,电针治疗组与模型组相比脑微血管壁Ab1-40和1-42的表达明显减弱,脑实质内老年斑数量和面积减少,且学习记忆能力改善。说明电针通过影响脑微血管清除途径,降低脑内Ab水平,改善学习记忆能力损害。
综上,从电针能够改善小鼠脑微血管壁的Ab1-40、1-42的沉积及学习记忆能力,可以说明电针治疗AD可能是通过一种机制,即恢复脑微血管对Ab的清除能力。清除脑实质内过量沉积的Ab,减轻其神经毒性,从而改善AD学习记忆损害的病理性变化。该机制可能是电针治疗阿尔茨海默病早期学习记忆损害的重要机制。
参考文献
[1]Rosenkranz SC,Geissen M,Härter K,et al.Amyloid-precursorprotein-lowering small molecules for disease modifying therapy of Alzheimer’s disease[J].PLoS One,2013,8(12):e82255.
[2]Baranello RJ,Bharani KL,Padmaraju V,et al.Amyloid-beta protein clearance and degradation(ABCD)pathways and their role in Alzheimer’s disease[J].CurrAlzheimer Res,2015,12(1):32-46.
[3]Bitting L,Naidu A,Cordell B,et al.Beta-amyloid peptide secretion by a microglial cell line is induced by beta-amyloid-(25-35)and lipopolysaccharide[J].J Biol Chem,1996,271(27):16084-16089.
[4]Masters CL,Simms G,Weinman NA,et al.Amyloid plaque core protein in Alzheimer disease and Down syndrome[J].Proc Natl Acad Sci USA,1985,82(12):4245-4249.
[5]Kumar-Singh S.Hereditary and sporadic forms of abeta-cerebrovascular amyloidosis and relevant transgenic mouse models[J].Int J Mol Sci,2009,10(4):1872-1895.
[6]Monro OR,Mackic JB,Yamada S,et al.Substitution at codon 22 reduces clearance of Alzheimer’s amyloid-beta peptide from the cerebrospinal fluid and prevents its transport from the central nervous system into blood[J].NeurobiolAging,2002,23(3):405-412.
[7]Sutcliffe JG,Hedlund PB,Thomas EA,et al.Peripheral reduction of b-amyloid is sufficient to reduce brainb-amyloid:implications for Alzheimer’s disease[J].J Neurosci Res,2011,89(6):808-814.
[8]András IE,Toborek M.Amyloid beta accumulation in HIV-1-infected brain:The role of the blood brain barrier[J].IUBMB Life,2013,65 (1):43-49.
[9]Xu W,Xu F,Anderson ME,et al.Cerebral microvascular rather than parenchymal amyloid-bprotein pathology promotes early cognitive impairment in transgenic mice[J].J Alzheimers Dis,2014,38(3): 621-632.
[10]李芙,李丽娜,王鑫,等.电针“百会”“涌泉”对APP/PS 1双转基因小鼠海马b淀粉样蛋白及低密度脂蛋白受体相关蛋白-1水平的影响[J].针刺研究,2015,40(1):31-34.
[11]王鑫,加吾拉·阿不力孜,李芙,等.电针对APP/PS1双转基因小鼠行为学及皮层Ab1-42、LRP1表达的影响[J].中华中医药杂志, 2015,30(5):1513-1518.
[12]邱宏,金国琴,金如锋,等.水迷宫重复测量数据的方差分析及其在SPSS中的实现[J].中西医结合学报,2007,5(1):101-105.
[13]Kanekiyo T,Bu G.The low-density lipoprotein receptor-related protein 1 and amyloid-bclearance in Alzheimer’s disease[J].Front Aging Neurosci,2014,6:93.
[14]Jeynes B,Provias J.The case for blood-brain barrier dysfunction in the pathogenesis of Alzheimer’s disease[J].J Neurosci Res,2011,89 (1):22-28.
[15]Gosselet F,Candela P,Cecchelli R,et al.Role of the blood-brain barrier in Alzheimer’s disease[J].Med Sci(Paris),2011,27(11): 987-992.
[16]LaFerla FM,Green KN,Oddo S.Intracellular amyloid-beta in Alzheimer’s disease[J].Nat Rev Neurosci,2007,8(7):499-509.
[17]Xiong H,Callaghan D,Wodzinska J,et al.Biochemical and behavioral characterization of the double transgenic mouse model (APPswe/PS1dE9)of Alzheimer’s disease[J].Neurosci Bull,2011,27 (4):221-232.
[18]朱娬,陈静,秦红芳,等.APP/PS1双转基因老年性痴呆小鼠早期病理和认知行为变化[J].广州中医药大学学报,2012,29(2):193-196.
[19]Jankowsky JL,Fadale DJ,Anderson J,et al.Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo:evidence for augmentation of a 42-specific gamma secretase[J].Hum Mol Genet,2004,13(2):159-170.
[20]Lee JE,Han PL.An update of animal models of Alzheimer disease with a reevaluation of plaque depositions[J].Exp Neurobiol,2013,22 (2):84-95.
[21]Garcia-Alloza M,Robbins EM,Zhang-Nunes SX,et al.Characterization of amyloid deposition in the APPswe/PS1dE9 mouse model of Alzheimer disease[J].Neurobiol Dis,2006,24(3):516-524.
[22]Lesne SE.Toxic oligomer species of amyloid-bin Alzheimer’s disease,a timing issue[J].Swiss Med Wkly,2014,144:w14021.
[23]Weller RO1,Subash M,Preston SD,et al.Perivascular drainage of amyloid-beta peptides from the brain and its failure in cerebral amyloid angiopathy and Alzheimer’s disease[J].Brain Pathol,2008, 18(2):253-266.
[24]许安萍,唐银杉,陈万顺,等.不同电针刺激对SAMP8小鼠学习记忆能力及大脑皮层APP、ApoE mRNA表达的影响[J].针灸临床杂志, 2014,30(2):62-65.
[25]Li X,Guo F,Zhang Q,et al.Electroacupuncture decreases cognitiveimpairmentandpromotesneurogenesisintheAPP/PS1 transgenic mice[J].BMC ComplementAltern Med,2014,14:37.
【中图分类号】R2-03
【文献标志码】A
DOI:10.13460/j.issn.1005-0957.2016.04.0472
文章编号:1005-0957(2016)04-0472-05
收稿日期2015-08-20
基金项目:国家自然科学基金项目(81273826);北京中医药大学研究生自主课题(2015-JYB-XS-122)
作者简介:高堂珂(1988-),男,2013级硕士生,Email:gaotangke@163. com
通信作者:薛卫国(1968-),男,副教授,硕士生导师,研究方向为针刺治疗阿尔茨海默症的机理研究,Email:snowmanxue@163.com
Effect of Electroacupuncture on Behaviours and Hippocampal Microvascular AbDeposition in 7-month-old APP/PSI Double Transgenic Mice
GAO Tang-ke,BU Qing-yun,GAO Yang,WANG Xin,GAO Yu-shan,MAO Ying-qiu,XUE Wei-guo.
Beijing University of Traditional Chinese Medicine,Beijing 100029,China
[Abstract]ObjectiveTo explore one mechanism of therapeutic action of electroacupuncture on Alzheimer’s disease(AD), that is,improving the way to eliminate cerebral microvascular Abby investigating the effect of electroacupuncture on hippocampal microvascular Abdeposition and learning and memory abilities in APP/PSI double transgenic mice.Method Twenty-four 7-month-old male APP/PSI double transgenic mice were randomized into model and electroacupuncture groups, 12 mice each.Same sex transgene-negative littermate mice(12 mice)constituted a blank control group.The electroacupuncture group received electric acupuncture at points Baihui(GV20)and Yongquan(KI1),15 min once every other day,for a total of six weeks.After treatment,mouse learning and memory abilities were tested using the Morris water maze.The expressions of Ab1-40 and Ab1-42 in the hippocampal microvascular wall and senile plaque were determined by immunohistochemical method. Hippocampal microvascular Ab-positive expression was semi-quantitatively analyzed using the Imagine Pro Plus software.Result The Morris water maze test showed that escape latency lengthened(P<0.05),and the number of crossing platform and swimming time in the platform quadrant decreased(P<0.05)in the model group compared with the blank control group.Escape latency shortened(P<0.05),and the number of crossing platform and swimming time in the platform quadrant increased(P<0.05)in the electroacupuncturegroupcomparedwiththemodelgroup.Theimmunohistochemicalresultsshowedthat hippocampal microvascular Ab1-42 and Ab1-40 integral optical densities were higher in the model group than in the blank control group(P<0.05)and senile plaques appeared in the hippocampus.Hippocampal microvascular Ab1-42 and Ab1-40 integral optical densities were lower in the in the electroacupuncture group than in the model group(P<0.05).ConclusionElectroacupuncture reduces mouse learning and memory impairments and hippocampal microvascular Abdeposition.Its mechanism may be that electroacupuncture improves the way of eliminating cerebral microvascularAbto decrease cerebralAbdeposition.
[Key words]Electroacupuncture;Alzheimer disease;Hippocampal microvascular wall;Amyloidb-protein;APP/PSI double transgenic mice
