哲罗鲑胰岛素样生长因子-I(IGF-I)cDNA分子克隆、序列分析及组织表达
2016-07-28王晓玉徐黎明赵景壮曹永生尹家胜
王晓玉,纪 锋,徐黎明,赵景壮,刘 淼,曹永生,尹家胜
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨 150070;2.上海海洋大学水产与生命学院,上海 201306)
哲罗鲑胰岛素样生长因子-I(IGF-I)cDNA分子克隆、序列分析及组织表达
王晓玉1,2,纪锋1,2,徐黎明1,赵景壮1,刘淼1,曹永生1,尹家胜1
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
摘要:采用逆转录聚合酶链式反应(RT-PCR)方法,从哲罗鲑(Hucho taimen)肝脏的总RNA中扩增出胰岛素样生长因子-I(IGF-I)的cDNA开放阅读框(Open reading frame,ORF)序列,运用软件对其进行生物信息学分析,并利用荧光实时定量PCR技术检测了哲罗鲑成鱼不同组织中IGF-I mRNA的表达情况。结果显示,IGF-I 基因的cDNA开放阅读框为573 bp,编码190个氨基酸,蛋白质等电点为9.21,氨基酸结构由信号肽、B、C、A、D结构域及E肽组成;氨基酸序列与其他鲑科鱼类具有较高的同源性,其中与北极红点鲑的IGF-I同源性最高(99.2%);组织表达分析显示,哲罗鲑IGF-I mRNA在肝脏中表达量最高,在鳃、前肠中次之,在脑、头肾、脾、心、胃和肌肉等组织中的表达量较低。
关键词:哲罗鲑(Hucho taimen);胰岛素样生长因子-I(IGF-I);进化树;组织表达
哲罗鲑(Huchotaimen)又称哲罗鱼,属鲑形目(Samoniformes)鲑科(Salmonidae)哲罗鱼属(Hucho),是名贵的大型冷水性鱼类,具有较高的经济价值。近年来,由于哲罗鲑生态环境遭到破坏,资源下降,导致种群数量减少[1]。国内外对于哲罗鲑的研究主要集中在区域变化、遗传育种、种群结构等方面,但对于分子生理学,尤其是胰岛素样生长因子(IGF)系统的研究较少。
鱼类胰岛素样生长因子(Insulin-like growth factors,IGF)是一类具有胰岛素样代谢和促进有丝分裂功能的多肽,包括IGF-I和IGF-II,但近年来Wang等研究罗非鱼发现新成员IGF-III[2]。IGF-I具有调节细胞代谢,促进细胞生长、分化和分裂,抑制细胞死亡和调节渗透压等多种生理功能[3-4]。对哲罗鲑的IGF-I基因进行深入研究,在哲罗鲑的育种及养殖管理等方面都具有重要的指导作用。鱼类IGF-I主要在肝脏中合成,并由GH调节,但IGF-I不仅在肝脏中表达,在脑、肠、鳃、肾等组织中也有表达,而且大都是通过自分泌和旁分泌方式释放[5],其主要在胚后发育和成年期发挥促生长作用[6]。目前,鱼类中已经有牙鲆[7]、尼罗罗非鱼[8]、斑马鱼[9]和马苏大马哈鱼[10]等硬骨鱼类获得了IGF-I cDNA部分及全长基因序列,揭示了IGF-I在进化过程中的保守性。
本研究克隆获得了哲罗鲑IGF-I基因的开放阅读框(Open reading frame,ORF)序列,对其进行了生物信息学分析,并运用实时荧光定量PCR技术对哲罗鲑心脏、肝脏、头肾、脾、胃、前肠、后肠、鳃、脑和肌肉等十种组织的IGF-I mRNA表达水平进行了分析,为进一步了解IGF-I基因的功能和作用机制奠定基础。
1材料与方法
1.1材料
试验用哲罗鲑采自中国水产科学院黑龙江水产研究所渤海冷水鱼试验站,为2龄鱼,体重约0.75 kg。
一步法RT-PCR试剂盒、PCR试剂、Taq聚合酶、DNA Marker、pMD18-T simple Vector、限制性内切酶及SYBR®premix Ex TaqTMII(Tli RnaseH Plus)均购自TaKaRa公司;DNA凝胶回收试剂盒及SV Total RNA Isolation kit购自Promega公司;First Strand cDNA Synthesis Kit (ReverTra Ace-α-)试剂盒购自TOYOBO公司。
1.2引物设计与合成
对Genbank收录的多条鲑鳟鱼IGF-I基因开放阅读框序列进行比对,然后选择北极红点鲑的IGF-I基因开放阅读框序列(NCBI登录号为:GU933431.1)为模板,利用Primer5.0设计用于扩增哲罗鲑ORF序列的引物P-F、P-R,分别在上、下游引物的5′端添加了BsaI 和BamH I酶切位点(酶切位点见下划线标识)。
根据扩增出的哲罗鲑的IGF-I基因开放阅读框,设计用于荧光定量PCR的引物IGF-I-F、IGF-I-R。引物均由博仕生物技术有限公司合成(见表1)。用于荧光定量PCR的内参引物β-actin-F、β-actin-R和18s-F、18s-R,是由丰程程[11]根据扩增出的哲罗鲑的β-actin和18s基因的片段而设计的用于做荧光定量的内参引物。

表1 引物序列及退火温度
注:下划线部分为引入的酶切位点
1.3IGF-I基因克隆
1.3.1IGF-I基因的获得
按照Promega公司SV Total RNA Isolation System试剂盒的方法提取2龄哲罗鲑肝脏总RNA,并用1%琼脂糖凝胶电泳检测其质量和浓度。按照TOYOBO公司First Strand cDNA Synthesis Kit (ReverTra Ace-α-) 试剂盒的方法对提取后的RNA进行RT-PCR一步反应扩增IGF-I基因。取5 μL PCR扩增产物用1%琼脂糖凝胶电泳进行检测。
1.3.2产物纯化及测序
用琼脂糖凝胶DNA回收试剂盒对PCR产物进行回收纯化。纯化产物与pMD18-T simple Vector连接构建重组质粒,转化至大肠杆菌DH5α感受态细胞中,经LB平板倒置培养后,挑取单菌落培养并进行PCR鉴定。选择阳性克隆送哈尔滨博仕生物技术有限公司测序。
1.4IGF-Ⅰ基因的序列分析
在NCBI的Genbank数据库中搜索脊椎动物IGF-I的氨基酸序列,利用Clustal X软件和MEGA5.0软件对哲罗鲑及十九种脊椎动物IGF-I氨基酸序列进行多重对比,并采用Neighbor-Joining法(1 000 runs,Amino:p-distance)构建系统进化树。用于IGF-I核苷酸序列和氨基酸序列同源性比对分析及进化树构建的物种名称和登录号列于表2。

表2 本研究所用物种IGF-I的NCBI登录号
1.5IGF-I组织表达情况分析
分别取三尾2龄哲罗鲑的心脏、肝脏、头肾、脾、胃、前肠、后肠、鳃、脑和肌肉组织,于液氮中迅速冷冻,并保存于-80 ℃超低温冰箱中。运用Trizol方法提取各组织RNA,首先将组织在液氮中研磨成粉末,取100 mg组织粉末,加入1 mL Trizol冰上裂解;加0.2 mL氯仿进行抽提;取400 μL上清液,用0.5 mL异丙醇沉降RNA,再用1 mL 75%乙醇洗涤去除杂质;用DEPC水溶解RNA。琼脂糖凝胶电泳检测RNA质量,并用紫外分光光度计测定RNA的A260∶A280值和RNA浓度。按照PremeScriptTMRT reagent Kit操作方法去除组织DNA,将RNA定量至1 μg,进行反转录。
把各组织cDNA按一倍稀释,按照SYBR premix Ex TaqTMII (Tli RnaseH Plus) 试剂盒操作方法配制反应液,在ABI 7500荧光定量PCR仪上进行PCR反应。以哲罗鲑的脾作为参照,每个组织设置3个重复。扩增参数为:95 ℃预变性10 s;95 ℃变性15 s;55 ℃退火30 s;72 ℃延伸30 s;循环数40个。运用2-△△Ct法计算基因表达量,所有数据以平均相对量展现(Means±SD)。
2结果与分析
2.1哲罗鲑IGF-I基因片段的克隆
哲罗鲑肝脏总RNA经过RT-PCR扩增,产物经1%琼脂糖凝胶电泳检测分析,发现在500~750 bp之间有一明显条带,与预期的目的条带大小相符(573 bp)(图1)。将PCR产物纯化回收后与pMD18-T simple Vector连接,并利用BsaI/BamH I对重组质粒pMD18-T-IGF-I进行酶切鉴定(图2)。将鉴定正确的pMD18-T-IGF-I进行测序鉴定,得到开放阅读框(ORF)长度为573 bp的IGF-I基因片段,在NCBI上BLAST分析后发现此基因片段与北极红点鲑的IGF-I基因同源性高达99%,判断出此序列是哲罗鲑IGF-I基因。

图1 IGF-I基因扩增产物电泳图
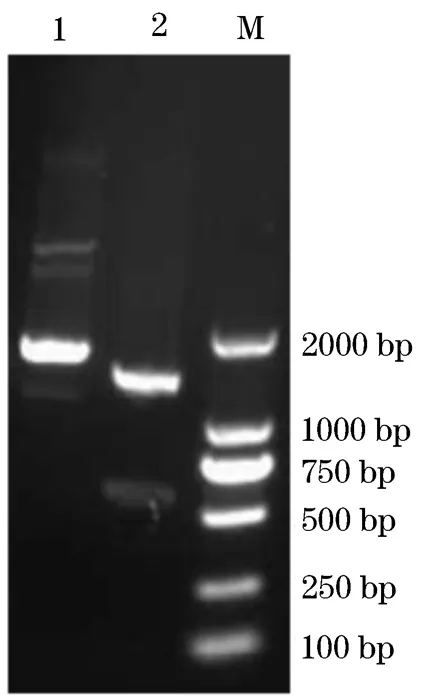
图2 IGF-I重组质粒酶切鉴定
1.IGF-I重组质粒;2.双酶切后的IGF-I重组质粒;M.DL2000分子标准
2.2哲罗鲑IGF-I基因的氨基酸结构分析
本研究获得的哲罗鲑IGF-I基因的cDNA开放阅读框为573 bp,编码含190个氨基酸的蛋白质(图3)。利用Protean软件预测确定IGF-I蛋白的相对分子质量为21.01 kDa,等电点为9.21。对IGF-I的氨基酸结构进行比对分析发现,哲罗鲑的IGF-I与其他鲑鳟鱼类结构相似,其由信号肽、B、C、A、D结构域和E肽组成。其中信号肽含有46个氨基酸残基、E肽含有74个氨基酸残基,而B、C、A、D结构域分别含有29、12、21、8个氨基酸残基。
2.3哲罗鲑IGF-I基因序列的系统进化分析
对比二十个物种的氨基酸序列发现,哲罗鲑的IGF-I氨基酸序列与斑鳟、北极红点鲑、大西洋鲑、虹鳟、鲑鱼的同源性为99.4%~96.3%。因此鲑科鱼类的IGF-I基因相对保守,而与其他硬骨鱼类的同源性在87.7%~82.9%之间。哲罗鲑的IGF-I氨基酸序列与金仓鼠、绿头鸭、人、中华鳖、野猪及牛等其他6种动物的同源性最低,仅72.5%~66.4%(见图4所示)。
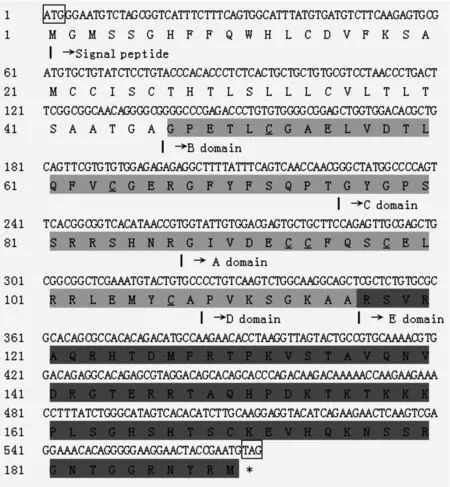
图3 哲罗鲑IGF-I ORF的cDNA和氨基酸序列

图4 哲罗鲑IGF-Ⅰ氨基酸序列与其他物种IGF-I同源性比较
基于以上获得的氨基酸序列,利用Mega5.05软件,以邻位相连法(Neighbor-joining)构建NJ系统进化树(见图5)。结果与同源性的分析相一致,哲罗鲑与斑鳟、北极红点鲑、大西洋鲑、虹鳟、鲑鱼聚类为一枝,说明哲罗鲑IGF-I与鲑鳟鱼IGF-I的亲缘关系较近,与其他硬骨鱼类的分化较远。整个鱼类作为一个大枝聚类在一起,与此相对的是其他几种非鱼类脊椎动物聚为一个大枝,说明哲罗鲑IGF-I与哺乳类、鸟类及两栖类等亲缘关系较远。该系统进化树中的各物种亲缘关系与其传统地位相一致。
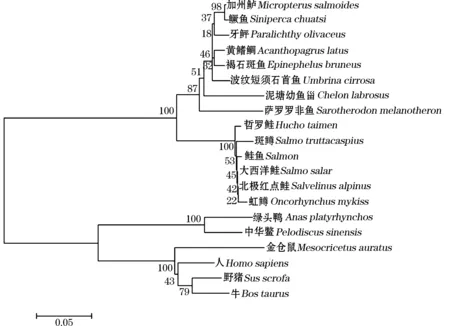
图5 IGF-Ⅰ氨基酸序列的NJ系统进化树
2.4哲罗鲑IGF-I的组织表达分析
利用实时荧光定量PCR分析哲罗鲑IGF-I基因在不同组织中的表达情况,本研究以18S及β-actin作为内参基因对各组织起始RNA进行校正。对哲罗鲑不同组织IGF-I基因及18S和β-actin进行实时荧光定量实验,分别进行3组重复,以脾组织作为对照,采用2-△△Ct法分析不同组织中IGF-I mRNA的相对表达量。结果显示,哲罗鲑IGF-I mRNA在所有被检测组织中均有表达,其中在肝脏中的表达量最高,鳃中的表达量次之,在肌肉中的表达量最低。(图6)
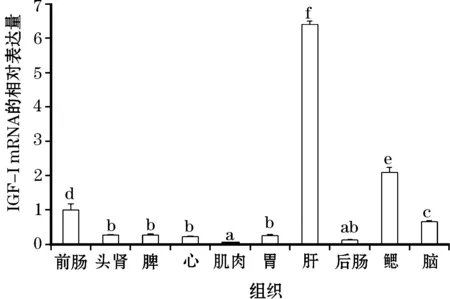
图6 哲罗鲑各组织IGF-I mRNA的相对表达含量
3讨论
本研究成功克隆获得了哲罗鲑IGF-I基因的开放阅读框,大小为573bp,编码190个氨基酸。对实验结果进行生物学分析,显示哲罗鲑IGF-I序列与虹鳟IGF-I序列结构相似[12],包括信号肽、B、C、A、D结构域及E肽三部分,且含有6个半胱氨酸残基。6个半胱氨酸残基可形成3对二硫键,从而形成稳定的结构并保持相应的功能。但哲罗鲑IGF-I成熟肽的第27位氨基酸残基与虹鳟不同,且哲罗鲑IGF-I的E肽所含氨基酸残基比虹鳟多12个,这可能是哲罗鲑与虹鳟产生差异的原因之一。氨基酸序列同源性比对分析发现哲罗鲑IGF-I与北极红点鲑IGF-I同源性最高,为99.4%,与其他鲑科鱼类的同源性也均在96%以上。而与其他硬骨鱼类的同源性较低,在87.7%~82.9%之间,与金仓鼠、绿头鸭、人、中华鳖、野猪及牛等其他动物的同源性最低,仅72.5%~66.4%。同样,系统进化树的结果显示与同源性分析结果一致,且进化树的结构与传统分类学的结论相一致。IGF-I在不同鱼类间的高度保守性说明其在进化过程中始终保留着重要的功能结构,但是根据自身的身体条件以及生长环境的影响也发生了一定的变异。
本研究利用荧光定量PCR检测了哲罗鲑十种组织中IGF-ImRNA的相对表达量,结果显示,IGF-I在肝脏中的表达量最高,这与已研究过的花鲈[13]、日本白鲫[14]、波纹短须石首鱼[15]和银大马哈鱼[16]的结果相似。肝脏是分泌IGF-I的主要部位,但IGF-I的表达也呈现出多样性,例如本实验结果显示哲罗鲑IGF-I在脾、心、肾、肠以及肌肉等组织中也有少量表达,甚至有研究者在大麻哈鱼的脂肪中也检测到有IGF-I的表达[17]。表明鱼类IGF-I通过这些组织细胞的自分泌和旁分泌而作用于自身组织细胞发挥生理作用。哲罗鲑IGF-I在肌肉、后肠等组织中的表达量不是十分明显,出现此种情况的原因有很多,可能是IGF-I的表达受多种因素的调控所致,例如激素水平、营养状况、生长环境等因素的调控;也可能是个体差异所致。
参考文献:
[1]乐佩琦,陈宜瑜.中国濒危动物红皮书-鱼类[M].北京:科学出版社,1998:29-311.
[2]WangDS,JiaoBW,HuCJ,etal.Discoveryofagonad-specificIGFsubtypeinteleost[J].BiochemBiophysResCommun,2008,367(2):336-341.
[3]JonesJI,ClemmonsDR.Insulin-likegrowthfactorsandtheirbindingproteins:Biologicalactions[J].EndocrRev,1995,16(1):3-34.
[4]UptonaZ,YandellaCA,DeggerBG,etal.Evolutionofinsulin-likegrowthfactor-I(IGF-I)action:InvitrocharacterizationofvertebrateIGF-Iproteins[J].CompBiochemPhysiolBBiochemMolBiol,1998,121(1):35-41.
[5]DuanCM.Nutritionalanddevelopmentalregulationofinsulin-likegrowthfactorsinfish[J].JNutr,1998,128(2):306S-314S.
[6]WoodAW,DuanCM,BernHA.Insulin-likegrowthfactorsignalinginfish[J].IntRevCytol,2005,243:215-285.
[7]NakaoN,TanakaM,HigashimotoY,etal.Molecularcloning,identificationandcharacterizationoffourdistinctreceptorsubtypesforinsulinandIGF-IinJapaneseflounder,Paralichthysolivaceus[J].J Endocrinol,2002,173(2):365-375.
[8]Vera Cruz E M,Brown C L,Luckenbach J A,et al.Insulin-like growth factor-I cDNA cloning,gene expression and potential use as a growth rate indicator in Nile tilapia,Oreochromisniloticus[J].Aquaculture,2006,251(2-4):585-595.
[9]Ayaso E,Nolan C M,Byrnes L.Zebrafish insulin-like growth factor-I receptor:Molecular cloning and developmental expression[J].Mol Cell Endocrinol,2002,191(2):137-148.
[10]Furukuma S,Onuma T,Swanson P,et al.Stimulatory effects of insulin-like growth factor 1 on expression of gonadotropin subunit genes and release of follicle-stimulating hormone and luteinizing hormone in masu salmon pituitary cells early in gametogenesis[J].Zool Sci,2008,25(1):88-98.
[11]丰程程.哲罗鱼早期发育阶段免疫指标变化及vasa基因的克隆与表达分析[D].上海:上海海洋大学,2014.
[12]Shamblott M J,Chen T T.Identification of a second insulin-like growth factor in a fish species[J].Proc Natl Acad Sci USA,1992,89(19):8913-8917.
[13]钱焜,温海深,迟美丽,等.花鲈类胰岛素生长因子-1基因的全长cDNA分离与表达分析[J].中国海洋大学学报,2014,44(2):27-34.
[14]陶敏,钟欢,刘少军,等.日本白鲫IGF-1基因全长cDNA克隆及组织表达分析[J].生命科学研究,2012,16(4):295-300.
[15]Patruno M,Maccatrozzo L,Funkenstein B,et al.Cloning and expression of insulin-like growth factors I and II in the shi drum (Umbrinacirrosa)[J].Comp Biochem Physiol B Biochem Mol Biol,2006,144(2):137-151.
[16]Pierce A L,Dickey J T,Larsen D A,et a1.A quantitative real-time RT-PCR assay for salmon IGF-I mRNA and its application in the study of GH regulation of IGF-I gene expression in primary culture of salmon hepatocytes[J].Gen Comp Endocrinol,2004,135(3):401-411.
[17]Duguay S J,Park L K,Samadpour M,et al.Nucleotide sequence and tissue distribution of three insulin-like growth factor I prohormones in salmon[J].Mol Endocrinol,1992,6(8):1202-1210.
(责任编辑:张潇峮)
收稿日期:2015-06-23;
修订日期:2016-03-17
第一作者简介:王晓玉(1989-),女,硕士,从事水产动物繁殖生理学研究。E-mail:xyw7913@163.com 通讯作者:尹家胜。E-mail:xwsc20@tom.com
中图分类号:S917.4
文献标识码:A
文章编号:1000-6907-(2016)04-0019-06
Cloning,sequence analysis and tissue expression of insulin-like growth factor I in Hucho taimen
WANG Xiao-yu1,2,JI Feng1,2,XU Li-ming1,ZHAO Jing-zhuang1,LIU Miao1,CHAO Yong-sheng1,YIN Jia-sheng1
(1.HeilongjiangRiverFisheryResearchInstitute,ChineseAcademyofFisherySciences,Harbin150070,China;2.CollegeofFisheryandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China)
Abstract:Total RNA was isolated from Hucho taimen liver tissue.The cDNA encoding insulin-like growth factor I (IGF-I) peptide was amplified by reverse transcription polymerase chain reaction (RT-PCR) strategy using isolated total RNA as template.The IGF-I mRNA level was detected in different tissues using real-time quantitative PCR technique.The results displayed that the IGF-I contained an open reading frame (ORF) of 573 bp,and encoded a polypeptide with length of 190 amino acids.The polypeptide was composed of signal peptide,B,C,A,D domain and E peptide and the isoelectric point was 9.21.The amino acid sequence of H.taimen IGF-I was high homologus to that of other Salmonidae. H.taimen shared the highest identity with Salvelinus alpinus and the homology at nucleotide level of the IGF-I gene was 99.2%.The expression analysis of IGF-I gene with real-time quantitative RT-PCR showed that the highest level of IGF-I mRNA was observed in liver,followed by in gill and anterior intestine.There was no obvious expression in brain,pronephros,spleen,heart,stomach and muscle.
Key words:Hucho taimen;IGF-I;evolutionary trees;tissue expression
资助项目:国家科技支撑计划(2012BAD25B10);公益性行业(农业)科研专项(201003055-14)
