水体pH对中华绒螯蟹幼蟹蜕壳生长及其相关基因表达的影响
2016-07-28刘金生岳武成慈元吉王成辉
刘金生,王 军,岳武成,陈 娇,黄 姝,慈元吉,王成辉
(上海海洋大学,农业部淡水水产种质资源重点实验室,上海 201306)
水体pH对中华绒螯蟹幼蟹蜕壳生长及其相关基因表达的影响
刘金生,王军,岳武成,陈娇,黄姝,慈元吉,王成辉
(上海海洋大学,农业部淡水水产种质资源重点实验室,上海201306)
摘要:为了解养殖水体pH值对中华绒螯蟹(Eriocheir sinensis)蜕壳生长及其相关基因表达的影响,在试验室水槽条件下,设定pH=7、8、9、10(均无水草)为实验组,以种植适量水草(pH值为8.2~9.1)为对照组,研究中华绒螯蟹幼蟹(均重0.43 g±0.09 g)在不同pH值水体中饲养一个蜕壳周期(37 d)的蜕壳生长及其相关基因(蜕皮抑制激素MIH,蜕皮激素受体EcR,维甲类X受体RXR,胰岛素样生长因子IGF2)表达情况。结果显示,对照组河蟹的成活率和增重率均显著高于实验组,其中,pH10的河蟹成活率和增重率最低。荧光定量PCR检测显示,MIH、EcR和RXR基因在不同pH水体的表达存在显著差异,IGF2基因在不同pH水体中的表达无显著差异;不同pH水体幼蟹的增重率与成活率之间存在显著正相关,EcR、RXR与IGF2基因相互间的表达量存在显著正相关,表明这三个基因的表达具有协同作用。通过对成活率、增重率和基因表达的综合分析认为幼蟹生长的最适pH为8~9。
关键词:中华绒螯蟹(Eriocheir sinensis);pH值;水草;蜕壳;生长;基因表达
水体pH是水产生物生存环境的重要生态因子,对水产生物的成活率和生长率[1-2],甚至对酶活性和基因表达[3-4]均会产生影响。如罗氏沼虾在pH 6.8的水体饲养56 d后,其蜕壳频率和增重率显著低于pH 7.4和8.2的养殖水体[1],中国对虾在pH 7.0和pH 9.0胁迫148 h时其鳃、肌肉和血细胞中的HSP90基因表达均上调[4]。中华绒螯蟹(Eriocheirsinensis)俗称河蟹,是我国一种重要的水产经济生物。水体pH值对其生长发育也有重要影响,不同pH会影响幼蟹发育和非特异性免疫等[5-6],高pH会影响河蟹蛋白质和氨基酸的代谢水平,降低血淋巴总蛋白和血蓝蛋白的含量[7],高pH还能导致河蟹氧化应激改变体色[8]。据报道,生产上河蟹的适宜pH值为6.5~9.5[9-11],此pH值范围跨度较大,是一种生产实践中的经验总结和推论,尚缺乏严格的实验验证。
另一方面,水草是河蟹养殖中一个重要生态因子,它不仅提供丰富的饵料、良好的栖息和隐蔽场所,而且有改善水质,减少水体有害物质等作用[12]。同时,水草对池塘pH也有重要影响。如王传海等[13]报道,种有苦草的水体日平均pH值明显高于无水草水体。
生物的生长发育受外界环境因子的影响,同时也受体内基因的调控。河蟹属于甲壳动物,其生长与蜕壳密切联系,即河蟹的生长有赖于蜕壳的次数和蜕壳后体长和体质量的增加程度[14],而蜕壳过程主要是受蜕皮激素、蜕皮抑制激素(MIH)、蜕皮激素受体(EcR)、维甲类X受体(RXR)等基因的调控[15]。然而,这些蜕壳相关基因在不同pH下是否存在表达差异,目前尚不清楚。此外,胰岛素样生长因子(IGFs)作为一类多功能细胞增殖调控因子,在细胞分化、增殖、个体生长发育中具有重要的促进作用[16],但其在甲壳动物蜕壳生长中的作用亦未见报道。
本实验拟在人工控制的实验室条件下,探究不同水体pH对幼蟹蜕壳、生长及其相关基因表达的影响,探讨水草(pH方面)在河蟹养殖中的作用机制,以期为河蟹生态养殖提供参考和依据。
1材料与方法
1.1实验设置
本研究在实验室的60 L长方体水箱(52 cm×36 cm×32 cm)中进行。实验共设5组,其中以pH=7、8、9和10为实验组,用0.5 mol/L NaOH和0.5 mol/L HCl调节水体pH,无水草种植;以种植适量水草(苦草)为对照组。每组设置3个重复(共15个实验水箱),每个水箱内放养24只幼蟹(雌雄蟹各12只),共饲养幼蟹360只。
1.2饲养方法
实验蟹来自上海海洋大学水产动物种质实验站的良种选育系仔蟹,体重(0.43±0.09) g。每个养殖水箱中间均放置1个长形拱状瓦片作为隐蔽物,以减少蜕壳过程中的互相残杀。每日早晚定时各投喂1次适量的河蟹专用配合饲料,并及时清理残渣和排泄物。实验水源为河水(pH值在7.6左右),每隔3 d换水一次(预先调好pH),实验期间连续充氧。每日测量2次水体pH并进行调节,同时测量对照组pH值(实验期间的pH范围为8.2~9.1,平均为8.5)。实验日期为2014年7月1日—2014年8月6日,共37 d。
1.3生长测定与组织样本采集
每天记录实验幼蟹的蜕壳和死亡情况,及时将蜕壳前期和蜕壳后不久的蟹用网袋隔离开,第2天待壳硬化后测量体重,然后放回原水箱养殖。第二次蜕壳时,同样先用网袋隔离,然后在第2天待壳硬化后时测量体重,并取其眼柄和肝胰腺组织放于-80 ℃冰箱备用。
1.4荧光定量PCR分析
总RNA提取采用Axygen-RNA试剂盒,反转录采用PrimeScript®RT reagent Kit试剂盒(大连宝生物公司)。根据已报道的与蜕壳生长相关的基因序列[17-19]设计引物(表1)用于荧光定量PCR检测。本研究分析了眼柄中的蜕皮抑制激素(MIH),肝胰腺中的蜕皮激素受体(EcR)、维甲类X受体(RXR)和胰岛素样生长因子2(IGF2)基因。荧光定量PCR反应条件如下:预变性95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,共40个循环;72 ℃ 10 min,溶解曲线60~94 ℃。

表1 荧光定量PCR引物序列与反应特性
1.5数据处理
蜕壳间期(d)为各组河蟹第二次蜕壳的平均日期与第一次蜕壳的平均日期之差。荧光定量结果按2-ΔΔCt法进行分析[20]。生长数据和基因表达数据均用平均值±标准差表示,用Excel、SPSS 20对这些数据进行单因素方差分析(ANOVA)、显著性检测和相关分析。
2结果与分析
2.1生长情况观察
经过37 d的实验,发现实验组中以pH 8的成活率最高(76.39%),pH 10的成活率最低(51.39%),但均低于对照组(83.33%)(P<0.05)。不同pH实验组的增重率也存在较大变化,pH 9的增重率最高(140.90%),其次是pH 7(139.28%)和pH 8(132.69%),但相互间不存在显著差异,而pH 10的增重率显著低于其它pH实验组(102.23%)。但所有四种pH实验组的增重率均显著低于对照组(226.13%)(P<0.05)表2。
通过统计前后两次蜕壳间的蜕壳间期如图1所示,发现对照组的蜕壳间期最短,平均为9.7 d,实验组中pH 7的蜕壳间期最长(平均13.8 d),pH 8的蜕壳间期(13.2 d)高于pH 9(12.0 d)和pH 10(9.8 d图1)。
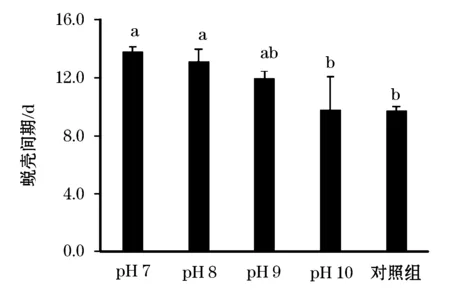
图1 四种不同pH实验组与对照组(水草)的蜕壳间期
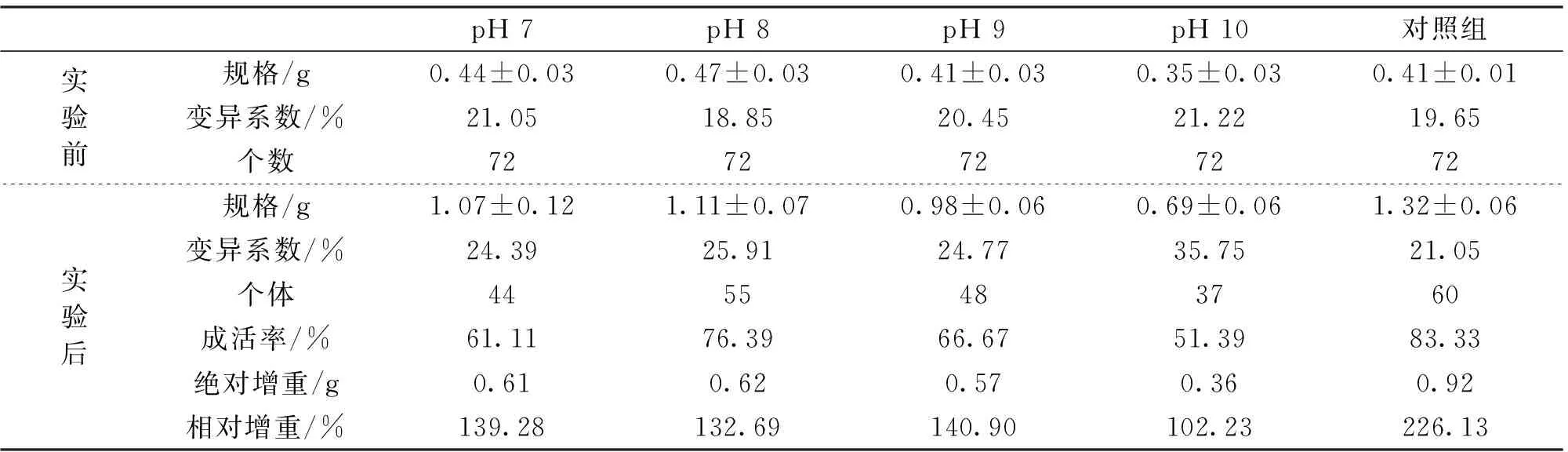
pH7pH8pH9pH10对照组实验前规格/g0.44±0.030.47±0.030.41±0.030.35±0.030.41±0.01变异系数/%21.0518.8520.4521.2219.65个数7272727272实验后规格/g1.07±0.121.11±0.070.98±0.060.69±0.061.32±0.06变异系数/%24.3925.9124.7735.7521.05个体4455483760成活率/%61.1176.3966.6751.3983.33绝对增重/g0.610.620.570.360.92相对增重/%139.28132.69140.90102.23226.13
2.2蜕壳生长相关基因的表达分析
荧光定量PCR表达结果检测显示,MIH、EcR和RXR基因的表达水平与pH密切相关,IGF2基因在不同pH组中的表达无显著差异(表3和图2)。MIH基因在对照组中的表达量显著高于各pH实验组(P<0.05),但在各pH实验组间无显著表达差异(P>0.05)。EcR基因在pH 10的表达量显著高于其它组(P<0.05),而在pH 8的表达量最低。RXR基因在pH 9的表达量显著高于其他pH水体(P<0.05),同样在pH 8的表达量最低。IGF2基因在不同pH组和对照组中的表达均无显著差异(P>0.05),但以pH 9的表达量最高。进一步分析基因间的表达关系,发现EcR和RXR基因的表达量存在相同的表达关系(r=0.654,P<0.01),只有在pH 10组存在相反的表达关系(图3)。
2.3相关性分析
将生长相关数据与基因表达量进行相关分析(表4)显示,增重率与成活率之间存在显著正相关(r=0.729,P<0.01),即成活率越大,反映生长环境条件较好,有利于河蟹生长,从而增重率越高。EcR、RXR与IGF2基因相互间表达量存在显著正相关(r=0.654~0.868,P<0.01),表明这三个基因的表达具有协同作用。MIH基因表达与增重率之间存在显著正相关(r=0.748,P<0.01),与蜕壳间期之间存在显著负相关(r=-0.528,P<0.05);EcR基因表达与成活率、增重率之间存在显著负相关(r=-0.591~-0.601,P<0.05),表明MIH基因高表达,而EcR基因低表达时蜕壳间期变短,成活率越高,有利于河蟹的生长。

表3 基因表达量在不同pH水体的单因素方差分析结果
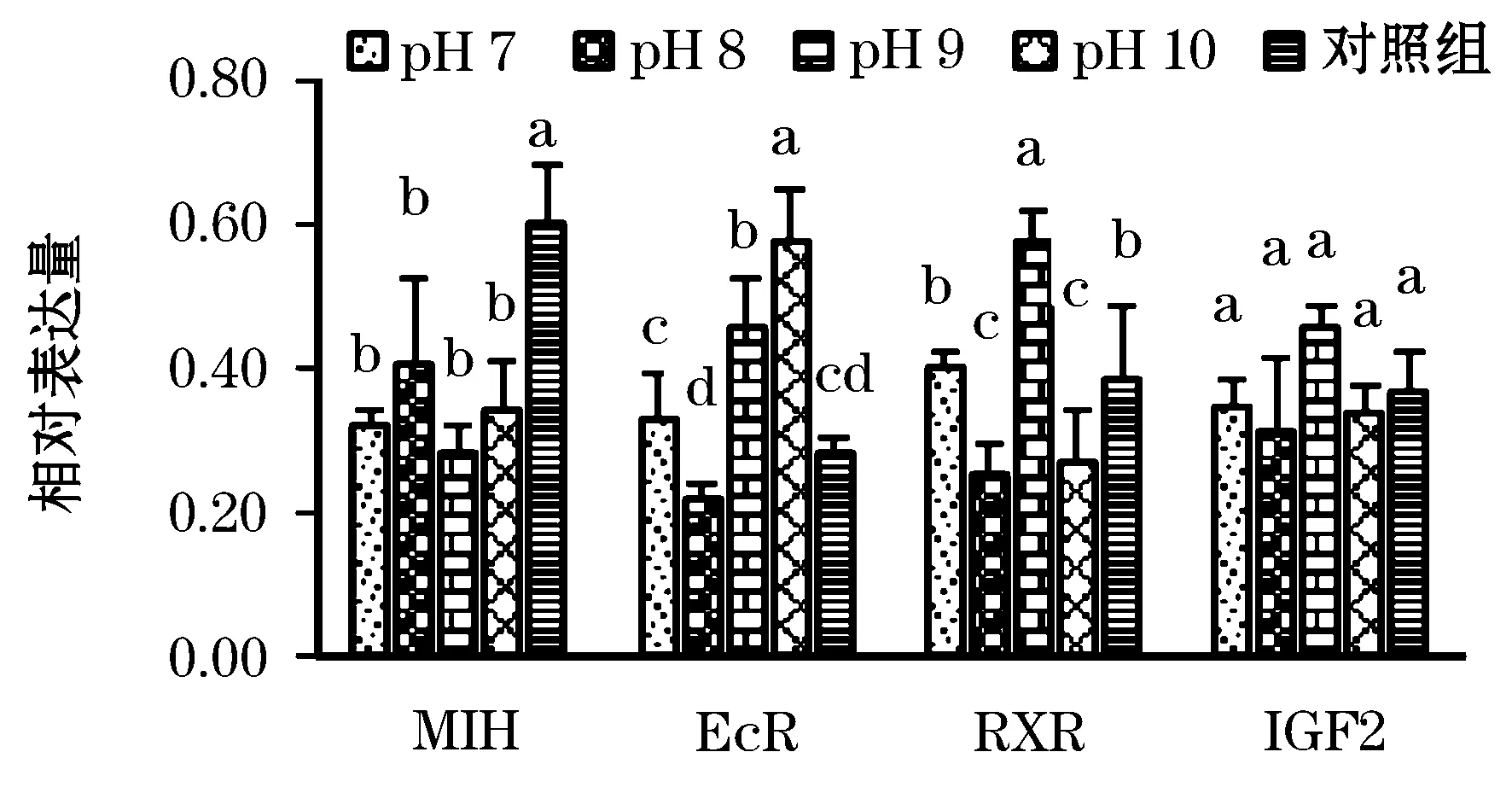
图2 相关基因在不同pH水体的表达
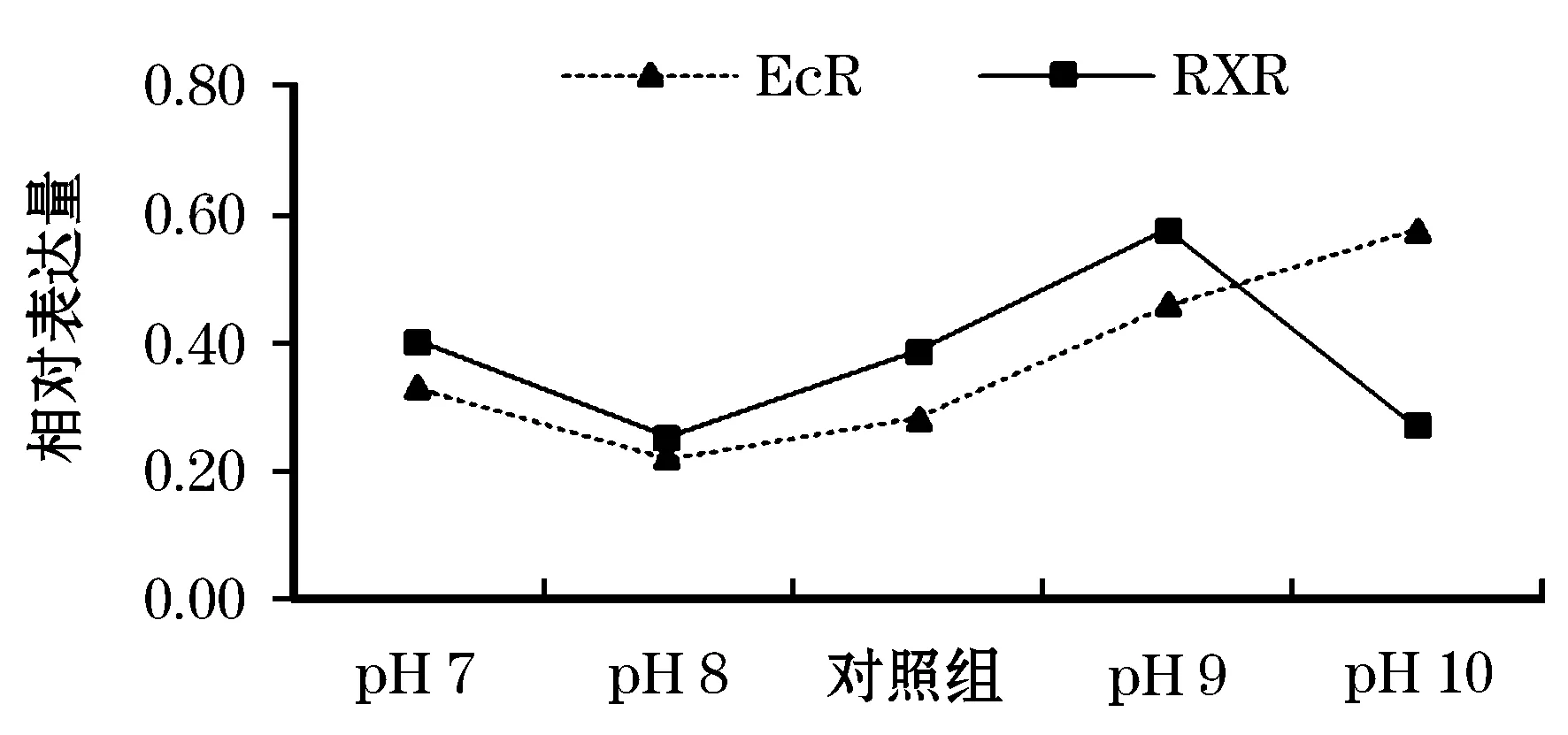
图3 EcR和RXR基因的表达关系
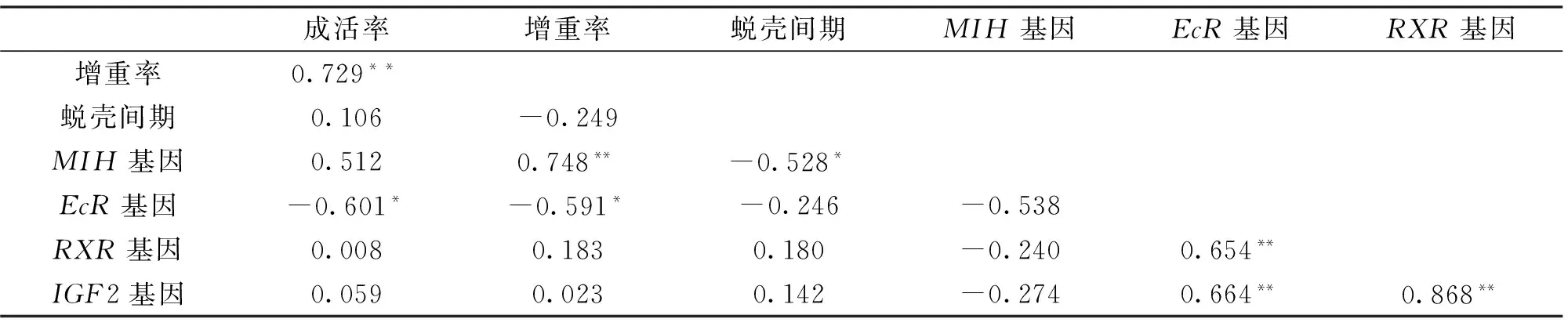
成活率增重率蜕壳间期MIH基因EcR基因RXR基因增重率0.729**蜕壳间期0.106-0.249MIH基因0.5120.748**-0.528*EcR基因-0.601*-0.591*-0.246-0.538RXR基因0.0080.1830.180-0.2400.654**IGF2基因0.0590.0230.142-0.2740.664**0.868**
注:**表示相关性极显著(P<0.01),*表示相关性显著(P<0.05).
3讨论
pH是水生动物生长环境中重要的理化因子,动物的生长发育在一定程度上受到水环境pH的影响。而在水生甲壳动物中,蜕壳间期常常作为其生长发育水平的阶段性衡量标准。本研究的不同pH实验组中,其河蟹的蜕壳间期随水体pH的升高逐渐缩短且显著负相关。该结果与董双林等[21]在日本沼虾中的研究结果一致,其研究认为适度的高pH诱导的高蜕壳频率可能与加速的甲壳动物甲壳钙化相关。有研究结果显示,水体pH值对水生甲壳动物生长的影响可能是通过影响其能量摄入多少以及摄食能用于生长的比例来实现,即在一定范围内水生甲壳动物摄食及用于生长的能量随着pH值的增大而增加[22],其外在表现为成活率升高以及体重的增加,本实验结果与之一致。如在本实验中,增重率在pH 9时达到最高,在pH 10却降低,这说明pH诱导在一定范围内会加速河蟹的蜕壳,而过高(pH 10时)可能会在一定程度抑制生长。综上,在一定范围内,pH增加有利于幼蟹的蜕壳生长,超过一定范围时表现为抑制作用,幼蟹的最适pH值范围为8~9。
在不同pH实验组中,幼蟹成活率以pH 8最高,增重率以pH 9最大,即与pH 7、pH 10相比,实验组中幼蟹生长效果较好的pH 值为8~9,这跟种植水草的对照组pH值范围(8.2~9.1)是一致的。但对照组河蟹的生长效果在所有养殖组中最好,这与种植水草的水体能够提供更优的生存环境有关。种植水草的水体除了调节pH范围外,还能提供丰富的饵料食物作为河蟹重要的营养源,能有效地遮阳降温,是蜕壳时支撑和隐蔽的场所,能提供良好的栖息环境[12]。
在调节pH的机制上,水草通过光合作用吸收CO2,改变水体中碳酸盐平衡,促使总碱度增加,从而提供水体较高pH值[23]。另一方面,水草也能在一定范围内稳定水体pH。养殖池塘中常产生大量有机物(养殖生物的排泄和尸体、饵料残渣以及其他生物的代谢、死亡等),这些物质在一定条件下(如暴雨),使水体缺氧、变黑发臭,水质恶化,产生有机酸(乳酸和醋酸),H2S、CO2等酸性物质,改变水体pH,严重时使水体酸化(pH<7)[24]。水草能直接吸附部分有机物质,同时也能间接降低水体有机物含量,如水体有机氮被微生物分解与转化后,无机氮(氨氮)作为水草的营养物质而被水草吸收[25],从而在一定范围内维持水体pH稳定。综上所述,水草能在一定范围内提供并维持水体pH,即水草能为河蟹的生长发育提供合适的pH水体环境。
参考文献:
[1]Chen S M,Chen J C.Effects of pH on survival,growth,molting and feeding of giant freshwater prawnMacrobrachiumrosenbergii[J].Aquaculture,2003,218(1-4):613-623.
[2]么宗利,王慧,周凯,等.碳酸盐碱度和pH值对凡纳滨对虾仔虾存活率的影响[J].生态学杂志,2010,29(5):945-950.
[3]朱毅菲,熊传喜,王良发.温度、pH对克氏原螯虾血清酚氧化酶活力及稳定性的影响[J].淡水渔业,2006,36(5):16-19.
[4]王芸,李健,张喆,等.pH、氨氮胁迫对中国对虾HSP90基因表达的影响[J].渔业科学进展,2013,34(5):43-50.
[5]孙汉,李义,王玥,等.pH胁迫对中华绒螯蟹5种非特异性免疫指标的影响[J].淡水渔业,2011,41(4):70-74.
[6]赵晓红,金送笛.低温、降盐度及pH对中华绒螯蟹幼体变态的影响[J].大连水产学院学报,2001,16(4):249-256.
[7]于敏,王顺昌,卢韫.中华绒螯蟹在不同pH下氨氮排泄和血淋巴含氮成分的变化[J].水生生物学报,2008,32(1):62-67.
[8]龚志,蔡春芳,朱健明,等.高pH值对中华绒螯蟹抗氧化能力及虾青素沉积的影响[J].淡水渔业,2015,45(1):20-24.
[9]宋伟.池塘养殖大规格商品河蟹高产高效技术研究[J].黑龙江水产,2011,(3):6-8.
[10]石小平.河蟹生态养殖中pH值与养殖效果的关系[J].安徽农学通报,2010,16(5):149-151.
[11]陈卫境.河蟹健康养殖的主要技术措施[J].淡水渔业,2002,32(2):25-27.
[12]何杰.水草在鱼虾蟹类健康养殖中的作用[J].现代渔业信息,2007,22(10):27-28.
[13]王传海,李宽意,文明章,等.苦草对水中环境因子影响的日变化特征[J].农业环境科学学报,2007,26(2):798-800.
[14]王武,王成辉,马旭洲.河蟹生态养殖[M].第2版.北京:中国农业出版社,2013:52.
[15]Devaraj H,Natarajan A.Molecular mechanisms regulating molting in a crustacean[J].FEBS J,2006,273(4):839-846.
[16]Duan C M,Ren H X,Gao S.Insulin-like growth factors (IGFs),IGF receptors,and IGF-binding proteins:Roles in skeletal muscle growth and differentiation[J].Gen Comp Endocrinol,2010,167(3):344-351.
[17]王瑶,杨志刚,郭子好,等.中华绒螯蟹RXR基因全长cDNA克隆及表达分析[J].水产学报,2013,37(12):1761-1769.
[18]孙妍,张亦陈,刘逸尘,等.中华绒螯蟹蜕皮抑制激素基因全长cDNA克隆和重组表达[J].水生生物学报,2011,35(2):210-217.
[19]王瑶,杨志刚,沈城,等.中华绒螯蟹EcR基因全长cDNA克隆及表达分析[J].水产学报,2014,38(5):651-661.
[20]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[21]董双林,堵南山,赖伟.pH值和Ca2+浓度对日本沼虾生长和能量收支的影响[J].水产学报,1994,18(2):118-123.
[22]马雄威.盐度和pH胁迫对中华绒螯蟹能量代谢及性腺发育的影响[D].河北保定:河北大学,2009.
[23]李钟玮,魏云慧,柳淼,等.干旱季节水库水质pH值增高原因探析[J].环境科学与管理,2007,32(2):80-81,84.
[24]吴建强,黄沈发,丁玲.水生植物水体修复机理及其影响因素[J].水资源保护,2007,23(4):18-22,36.
[25]雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004:218-219.
(责任编辑:邓薇)
收稿日期:2015-09-30;
修订日期:2015-12-28
第一作者简介:刘金生(1990-),男,硕士研究生,专业方向为水产动物种质资源与苗种工程。E-mail:876439014@qq.com 通讯作者:王成辉。E-mail:wangch@shou.edu.cn
中图分类号:S966.12
文献标识码:A
文章编号:1000-6907-(2016)04-0096-05
The effect of pH on the molting,growth and related gene expression in juvenile mitten crab,Eriocheir sinensis
LIU Jin-sheng,WANG Jun,YUE Wu-cheng,CHEN Jiao,HUANG Shu,CI Yuan-ji,WANG Cheng-hui
(KeyLaboratoryofFreshwaterFisheriesGermplasmResoures,MinistryofAgriculture,ShanghaiOceanUniversity,Shanghai201306,China)
Abstract:In order to investigate the effect of pH on the molting,growth and expression of related genes (MIH,EcR,RXR,IGF2) in juvenile mitten crabs, Eriocheir sinensis,with the average weight of (0.43±0.09)g cultured in the indoor experiment closets,tests were conducted with four experimental group of pH=7,8,9 and 10 (no water grass) and one control group (water grass) for one inter-molting period (37 days).The results indicated that the survival rate and weight gain in the control group were significantly higher than those in the experimental groups,while the lowest survival rate and weight gain existed in the pH 10 group.The quantitative real-time PCR showed there were significant expression difference in MIH, EcR and RXR genes.Among the different water pH groups,however,there was no significant expression difference in IGF2 gene.Correlation analysis showed that there was significant positive correlation between the weight gain rate and survival rate,and among EcR、RXR and IGF2 genes,indicating synergistic effects in expression in the three genes.Combining survival rate,weight gain and gene expression,it would have been concluded that the optimal pH was 8~9 for juvenile crab.
Key words:Eriocheir sinensis;pH;water grass;molting;growth;gene expression
资助项目:上海市科委崇明科技专项项目(13391912102);上海市工程技术中心建设项目(03DZ2251800);上海市中华绒螯蟹产业技术体系项目[沪农科(产)字2014第4号]
