嗜水气单胞菌ATCC7966 luxS基因缺失株构建及特性研究*
2016-07-28张福蓉郭婉萍权春善范圣第
崔 一,赵 晶,张福蓉,郭婉萍,陈 明*,权春善,范圣第
嗜水气单胞菌ATCC7966 luxS基因缺失株构建及特性研究*
崔一1,赵晶2,张福蓉2,郭婉萍2,陈明1*,权春善2,范圣第2
1. 大连工业大学 生物工程学院,大连116034;2. 大连民族大学 生命科学学院 大连民族大学 国家民委-教育部生物化工重点实验室,大连116600
摘要:目的研究群体感应信号分子AI-2合成酶编码基因luxS对嗜水气单胞菌ATCC 7966生理特性及毒力因子的影响。方法利用同源重组原理,构建含有中间为卡那霉素抗性基因,两侧为luxS基因上、下游同源序列片段的基因敲除质粒,将构建好的质粒转化大肠埃希氏菌 SM 10(λpir)感受态细胞,利用接合法将质粒转入嗜水气单胞菌ATCC 7966,通过抗性筛选、PCR和DNA测序确认嗜水气单胞菌luxS基因缺失突变株。比较野生株ATCC 7966和luxS基因缺失突变株生长速度、AI-2合成、胞外蛋白酶合成及生物膜形成的差异。结果嗜水气单胞菌luxS基因缺失突变株ΔluxS构建成功。与野生株相比,突变株生长周期延长,基本丧失合成AI-2和胞外蛋白酶的能力;突变株生物膜形成能力降低,生长24 h时生物膜形成能力为野生株的14.5%,36 h时生物膜形成能力为野生株的 60.0%,突变株生物膜形成速度明显比野生株缓慢,结构更为疏松。结论luxS基因参与调控嗜水气单胞菌的生长、AI-2合成和毒力因子表达,本研究为进一步研究luxS基因在嗜水气单胞菌致病性中发挥的作用奠定基础。
关键词:嗜水气单胞菌;luxS;AI-2;胞外蛋白酶;生物膜
嗜水气单胞菌(Aeromonashydrophila)是一种在自然界水体中广泛存在的革兰氏阴性菌,是典型的人-兽-鱼共患病病原菌[1],能导致鱼类的出血性败血症[2],给水产养殖带来严重的危害。该菌的致病性与其分泌的毒力因子密切相关。已报道的毒力因子有胞外蛋白酶、溶血素、肠毒素以及粘附因子如菌毛和表面蛋白S层等[3-4],这些毒力因子相互协调作用于机体,发挥致病作用。
群体感应(Quorum Sensing,QS)是细菌细胞密度达到一定阈值后,能够感知自身分泌的自诱导信号分子(autoinducer,AI),进行细胞间交流的现象[5-6]。目前发现革兰氏阴性菌和阳性菌中广泛存在着LuxS/AI-2 QS系统,可产生用于细菌种间交流的通用自诱导物AI-2。AI-2通过QS途径进行信号转导,能够有效地调控细菌的生理活动及病原菌的毒力作用[7]。luxS基因编码蛋白LuxS具有AI-2合成酶的功能,能够与甲硫腺苷/S-腺苷高半胱氨酸核苷酶(Pfs) 共同作用,将S-腺苷高半胱氨酸(SAH)转化为AI-2[8],是LuxS/AI-2 QS系统赖以发挥调控作用的关键组成元件。
嗜水气单胞菌ATCC7966是一株属于O∶1血清型且具有一定毒性的模式菌株[9],LuxS/AI-2 QS系统在该菌株中如何发挥调控作用尚不明确。本研究通过同源重组的方法构建其luxS基因缺失突变株,并对其生物学特性进行研究。
1材料和方法
1.1菌株、质粒、试剂与仪器嗜水气单胞菌 ATCC 7966购自中国普通微生物菌种保藏管理中心(CGMCC),哈维氏弧菌 BB 152 (野生型哈维氏弧菌 BB 120luxLM::Tn5)和哈维氏弧菌 BB 170 (野生型哈维氏弧菌 BB 120luxN::Tn5)由中国农业科学院上海兽医研究所韩先干研究员馈赠。嗜水气单胞菌和luxS基因缺失突变株于 Luria-Bertani (LB)培养基中培养,哈维氏弧菌于 AB 培养基[10]中培养,培养温度均为 30 ℃。自杀性载体pWM 91、大肠埃希氏菌SM10(λpir)由南京农业大学钟增涛教授馈赠。
DNA胶回收试剂盒、 DNA纯化试剂盒、质粒提取试剂盒等均购自宝生物工程(大连)有限公司;pEASY-T1克隆试剂盒购自北京全式金生物技术有限公司;Flx800 荧光发光微孔检测仪购自美国伯腾(BioTek)仪器有限公司;Multiskan GO 超微量分光光度计购自美国Thermo Scientific公司;Ultrospec 4300 pro分光光度计购自美国通用(GE)电气医疗公司;IX71 倒置荧光显微镜购自日本奥林巴斯(Olympus Corporation)公司。
1.2引物设计与目的片段的扩增利用引物a、b和e、f,以嗜水气单胞菌ATCC 7966基因组为模板PCR扩增luxS基因的上下游片段,利用引物c、d以pET28a载体为模板PCR扩增卡那霉素基因片段。将得到的片段通过重叠延伸PCR进行融合。实验中所用引物如表1所示。
表1引物序列Tab.1Sequences of primers

引物Primers序列5'→3'Sequence5'→3'aluxS-U-FACTTCCTGCCCAAGGTGAAGGTGGAGbluxS-kan-U-RCTTCTTGAGATCCTTGGTGTGGT-CAACGGTAckan-U-FTACCGTTGACCACACCAAGGATCT-CAAGAAGdkan-D-RCTTTTCAGCTTCTCTTCATTTCAGGTG-GCACTTeluxS-kan-D-FAAGTGCCACCTGAAATGAAGAGAAGCT-GAAAAGfluxS-D-RGCCAACGAGCTTGGTCACACCATGC
1.3重组质粒 pWM 91-ΔluxS的构建与鉴定将1.2中得到的融合片段与pEASY-T1 载体连接得到重组质粒pEASY-T1-ΔluxS,转化Trans1-T1感受态细胞。使用限制性内切酶SacI、NotI双酶切载体pWM 91 和重组质粒pEASY-T1-ΔluxS,以获得相同粘性末端的质粒pWM91和luxS基因缺失片段。连接得到重组质粒 pWM 91-ΔluxS,转化E.coliSM 10(λpir) 感受态细胞。使用SacI、NotI 双酶切鉴定重组质粒pWM 91-ΔluxS,与预期一致的质粒送至宝生物工程(大连)有限公司进行序列测定,测序结果与 Genbank 公布的核苷酸序列进行比对。
1.4突变株的筛选与鉴定采用接合转移的方法将重组质粒pWM91-ΔluxS转化嗜水气单胞菌,以含有正确重组质粒的E.coliSM 10(λpir)为供体菌,以嗜水气单胞菌ATCC 7966为受体菌进行接合。将菌液混合滴加在贴放于LB 平板上的 0.45 μm滤膜上,30 ℃接合 8 h。将滤膜用LB洗涤,取 200 μL菌液涂布含卡那霉素和庆大霉素的双抗性 LB 平板,30 ℃培养48 h。以待筛选菌株的基因组为模板,利用引物a 和 f 进行验证。将验证结果与预期相符的PCR 产物送至宝生物(大连)工程有限公司进行序列测定,以鉴定突变株。
1.5突变株和野生株的生物学特性分析
1.5.1生长曲线测定将野生株和突变株过夜活化培养。分别用LB培养基稀释菌液至OD6000.85,按 1%的接种量将野生株和突变株接种至LB液体培养基,分别定时取样测定OD600,每株菌重复3次试验。
1.5.2AI-2 活性的检测利用哈维氏弧菌报告菌株BB170检测AI-2的活性,哈维氏弧菌BB152培养OD600至1.0-1.1的无菌上清液作为阳性对照,灭菌的AB培养基作为阴性对照。哈维氏弧菌BB170于AB培养基中培养至OD600为1.0-1.1,用AB培养基按照1∶5000的比例稀释BB170培养液,分别加入10%的嗜水气单胞菌野生株无菌上清液、突变株无菌上清液、哈维氏弧菌BB152无菌上清液和AB培养基,30 ℃培养4 h。培养液加入96孔板中,用荧光发光微孔检测仪上预存程序检测其诱导发光值,以此表征AI-2的活性。每株菌培养不同时间获取的无菌上清液重复3次试验。
1.5.3胞外蛋白酶的检测偶氮酪蛋白法参照文献[11]的方法进行,分别取培养不同时间的野生株和突变株无菌上清液100 μL,加入 l00 μL偶氮酪蛋白溶液 (50 mmol/L pH 8.0 Tris-HCl 缓冲液配制,终浓度为 0.5%(w/v)),37 ℃反应 2 h。加入10%(w/v)三氯乙酸溶液500 μL终止反应,室温放置 30 min。反应液于12 000 r/min条件下离心10 min,500 μL上清液与 500 μL 1 M NaOH溶液混匀,以只含有Tris-HCl缓冲液和菌株无菌上清液的反应液为空白对照,测定OD440。每小时OD440变化0.001定义为一个酶活力单位(1 U)。每株菌重复3次试验。
1.5.4生物膜形成能力的测定采用结晶紫染色法[12]量化测定野生株和突变株生物膜的形成能力。将过夜活化的突变株和野生株菌液稀释至OD6000.85,按 2% 接种量分别接入每孔盛有200 μL LB 的96孔板中,30 ℃培养一定时间。将孔内菌液吸弃,200 μL PBS缓冲液洗涤 3 次,加入200 μL甲醇固定 15 min,吸弃甲醇,室温下干燥。加入 200 μL 1%(w/v)结晶紫溶液染色 15 min,吸弃结晶紫染液,用去离子水将结晶紫冲洗干净至无色,室温干燥。加入 33%(v/v)冰乙酸溶液,37 ℃培养箱中放置 30 min,利用超微量分光光度计检测OD590值。每株菌重复3次试验。
利用荧光显微镜观察突变株和野生株的生物膜的形态及形成过程,染色前期处理方法与结晶紫染色法中一致,使用0.01%(w/v) 吖啶橙溶液染色,避光放置15 min。荧光显微镜使用物镜为×20,目镜为×10,激发光488 nm。
2结果
2.1目的片段的扩增利用引物a、 b及e、f,以嗜水气单胞菌基因组为模板PCR 扩增出luxS基因 上下游片段,大小分别为888 bp、836 bp;利用引物c和d,以pET28a载体为模板PCR扩增出卡那霉素片段,大小1 075 bp。如图1a所示,条带大小与预期相符。利用引物a、f通过重叠延伸PCR将上述三段进行融合,如图1b所示,条带大小为2 799 bp,与预期相符。

aM: DNA Marker (DL2000); 1: PCR product of upstream fragment of luxS;2: PCR product of Kanr cassette; 3: PCR product of downstream fragment of luxS.
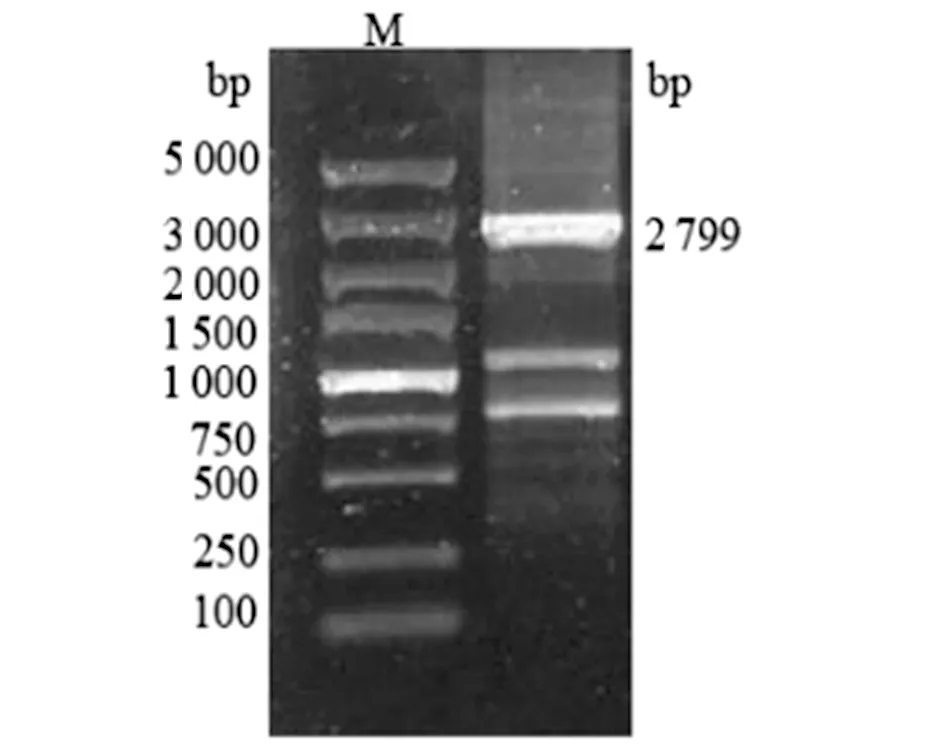
bM: DNA Marker (DL5000)图1 目的片段的扩增Fig.1 Amplification of target fragments
2.2重组质粒 pWM 91-ΔluxS的构建与鉴定对构建好的重组质粒 pWM 91-ΔluxS利用SacI、NotI进行双酶切验证。从图2中可以初步判断,3 号重组质粒被切成两条大小为8 000 bp和2 800 bp左右的片段,与预期结果一致。3 号质粒测序结果显示,luxS缺失片段序列正确,重组质粒构建成功。
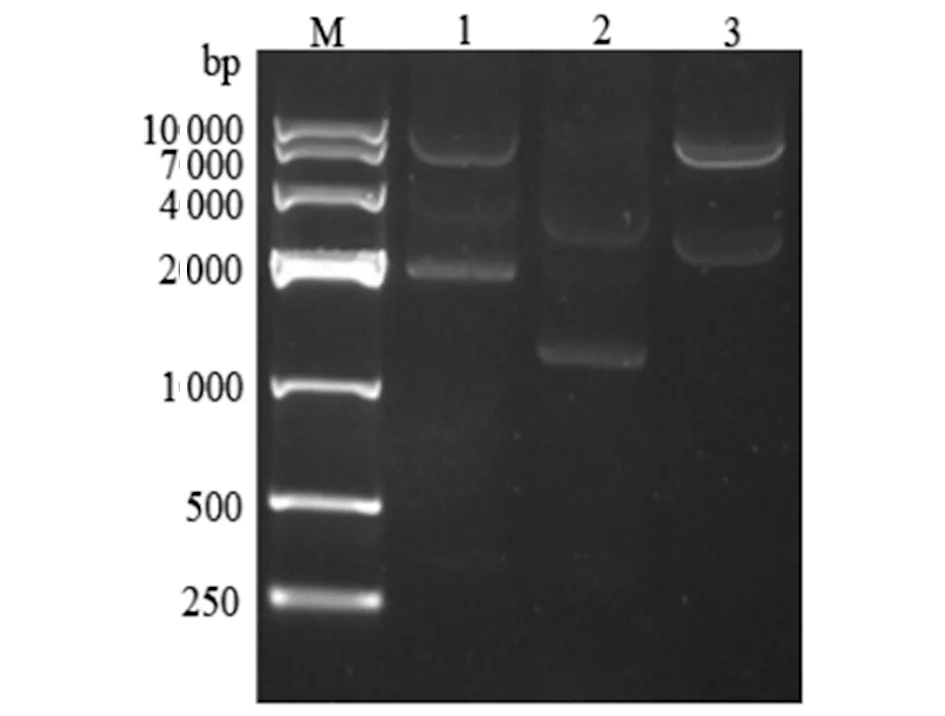
M: DNA Marker (DL10000); 1-3: Sac I/ Not I digestion of recombinant plasmid.图2 重组质粒 pWM91-ΔluxS的鉴定Fig.2 Identification of recombinant plasmid pWM91-ΔluxS
2.3突变株的筛选与鉴定将2.2中筛选含有正确重组质粒的E.coliSM 10(λpir)菌株与嗜水气单胞菌ATCC7966 0.45 μm的滤膜上进行接合,筛选嗜水气单胞菌luxS基因缺失突变株。以筛选菌株基因组为模板,利用引物a和f进行验证,结果如图3所示。野生株中luxS基因的片段大小为2 500 bp左右,而突变株中luxS基因片段大小与重组质粒pWM91-ΔluxS中luxS基因片段大小一致,为2 800 bp左右,待筛选的突变株luxS基因PCR 产物与预期相符。该PCR产物测序结果显示与目的片段一致,证明突变株构建成功,突变株以嗜水气单胞菌ΔluxS命名。
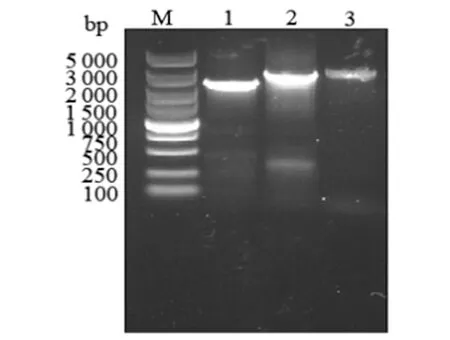
1: Genome of the wild strain as template; 2: pWM91-ΔluxSas template; 3: Genome of the mutant strain as template.
图3PCR鉴定突变株
Fig.3Identification of the mutant strains by PCR analysis
2.4生长曲线测定由图4可知,嗜水气单胞菌野生株的延滞期短,能够迅速进入对数生长期,在12 h左右进入稳定期,OD600达到9.0左右。而突变株的延滞期较长,在10 h左右进入对数期快速生长,18 h左右时生长减缓,但仍保持生长趋势,40 h OD600达到7.4左右。突变株的生长速度与野生株相比明显降低,生长周期延长,证明luxS基因对嗜水气单胞菌的生长具有明显的调控作用。
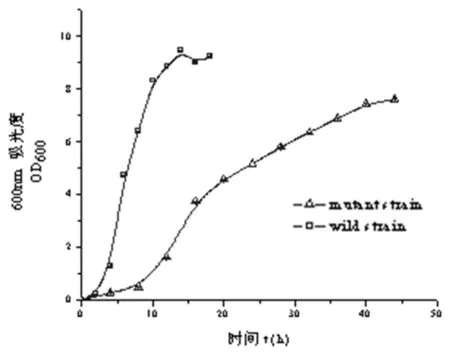
图4野生株和突变株的生长曲线
Fig.4Growth curves of wild strain and mutant strain
2.5AI-2活性检测利用哈维氏弧菌报告菌株 BB 170 检测嗜水气单胞菌及其luxS基因缺失突变株培养上清液中的 AI-2 活性。结果如图 5 所示,嗜水气单胞菌野生株不同培养时间制备的上清液均可诱导BB170 发光,培养4 h~16 h所得嗜水气单胞菌上清液的诱导发光值呈现先上升后下降的趋势,在 8 h时达到最大,为13 327.0±772.5;而培养4 h~44 h所得突变株上清液的诱导发光值均降低至与阴性对照水平接近,证明该突变株基本丧失合成AI-2的能力。
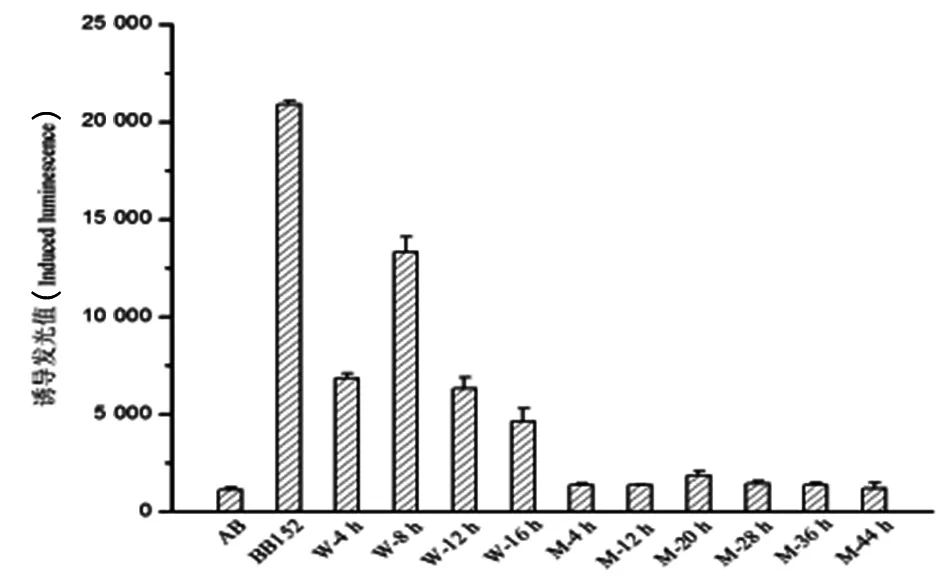
W: wild strain; M: mutant strain.图5 AI-2活性的测定Fig.5 Detection of AI-2 activity
2.6胞外蛋白酶的检测利用偶氮酪蛋白法测定胞外蛋白酶活性,结果如图6a所示。野生株和突变株分泌的胞外蛋白酶活性在12 h~48 h内均呈递增的趋势,野生株48 h培养上清液中胞外蛋白酶活力为91.2 U±3.9 U,而突变株48 h培养上清液中胞外蛋白酶活力仅为6.4 U±0.6 U。上述结果表明,突变株分泌胞外蛋白酶的能力明显降低。
2.7生物膜形成能力的测定利用结晶紫染色法定量测定生物膜的形成,表2显示突变株生物膜形成能力明显小于野生株,24 h时突变株生物膜形成量仅为野生株生物膜形成量的14.5%,36 h时突变株生物膜形成量为野生株生物膜形成量的60.0%。可见luxS基因在嗜水气单胞菌生长早期对其生物膜形成的影响更为显著。
利用倒置荧光显微镜观察野生株与突变株的生物膜形成过程。图7A1-A4显示,突变株在12 h~36 h菌体细胞相互连接,并聚集成团,团块随时间增加逐渐变大,有成膜趋势,48 h突变株成团的菌落相互融合,形成成熟的生物膜。图7B1-B4显示,野生株12 h时菌体细胞已经开始相互连接,并聚集成团,24 h相邻菌落相互融合,初步形成生物膜,36 h-48 h时生物膜成熟,其形态随时间增加逐渐均匀、密集。与野生株相比,突变株的生物膜形成时间明显晚于野生株,生物膜分布不均匀,结构更为疏松。
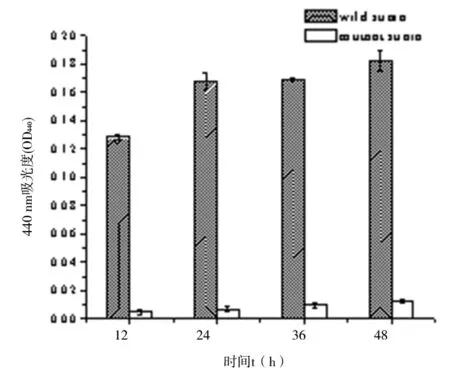
1: LB; 2: wild strain; 3: mutant strain.图6 胞外蛋白酶的检测Fig.6 Determination of extracellular protease
表2生物膜形成能力的测定
Tab.2Determination of biofilm forming ability

时间T(h)590nm吸光度OD590野生株wildstrain突变株mutantstrain242.2±0.390.32±0.13363.0±0.781.8±0.07
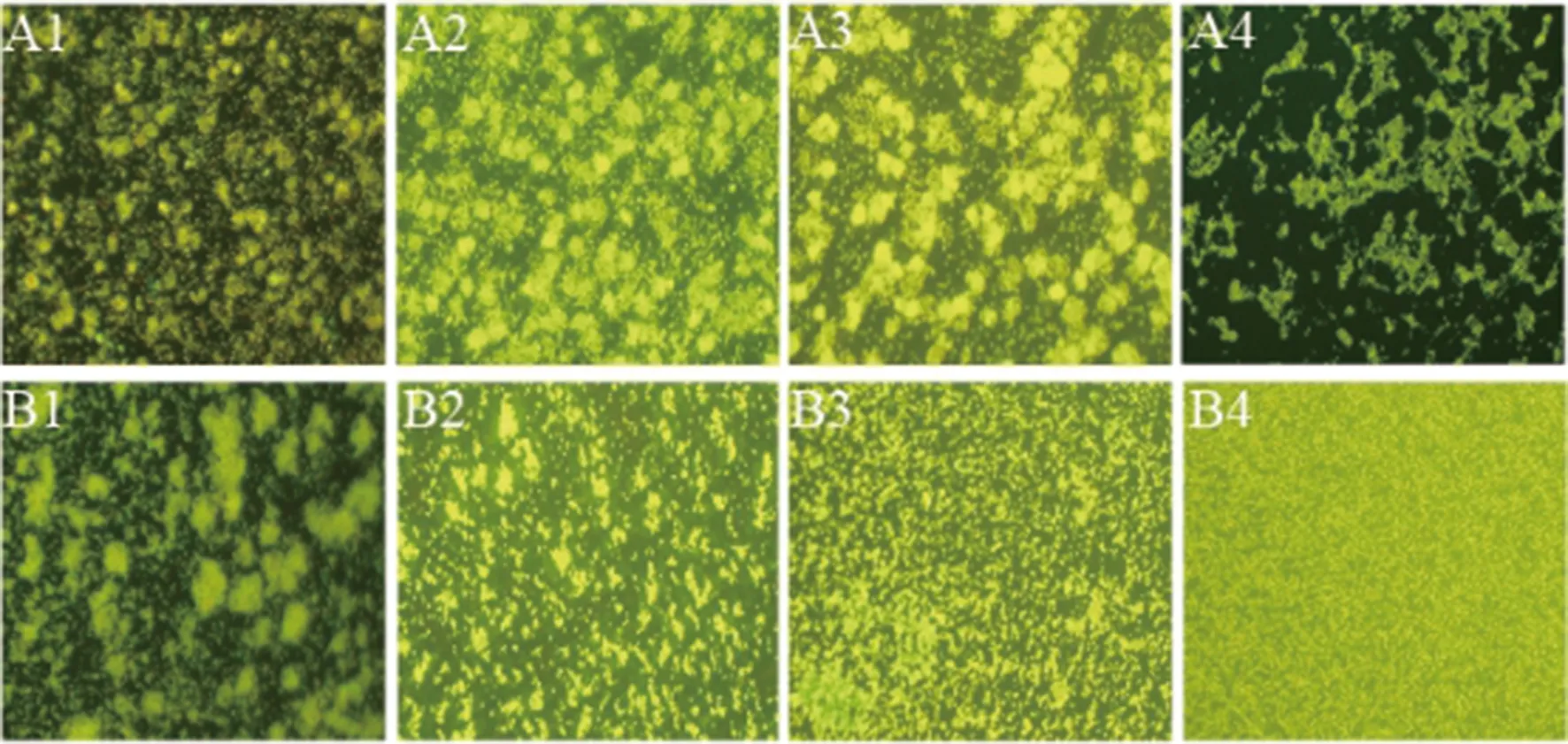
A1: Mutant strain of 12 h culture; A2: The mutant strain of 24 h culture;A3: Mutant strain of 36 h culture; A4: The mutant strain of 48 h culture;B1: Wild strain of 12 h culture; B2: The wild strain of 24 h culture;B3: Wild strain of 36 h culture; B4: The wild strain of 48 h culture.图7 生物膜的荧光显微镜照片Fig.7 Fluorescence microscope image of biofilms
3讨论
群体感应系统是细菌间交流的主要方式之一,LuxS/AI-2群体感应系统参与多种生物行为,包括生物膜的形成及毒力因子的产生。Han[13]等研究发现,信号分子AI-2在迟钝爱德华氏菌生长的对数早期就发挥了调控毒力因子的作用。张耀超[14]等研究显示,变异链球菌luxS基因缺失后,菌体形成的生物膜结构发生改变,生物膜形成能力下降。张敏[15]等研究显示,迟钝爱德华氏菌luxS基因的突变能够影响其 III-型分泌系统、生物膜的形成及丝氨酸蛋白酶的表达。本课题组前期实验以S-腺苷高半胱氨酸为底物,利用表达并纯化的LuxS蛋白和MtnN-1蛋白、MtnN-2蛋白共同催化,体外合成了具有活性的AI-2[16],证明LuxS蛋白在嗜水气单胞菌AI-2的合成过程起着不可或缺的作用。
本研究依据同源重组原理构建了嗜水气单胞菌ATCC7966luxS基因缺失突变株,通过PCR及测序鉴定luxS基因缺失突变株构建成功。生物学特性研究结果显示:突变株的生长变缓,证明luxS基因在嗜水气单胞菌生长过程中起着非常重要的调节作用;突变株培养上清液中AI-2活性降低至阴性对照水平,证明luxS基因直接调控信号分子AI-2的合成,该结论与本课题组前期体外合成AI-2实验结论一致。本文选取胞外蛋白酶及生物膜两种表征细菌毒力的因素进行研究,以反映luxS基因缺失对嗜水气单胞菌毒力的影响。胞外蛋白酶是嗜水气单胞菌主要的毒力因子之一,不仅能为其生存和生长提供必需的氨基酸,而且还可直接破坏宿主的补体或免疫球蛋白,使其逃避宿主补体系统和免疫系统的防御机制[17]。采用偶氮酪蛋白法检测不到明显的胞外蛋白酶活性,证明luxS基因显著调控嗜水气单胞菌胞外蛋白酶的表达。生物膜是由细菌菌体和其自身分泌的多糖、纤维蛋白、脂蛋白等多种糖蛋白复合物相互包裹而成[18],是细菌的一种自我保护屏障,能保护其免受宿主免疫系统或抗菌药物的杀灭。本研究发现luxS基因对菌体生长早期生物膜的形成影响更为显著。与野生株相比,突变株生物膜形成能力较弱,形成时间明显晚于野生株,菌体细胞间的空隙更大,生物膜更为疏松。
本研究首次针对嗜水气单胞菌ATCC7966株,报道了luxS基因缺失对其生物学特性的影响。上述实验结果与已有研究对比发现,嗜水气单胞菌不同菌株中luxS基因对菌株特性的调控作用存在一定差异。关于嗜水气单胞菌J-1株的研究表明,其ΔluxS缺失株虽然生长相对缓慢,但与J-1株生长周期较为一致,基本同时进入对数生长期;其ΔluxS缺失株仍然能够分泌胞外蛋白酶,luxS基因缺失并不影响菌株对数生长期丝氨酸蛋白酶基因(serP)表达,在菌株生长稳定期对于serP表达量则有显著抑制作用[19]。关于一株致腹泻的嗜水气单胞菌SSU株的研究表明,以玻璃盖片为基质,其ΔluxS突变株生物膜的形成速度明显快于野生株;以玻璃或塑料盖片为基质,野生株生物膜在基质中央松散分布,ΔluxS突变株生物膜则更为均匀密集[20]。上述报道与本研究的差异表明:luxS基因在嗜水气单胞菌不同菌株的生理功能调控方面发挥的作用并非完全相同,这种有趣的现象值得进一步研究。比较不同菌株之间luxS基因编码蛋白的功能,将有助于完整地阐述该基因对嗜水气单胞菌生理状态及毒力的影响。
本研究结果表明,嗜水气单胞菌ATCC7966株luxS基因对于菌体生长、AI-2合成、胞外蛋白酶合成及生物膜形成均有明显的调控作用,本研究为进一步研究LuxS/AI-2 QS系统在嗜水气单胞菌致病机制中的地位奠定了基础。
参考文献:
[1] Khajanchi BK, Sha J, Kozlov EV, et al. N-Acylhomoserine lactones involved in quorn sensing control the type Ⅳ secretion system, biofilm formation, protease production, and in virulence in a clinical isolate ofAeromonashydrophila[J].Microbiology, 2009, 155: 3518-3531. DOI: 10. 1099/mic.0.031575-0 [2] Vivas J, Carracedo B, Riano J, et al. Behavior of anAeromonashydrophilaaroA live vaccine in water microcosms[J].Appl Environ Microb, 2004, 70(5): 2702-2708. DOI: 10. 1128/AEM. 70. 5. 2702-2708. 2004
[3] Jayaraman A, Wood TK. Bacterial Quorum Sensing: signals, circuits, and implications for biofilms and disease[J]. Annu Rev Biomed Eng, 2008, 10: 145-167. DOI: 10. 1146/annurew. bioeng. 10. 061807. 160536
[4] Shen XF, Zhai XX, Wen ZC, et al. Cloning, expression an antigenicity analysis of recombinantAeromonashydrophilaflagellar FlaB protein[J]. Chin J Zoonoses, 2015, 31(3): 199-202. DOI: 10. 3969/cjz. j. issn. 1002-2694. 2015. 03. 02 (in Chinese)
沈雪飞, 翟新新, 温振才,等. 嗜水气单胞菌鞭毛蛋白基因flaB的克隆、 表达及其免疫原性分析[J]. 中国人兽共患病学报, 2015, 31(3): 199-202.
[5] Croxatto A, Pride J, Hardman A, et al. A distinctive dual-channel quorum-sensing system operates inVibrioanguillarum[J]. Mol Microbiol, 2004, 52(6): 1677-1689. DOI: 10. 111/j. 1365-2958. 2004. 04083. x
[6] Kim SY, Lee SE, Kim YR, et al. Regulation ofVibriovulnificusvirulence by the LuxS quorum-sensing system[J]. Mol Microbiol, 2003, 48(6): 1647-1664. DOI: 10. 1046/j. 1365-2958. 2003. 03536. x
[7] Waters CM, Bassler BL. Quorum sensing: cell-to-cell communication in bacteria[J]. Annu Rev Cell Dev Bi, 2005, 21: 319-346. DOI: 10. 1146/annurev. cellbio. 21. 012704. 121001
[8] Seshadri R, Joseph SW, Chopra AK, et al. Genome sequence ofAeromonashydrophilaATCC 7966T: jack of all trades[J]. J Bacteriol, 2006, 188(23): 8272-8282. DOI: 10. 1128/JB. 00621-06
[9] Yu HB, Zhang YL, Lan YL, et al. Identification and characterization of putative virulence genes and gene clusters inAeromonashydrophilaPPD134/91[J]. Appl Environl Microb, 2005, 71(8): 4469-4477. DOI: 10.1128/AEM. 71. 8. 4469-4477. 2005
[10] Greenberg EP, Hastings JW, Ulitzur S. Induction of luciferase synthesis inBeneckeaharveyiby other marine bacteria[J]. Arch Microbiol, 1979, 120(2): 87-91.
[11] Bendicho S, Marti G, Hernatndez O, et al. Determination of proteolytic activity in different milk system[J]. Food Chem, 2002, 79: 245-249. DOI: 10. 1016/S0308-8146(02)00126-7
[12] Stepanovic S,Vukovic D, Dakic I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. J Microbiol Meth, 2000(40): 175-179. DOI: 10. 1016/S0167-7012(00)00122-6
[13] Han Y, Li X, Qi Z, et al. Detection of different quorum-sensing signal molecules in a virulentEdwardsiellatardastrain LTB-4[J]. J Appl Microbiol, 2010, 108(1): 139-147. DOI: 10.1111/j. 1365-2672. 2009. 04405.x
[14] Zhang YC, Han YZ, Han FS, et al. Construction of LuxS-deletedStreptococcusmutans and biofilm formation property of the LuxS-deleted strain[J]. Chin J Conserv Dent, 2012, 22(6): 309-322. DOI: 10. 15956/j.cnki.chin.j. conserv.dent.2012.06.003 (in Chinese)
张耀超, 韩育植, 韩福胜等. 变异链球菌luxS基因缺陷突变株的构建及其生物膜结构的初步观察研究[J]. 牙体牙髓牙周病学杂志, 2012, 22(6): 309-322.
[15] Zhang M, Sun K, Sun L. Regulation of autoinducer 2 production andluxSexpression in a pathogenicEdwardsiellatardastrain[J]. Microbiology, 2008, 154(7): 2060-2069. DOI: 10. 1099/mic. 0. 2008/017343-0
[16] Zhao J, Zhang FR, Cui Y, et al.Invitrobiosynthesis and activity detection of quorum sensing signal molecule AI-2 ofAeromonashydrophila[J]. Microbiol China, 2015, 42(10): 1858-1865. DOI: 10. 13344/j.microbiol.china. 141010 (in Chinese)
赵晶, 张福蓉, 崔一,等. 嗜水气单胞菌群体感应信号分子 AI-2 的细胞外生物合成及活性检测[J]. 微生物学通报, 2015, 42(10): 1858-1865.
[17] Chu WH, Lu CP. Pathogenicity ofAeromonashydrophilaextracellular protease[J]. J Nanjing Agri Univ, 2000, 23(2): 80-84. (in Chinese)
储卫华, 陆承平. 嗜水气单胞菌胞外蛋白酶对鲫鱼的致病性[J]. 南京农业大学学报, 2000, 23(2): 80-84.
[18] Monds RD, O'Toole GA. The developmental model of microbial biofilms: ten years of a paradigm up for review[J]. Trends Microbiol, 2009, 17: 73-87. DOI: 10.1016/j. tim. 2008. 11. 001
[19] Zhang XJ. Construction and characterization ofluxSdeleted mutant strain inAeromonashydrophilaJ-1 [D]. Nanjing Agri Univ, 2009. (in Chinese)
张小军. 嗜水气单胞菌J-1株luxS基因缺失株的构建及特性分析[D].南京:南京农业大学, 2009.
[20] Kozlova EV, Popov VL, Sha J, et al. Mutation in the S-ribosylhomocysteinase (luxS) gene involved in quorum sensing affects biofilm formation and virulence in a clinical isolate ofAeromonashydrophila[J]. Microb Pathogenesis, 2008, 45 (5/6): 343-354. DOI: 10.1016/j.micpath.2008.08.007
DOI:10.3969/j.issn.1002-2694.2016.05.009
通讯作者:赵晶,Email: zhaojing@dlnu.edu.cn;
中图分类号:R378
文献标识码:A
文章编号:1002-2694(2016)05-462-07
Corresponding authors: Chen Ming, Email: chenming@dlpu.edu.cn; Zhao Jing, Email: zhaojing@dlnu.edu.cn.
收稿日期:2015-10-16修回日期:2016-03-21
Construction ofluxSgene deletion mutant strain inAeromonashydrophilaATCC 7966
CUI Yi1, ZHAO Jing2, ZHANG Fu-rong2, GUO Wan-ping2,CHEN Ming1,QUAN Chun-shan2, FAN Sheng-di2
(1.SchoolofBiologicalEngineering,DalianPolytechnicUniversity,Dalian116034,China;2.CollegeofLifeScience,DalianNationalitiesUniversity,StateEthnicAffairsCommission-MinistryofEducationKeyLaboratoryofBiochemicalEngineering,DalianNationalitiesUniversity,Dalian116600,China)
Abstract:The influences of synthase encoding gene luxS of quorum sensing signal molecule AI-2 on the physiological characteristics and virulence factors of the Aeromonas hydrophila ATCC 7966 was studied. Based on the principle of homologous recombination, recombinant gene knock-out vector was constructed consisting of Kanr cassette with the flanking homologous regions of gene luxS. The constructed recombinant plasmid was transformed into competent Escherichia coli SM 10 (λpir) cells and was further transferred into Aeromonas hydrophila ATCC 7966 by conjugation. The luxS gene deletion mutant strain was confirmed by resistance screening, PCR and DNA sequencing. Growth rates, ability of AI-2 synthesis, extracellular protease synthesis and biofilm formation were compared between the wild strain and luxS gene deletion mutant strain. Results suggested that luxS gene deletion mutant strain of Aeromonas hydrophila ATCC 7966 was successfully constructed. Compared with the wild strain, the growth cycle of the mutant strain was extended, the ability to synthesize AI-2 and extracellular protease were lost. Biofilm forming ability of the mutant strain was decreased, which was 14.5% and 60.0% of that of the wild strain at 24 hours and 36 hours respectively. Compared with the wild strain, biofilm formation rate of the mutant strain was slower and biofilm structure was looser. It was indicated that luxS gene was involved in the regulation of the growth, AI-2 synthesis and the expression of virulence factors of Aeromonas hydrophila. This study laid the foundation for further investigation of the role of luxS gene in the pathogenesis of Aeromonas hydrophila.
Key words:Aeromonas hydrophila; luxS; AI-2; extracellular protease; biofilm Supported by the Science Research General Project of Department of Education of Liaoning Province (No.L2013508) and Fundamental Research Fund for the Central Universities (No.DC201502020407).
辽宁省教育厅项目(L2013508);校基本科研业务费项目(DC201502020407)联合资助
陈明,Email: chenming@dlpu.edu.cn
