田鼠巴贝虫感染FTA-环介导等温扩增检测技术的建立
2016-07-28蔡玉春秦志强陈绍红吴秀萍陈家旭
吴 芬,蔡玉春,秦志强,艾 琳,卢 艳,陈绍红,吴秀萍,陈家旭
田鼠巴贝虫感染FTA-环介导等温扩增检测技术的建立
吴芬,蔡玉春,秦志强,艾琳,卢艳,陈绍红,吴秀萍,陈家旭
中国疾病预防控制中心寄生虫病预防控制所,卫生部寄生虫病原与媒介生物学重点实验室,世界卫生组织疟疾、血吸虫病和丝虫病合作中心,上海200025
摘要:目的建立敏感、特异、高效的检测田鼠巴贝虫 FTA-环介导等温扩增技术(LAMP)。方法根据GenBank公布的田鼠巴贝虫基因序列,就细胞色素B基因保守序列设计了多套LAMP引物,利用LAMP RealTime Turbidimeter LA-320 仪筛选最佳引物、反应条件,建立LAMP检测方法,从保存有血液样本的FTA卡片中提取田鼠巴贝虫 DNA进行LAMP,观察检测效果。结果设计的4组引物做LAMP试验,其中以引物1,最佳反应温度为64 ℃,恒温下作用,敏感性高,可在1 h内完成,其检出限量为0.687 fg/μL,而PCR的最低检测量为0.687 pg/μL,与间日疟原虫、恶性疟原虫、卵形疟原虫、三日疟原虫、诺氏疟原虫、冈地弓形虫、利什曼原虫、冈比亚锥虫均无交叉反应。以建立的FTA-LAMP法检测20份PCR检测阳性的田鼠巴贝虫感染者血样,其阳性符合率100%。结论成功建立了检测田鼠巴贝虫特异性细胞色素B基因的FTA-LAMP方法,该法特异性强、灵敏度高、简便、快速、适于现场应用。
关键词:田鼠巴贝虫;环介导等温扩增技术;FTA卡;细胞色素B基因
Supported by the Special Fund for Health Research in the Public Interest (No.201202019)
田鼠巴贝虫(Babesiamicroti)又称微小巴贝虫,是一种类似于疟原虫的人兽共患血液寄生虫,主要经蜱叮咬及输血传播[1]。如果在身体虚弱、免疫力低下的情况感染巴贝虫,将出现严重后果,甚至死亡。高危地区巴贝虫病防控与监测工作中存在快速评价、正确诊断、输血及血制品的安全等3大实际问题,急需敏感性与特异性较高的巴贝虫筛查技术。
当前诊断巴贝虫病方法包括:病原检测技术(血涂片染色法、动物接种法等)、免疫学检测(ELISA、IFA等)及分子生物学技术(普通PCR、实时定量PCR等)。但并不理想。近年来一种全新的核酸扩增技术——环介导等温扩增技术(Loop mediated isothermal amplification,LAMP)越来越受到研究人员的关注。
Salem等[2]报道,他们在利用细胞色素B基因(cytochrome B,cytB)作为靶基因建立PCR检测方法检测牛巴贝虫和双芽巴贝虫时发现,该方法要比利用18SrRNA作为靶基因建立的方法灵敏20%。
现场血液样本的采集、运输、保存,常受到一些条件的限制,尤其是当采集样本数较多时,亟需探索易于运输、保存,又利于病原体核酸提取的样本采集方法或措施。FTA (Flinders Technology Associates)卡(FTA卡)[3]是由特制的滤纸经强力变性剂、螯合剂浸泡,细胞与FTA卡接触后被裂解,其核酸与纤维基质结合,维持样品中核酸的完整性,保护核酸免于降解,起到保存作用。这一技术在病毒和一些寄生虫等研究中得到了广泛应用[4-8],但在田鼠巴贝虫检测方面尚未见报道。
1材料与方法
1.1材料
1.1.1虫株田鼠巴贝虫peabody mjr株,购自美国模式培养物集库存(American type culture collection,ATCC),货号:PRA-99; BALB/c小鼠(中科院上海实验动物中心)
1.1.2仪器设备PCR仪(美国 ThermoPX2); 凝胶分析成像系统(Bio-RAD公司Quantity on 4.6.6); 低温离心机(美国Thermo公司); 直径2 mm打孔机(Whatman公司); 涡旋振荡器(北京创博生物科技有限公司); 显微镜(日本奥林巴斯公司); EDTA抗凝管(浙江拱东医疗科技有限公司); LAMP Real Time Turbidimeter LA-302仪(日本荣源株式会社)。1.1.3主要试剂PCR试剂(上海生工公司); DNA提取试剂盒(QIAamp DNA Blood Mini Kit);PCR产物纯化回收试剂盒(上海超研生物科技有限公司); 100 bp DNA Ladder(天根生化科技有限公司); LAMP引物(上海生工公司合成); 钙黄绿素(日本荣源株式会社); 0.9%生理盐水(上海长富制药公司);吉姆萨染液原液(上海怡成生物科技公司); 甲醇(上海振兴化工一厂); E.Z.N.A. Viral Kit(Omega-Bio-tek); FTA纸片(Whatman公司)。
1.2方法
1.2.1引物设计以田鼠巴贝虫细胞色素B基因作为目的基因(GenBank: FO082868.1),采用引物设计软件Primer Explorer 4.0设计4套引物,分别包括外引物F3和B3、内引物FIP和BIP、环引物LF和LB(表1),由生工生物工程公司合成。
表1针对田鼠巴贝虫cytB基因序列设计的LAMP反应引物
Tab.1LAMP reaction primers designed for B.microti cytB gene sequence

引物组别Group引物Primer序列组成(5'→3')Sequence11F3/10CATGTTTATGTACGCTCATCT1B3CCTAAGGTACTACTATTTACAGAGT1FIPGCCAATAGCGTAGGATAACATTAGTTAAGGGACTATGGTATTCATGC1BIPTGTATTACCATATGGCCAAATGAGCAGTTAGTCCTTTGTTCCAGT1LFCCTGTATACCACGATAAAGGGAGA1LBGGAGCTACGGTAATCATTAACTTGT22F3/1AGATATCTGCATAGTAATGGAGTA2B3AGAACAAGTTAATGATTACCGTA2FIPAGGGAGATATGTGCATGAATACCATGTCTGTTCTTCATGTTTATGTACG2BIPCTAATGTTATCCTACGCTATTGGCTCCAGTAGCTCATTTGGCC33F3/23TCATCTAATTAAGGGACTATGGTAT3B3CCTAAGGTACTACTATTTACAGAGT3FIPGCCAATAGCGTAGGATAACATTAGTGCACATATCTCCCTTTATCGT3BIPTATGGCCAAATGAGCTACTGGGAGTAACTCAGTTAGTCCTTTGT44F3/4CATGTTTATGTACGCTCATCT4B3CTAAGGTACTACTATTTACAGAGT4FIPGCCAATAGCGTAGGATAACATTAGTGGGACTATGGTATTCATGC4BIPTTACCATATGGCCAAATGAGCTAGTTAGTCCTTTGTTCCAGT4LFCCTGTATACCACGATAAAGGGAGA4LBGGAGCTACGGTAATCATTAACTTGT
1.2.2动物模型及DNA模板制备
1.2.2.1田鼠巴贝虫动物模型取红细胞染虫率为60%的田鼠巴贝虫感染 BALB/c小鼠血,置EDTA抗凝管中,再在无菌条件下按1∶2比例加入0.9%生理盐水稀释使虫密度为20%,接种正常BALB/c小鼠,每只腹腔注射0.1 mL。接种后每日涂血片观察红细胞染虫率。至感染后第7天,红细胞染虫率达到高峰时,眼眶取血,-20 ℃,保存备用。
1.2.2.2田鼠巴贝虫DNA提取用DNA提取试剂盒提取全虫DNA,按说明书进行操作。
1.2.2.3Cyt b基因模板PCR测定Cyt b基因PCR反应体系为25 μL:10×PCR Buffer 2.5 μL,Taq DNA酶(5 U/μL)0.15 μL,dNTPs(2.5 mmol/μL)2 μL,上游引物(10pmol/μL)1 μL,下游引物(10 pmol/μL)1 μL,Template 1 μL,ddH2O 18.35 μL 。PCR扩增:94 ℃变性5 min进入循环,94 ℃ 45 s,60 ℃ 30 s,72 ℃ 70 s,35个循环后72 ℃保温10 min。同时设置空白阴性对照。得到的产物用1.5%的琼脂糖凝胶电泳进行检测后回收、纯化,测序鉴定最后测定浓度为以后反应作为模板。
1.2.3LAMP反应条件确定
1.2.3.1反应温度LAMP反应体系根据E.Z.N.A. Viral Kit试剂盒说明书进行,反应分别在61 ℃、62 ℃、63 ℃、64 ℃、65 ℃下进行,以确定最佳反应温度。
1.2.3.2LAMP扩增产物测定LAMP Real Time Turbidimeter LA-302仪检测扩增曲线,反应时加入1 μL荧光染料观察颜色变化,或取5 μL田鼠巴贝虫 LAMP反应产物,加1 μL 6×loading buffer,于2%琼脂糖凝胶电泳检测,观察是否有梯状条带产生。
1.2.4LAMP效果测试
1.2.4.1特异性试验以田鼠巴贝虫细胞色素B基因进行LAMP反应,观察浊度仪实时扩增曲线,产物采用琼脂糖凝胶电泳和加入钙黄绿素观察结果。另有10份间日疟原虫、10份恶性疟原虫、2份卵形疟原虫、3份三日疟原虫、1份诺氏疟原虫、5份冈地弓形虫、5份利什曼原虫、1份冈比亚锥虫、10份田鼠巴贝虫DNA样。分别进行PCR和LAMP实验,产物采用琼脂糖凝胶电泳和浊度仪实时扩增曲线观察结果。
1.2.4.2灵敏度试验检测基因的重组质粒PET28a-CytB浓度,10倍稀释法稀释并以此为模板进行LAMP实验,观察浊度仪实时扩增曲线或琼脂糖凝胶电泳结果,并计算其检测限。
1.2.4.3重复性实验每个反应同样条件下重复3次,以保证方法的稳定性。
1.2.5FTA-LAMP试验1.2.5.1FTA卡采集感染鼠血液样本同1.2.2.1所述方法,建立田鼠巴贝虫感染小鼠模型,于感染前及感染后21 d连续采集实验鼠尾静脉血,涂血片观察染虫率,并点于FTA卡片上,室温保存备用。
1.2.5.2FTA卡DNA模板提取取出点有田鼠巴贝虫感染鼠血样的FTA卡,按FTA卡操作说明步骤操作。用打孔器取直径为2 mm的滤纸片,置于1.5 mL EP管中,加入FTA 纯化试剂 200 μL置于室温下5 min,弃掉液体重复3遍,将装有滤纸片的EP管置于56 ℃干燥30 min后,进行PCR和LAMP检测。
1.2.5.3PCR与LAMP对比检测将处理样本移入到PCR管中,加入10×PCR Buffer 2.5 μL,Taq DNA酶(5 U/μL)0.15 μL,dNTPs(2.5 mmol/μL)2 μL,上游引物(10 pmol/μL)1 μL,下游引物(10 pmol/μL)1 μL,ddH2O 18.35 μL。反应条件:94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,反应25个循环,最后72 ℃延伸5 min。LAMP反应体系根据E.Z.N.A. Viral Kit试剂盒说明书进行,64 ℃,60 min。
1.2.6LAMP应用实验对临床采集的20份PCR检测阳性的田鼠巴贝虫感染病例血液采用初步建立的LAMP法进行检测。
2结果
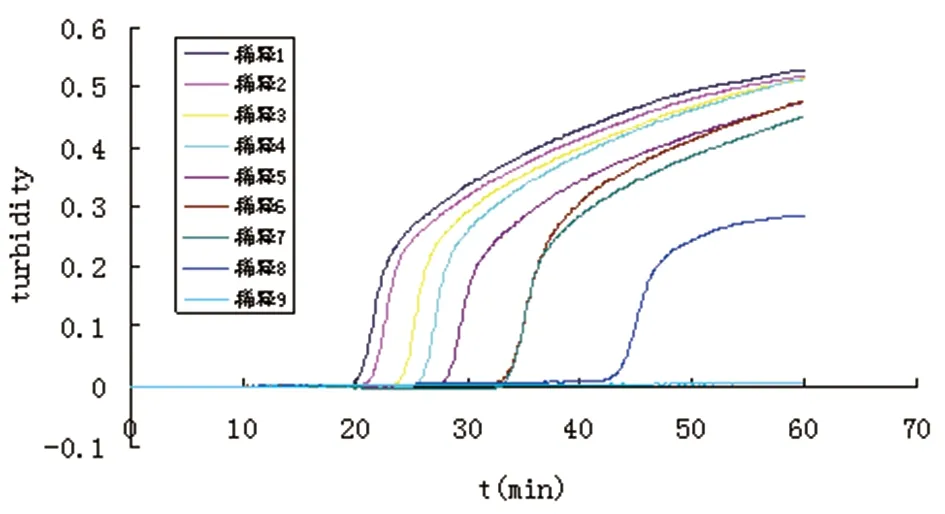
2.1田鼠巴贝虫LAMP反应温度及引物的确定LAMP反应结束后,用LAMP Real Time Turbidimeter LA-302仪检测扩增曲线,阳性可以观察到扩增曲线,阴性则观察不到(图1)。2%琼脂糖凝胶电泳检测后,阳性可以观察到梯状条带,阴性对照则无条带出现(图2)。反应时加入1 μL荧光染料观察颜色变化,可观察到阳性反应管颜色变为绿色,阴性对照则为橙色。64℃的温度LAMP反应速度最快,29 min开始扩增,54 min达到最高峰,以64 ℃为最佳温度(图3),4套引物中,引物1于22 min时开始反应,47 min达到了高峰值,远较其它三组引物反应的时间都短,因此以引物1为最好(图4)。
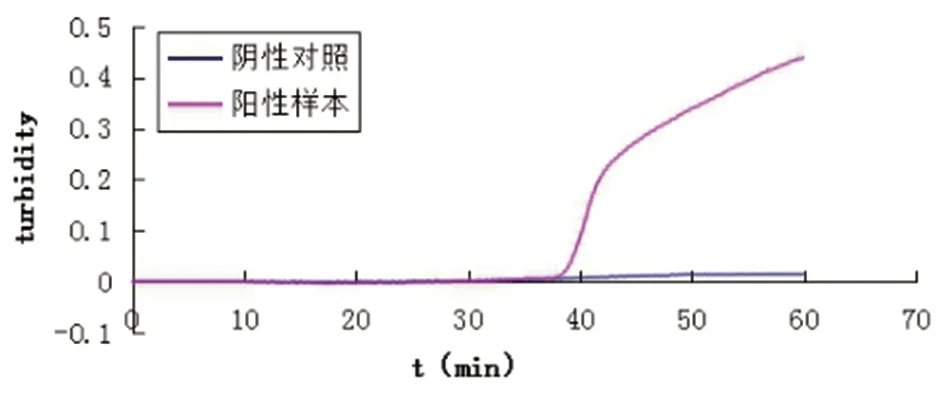
图1 LAMP检测浊度仪扩增曲线图Fig.1 LAMP detection of the amplification curve of the turbidity

M.DNA Marker II;1.阴性样品LAMP扩增结果;2.阳性样品LAMP扩增结果
M:DNA Marker; 1: LAMP product of negative samples;2:LAMP product of positive samples
图2LAMP检测产物琼脂糖凝胶电泳图
Fig.2LAMP productdetected by agarose gel electrophoresis
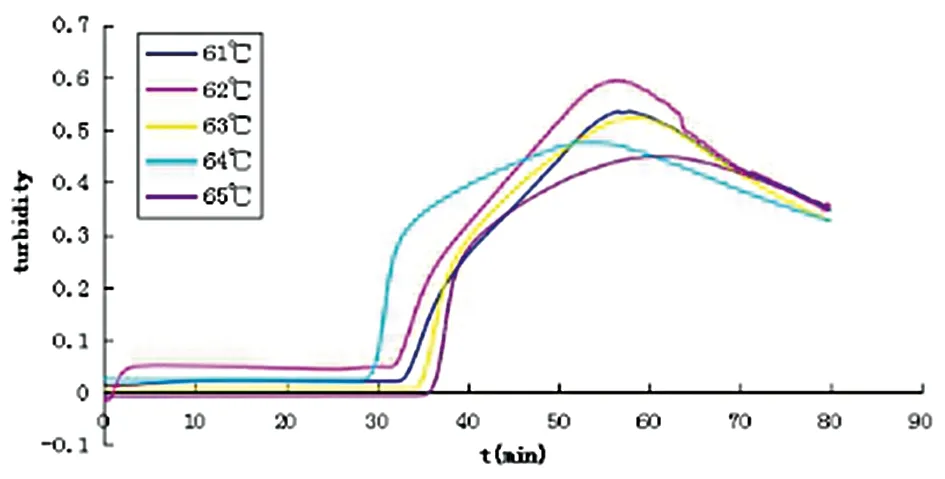
图3 不同温度条件下LAMP检测扩增曲线图Fig.3 The amplification curve of LAMP under different temperature conditions
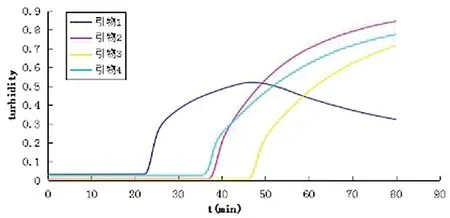
图4 不同引物LAMP检测扩增曲线图Fig.4 The amplification curve of LAMP with different primers
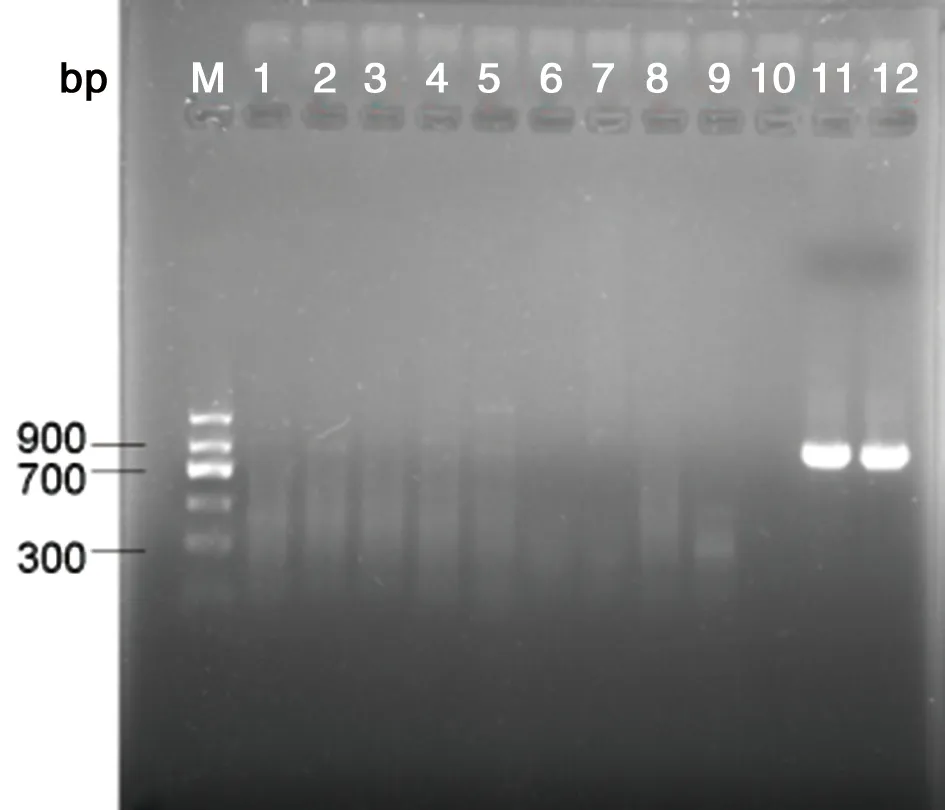
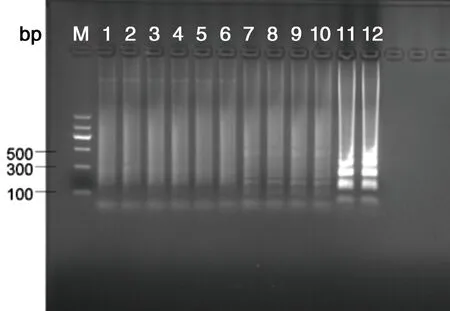
2.2特异性试验结果以引物1在64 ℃的温度下做LAMP反应对间日疟原虫、恶性疟原虫、卵形疟原虫、三日疟原虫、诺氏疟原虫、冈地弓形虫、利什曼原虫和冈比亚锥虫等感染者血样进行检测,另用PCR方法与其作对照检测,琼脂糖凝胶电泳和浊度仪实时扩增曲线观察结果。验证田鼠巴贝虫LAMP检测方法的特异性。结果表明,仅以田鼠巴贝虫的基因组DNA为模板的反应管呈阳性,其他寄生虫均为阴性(表2、图5)。
A
B
M:DNA Marker;1:正常鼠对照组;2:正常人对照组;3:间日疟病人;4:恶性疟病人;5:卵形疟病人;6:三日疟病人;7:诺氏疟病人;8:冈地弓形虫病人;9:利什曼病人;10:冈比亚锥虫病人;11:田鼠巴贝虫感染者;12:田鼠巴贝虫感染鼠
M:DNA Marker; 1:Mouse DNA; 2:Human DNA; 3:Vivax malaria patientsDNA; 4: Falciparum malaria patients DNA; 5:. Plasmodium falciparumpatients DNA; 6: Malaria quartana patients DNA; 7: Plasmodium falciparum malariapatients DNA; 8: Toxoplasma gondii patientsDNA; 9: Leishmania patientsDNA; 10: Castellanella gambiense patientsDNA; 11: B.microti patients DNA; 12: B.microti in mouse DNA
图5PCR/LAMP特异性产物琼脂糖凝胶电泳图
Fig.5PCR/LAMPproductsdetected by agarose gel electrophoresis
2.3灵敏度实验结果
通过以10倍稀释法稀释的细胞色素B基因为模板进行LAMP扩增和PCR扩增,采用琼脂糖凝胶电泳和浊度仪实时扩增曲线观察结果。结果表明,所建立的田鼠巴贝虫LAMP检测方法的检测限达到了0.687 fg/μL(图6),PCR方法的检测限是0.687 pg/μL(图7)。
表2田鼠巴贝虫FTA-LAMP交叉反应试验结果
Tab.2FTA-LAMP cross reaction test results of B.babesia
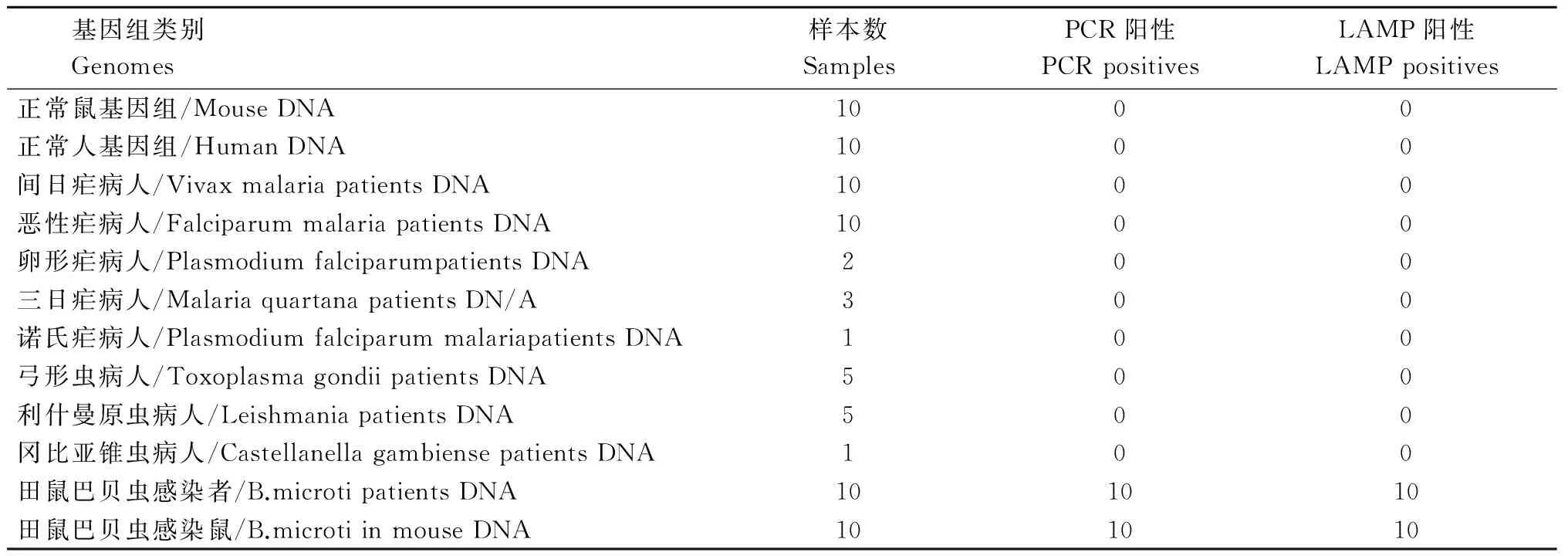
基因组类别Genomes样本数SamplesPCR阳性PCRpositivesLAMP阳性LAMPpositives正常鼠基因组/MouseDNA1000正常人基因组/HumanDNA1000间日疟病人/VivaxmalariapatientsDNA1000恶性疟病人/FalciparummalariapatientsDNA1000卵形疟病人/PlasmodiumfalciparumpatientsDNA200三日疟病人/MalariaquartanapatientsDN/A300诺氏疟病人/PlasmodiumfalciparummalariapatientsDNA100弓形虫病人/ToxoplasmagondiipatientsDNA500利什曼原虫病人/LeishmaniapatientsDNA500冈比亚锥虫病人/CastellanellagambiensepatientsDNA100田鼠巴贝虫感染者/B.microtipatientsDNA101010田鼠巴贝虫感染鼠/B.microtiinmouseDNA101010
A
BM: DNA Marker;1-9为不同稀释度的目标DNA:1:6.87 ng/μL;2:0.687 ng/μL;3: 68.7 pg/μL;4: 6.87 pg/μL;5: 0.687 pg/μL;6: 68.7 fg/μL;7: 6.87 fg/μL;8: 0.687 fg/μL;9: 0.0687 fg/μL。
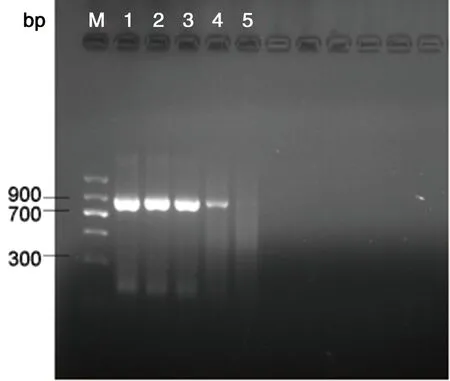
M: DNA Marker; 1-9 for different concentrations of DNA 1: 6.87 ng/μL; 2: 0.687 ng/μL; 3: 68.7 pg/μL; 4: 6.87 pg/μL图6不同浓度田鼠巴贝虫LAMP产物浊度曲线及琼脂糖凝胶电泳图Fig.6LAMPproductsdetected byturbidity meter or agarose gel electrophoresiL; 5: 0.687 pg/μL; 6: 68.7fg/μL; 7: 6.87 fg/L; 8: 0.687 fg/μL; 9: 0.0687 fg/μL.M:DNA Marker;1~9为不同稀释度的目标DNA:1:6.87 ng/μL;2:0.687 ng/μL;3:68.7 pg/μL;4:6.87 pg/μL;5:0.687 pg/μL;6:68.7 fg/μL;7:6.87 fg/μL;8:0.687 fg/μL;9:0.0687 fg/μL。
M:DNA Marker; 1- 9 for different concentrations of DNA 1: 6.87 ng/μL; 2: 0.687 ng/μL; 3: 68.7 pg/μL; 4: 6.87 pg/μL; 5: 0.687 pg/μL; 6: 68.7 fg/μL; 7: 6.87 fg/μL; 8: 0.687 fg/μL; 9: 0.0687 fg/μL
图7不同浓度田鼠巴贝虫PCR琼脂糖凝胶电泳图
Fig.7PCR productsdetected by agarose gel electrophoresis
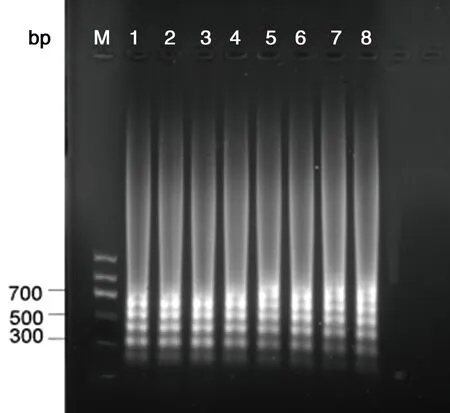
2.4LAMP应用实验对临床采集20份疑似田鼠巴贝虫感染的病例血液DNA,已验证其PCR为阳性,用LAMP检测方法结果图。

M:DNA Marker;-,阴性样本;+,阳性样本;1~20:20份田鼠巴贝虫感染的病例血液DNA。M: DNAMarker; -, negative samples; +, positive samples; 1~20,20 B.microti patients DNA图8 LAMP产物琼脂糖凝胶电泳图Fig.8 LAMP productsdetected by agarose gel electrophoresis
2.5FTA-LAMP连续采集21 d感染小鼠的血液,显微镜下观察血涂片感染率,如下图9所示,用FTA卡保存血样,用PCR和LAMP检测结果图10,11所示。
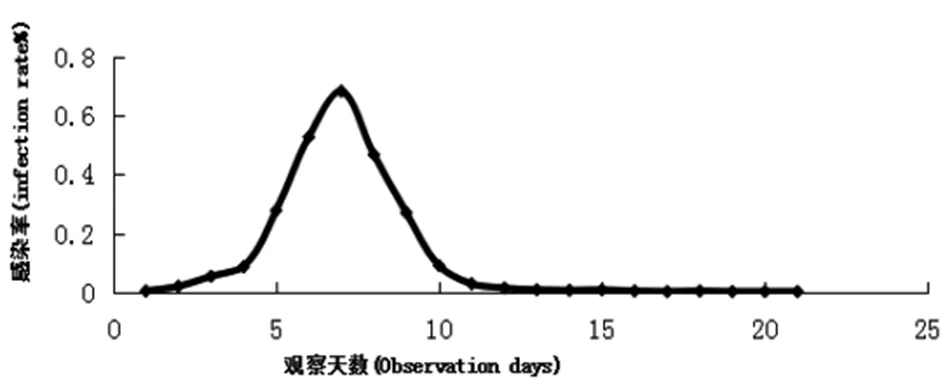
图9 田鼠巴贝虫感染小鼠21 d镜检感染率Fig.9 The infection rate of 21 days in mice with B.microti
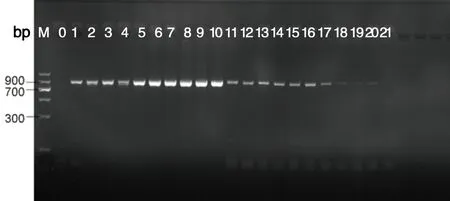
M:DNA Marker;0,阴性样本;1~21:分别是FTA卡保存田鼠巴贝虫感染小鼠21 d血液DNA。M:DNA Marker; 0, negative samples; 1~21: FTA card stored mice blood DNA infected with B.microti 21consecutive days 图10 田鼠巴贝虫感染小鼠21 d血液FTA-PCR结果Fig.10 The FTA-PCR products of 21 days in mice with B.microti
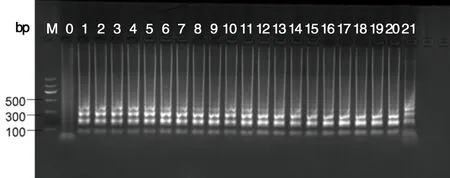
M:DNA Marker;0,阴性样本;1~21:分别是FTA卡保存田鼠巴贝虫感染小鼠21 d血液DNA。M:DNA Marker; 0, negative samples; 1~21: FTA card stored mice blood DNA infected with B.microti 21 consecutive days 图11 田鼠巴贝虫感染小鼠21 d血液FTA-LAMP结果Fig.11 The FTA-LAMP products of 21 days in mice with B.microti
3讨论
环介导等温扩增技术(LAMP)是由日本学者 Notomi等[2]首先提出来的一种全新高效的核酸扩增技术,其特点是针对靶基因的6个独立在链置换 DNA聚合酶(Bst DNA polymerase)的作用下,不需要模板的热变性,在水浴恒温(60~65 ℃),反应30~60 min内将自有几个拷贝的靶核酸即可扩增到109水平[9]。LAMP技术在核酸合成过程中,从脱氧核酸三磷酸基质(dNTPs) 中析出的焦磷酸根离子与反应溶液中的镁离子结合,产生大量白色焦磷酸镁沉淀。因此,可以把浑浊度作为反应的重要指标。操作人员只需用肉眼观察白色浑浊沉淀,就能鉴定扩增与否,而不需要长时间的温度循环,繁琐的电泳以及借助仪器观察LAMP整个检测反应只需1.5 h~2.5 h[1,10],在 LAMP反应终产物中添加染料,直接可用肉眼鉴别明显的颜色差异[11-15]。LAMP敏感性高、特异性强、操作简便、等温高效[16-18]。可以将基因的扩增和产物的检测同步完成,而且不需要昂贵的仪器设备,也没有复杂的操作步骤,扩增结果可以用肉眼直接观察,非常适用于普通实验室和基层单位推广,因此建立田鼠巴贝虫 LAMP诊断技术将会有很大的应用前景。
本研究以田鼠巴贝虫基因组中特异性序列细胞色素B为目的基因,根据LAMP反应原理及引物设计原则,经过优化反应温度后筛选出合适的引物。结果表明,61 ℃,32 min开始扩增,58 min达到高峰;62 ℃ 32 min开始扩增,56 min达到高峰; 63 ℃ 34 min开始扩增,58 min达到高峰;64 ℃ 29 min开始扩增,54 min达到最高峰;65 ℃ 36 min开始扩增,62 min达到高峰。相比较而言64 ℃的温度LAMP反应速度最快,64 ℃为最佳温度。引物1于22 min时开始反应,47 min达到了高峰值;引物2于37 min时开始反应;引物3于47 min时开始反应;引物4于35 min时开始反应。引物1远较其它三组引物反应的时间都短,后3组引物在80 min时实验结束时还未达到高峰,反应时间过长可能会增加假阳性率,所以选择引物1做为实验引物。田鼠巴贝虫 LAMP检测方法的灵敏度非常高,在田鼠巴贝虫 DNA含量只有0.687 fg/μL时,也能够检测出,而PCR的最低检测量为0.687 pg/μL。由于LAMP的高灵敏度,其也相对易产生假阳性结果,本实验通过,加样与检测分实验区,不开盖检测,来降低其假阳性率。特异性实验结果表明,在所检测的11种基因组中未有假阳性假阴性,特异性达到100%。但由于所能获得的相关寄生虫种类有限,所以其特异性还有待更多的寄生虫基因组样本进一步验证。另外,FTA卡提取DNA的PCR/LAMP结果与镜检观察染虫率结果符合,FTA卡保存的血液可以长期保存,携带方便。实验证明,试剂盒直接提取血液内DNA样,长期保存后,DNA易降解,使得实验无法重复,可能与试剂盒提取DNA中含有一些杂质有关。但FTA卡在干燥的环境中,保存血样相对较稳定,样本DNA也可以长期保存,方便现场大量样本采集、携带、贮存。所以FTA-LAMP方法快速灵敏、操作简单、设备要求低,可用于田鼠巴贝虫感染的现场快速检测。
参考文献:
[1] Lobo CA, Rodriguez M, Cursino-Santos JR.Babesia and red cell invasion[J]. Curr Opin Hematol, 2012, 19(3): 170-175.DOI: 10.1097/MOH.0b013e328352245a
[2] Salem GH, Liu XJ, Johnsrude JD, et al. Development and evaluation of an extra chromosomal DNA-based PCR test for diagnosing bovine babesiosis[J]. Mol Cell Probes, 1999, 13(2): 107-113.DOI:10.1006/mcpr.1998.0223
[3] Fu SL, Liu JW, Ren TH, et al. Research on application of FTA filters in preparation of DNA template[J]. Chinese Journal of Health Laboratory Technology, 2008, 18(6): 1124-1125.(in Chinese)
付素兰, 刘景武, 任天红, 等. FTA 卡在模板 DNA 制备中的应用研究[J]. 中国卫生检验杂志, 2008, 18(6): 1124-1125.
[4] Nuchprayoon S, Saksirisampant W, Jaijakul S, et al. Flinders technology associates (FTA) filter paper-based DNA extraction with polymerase chain reaction (PCR) for detection of Pneumocystis jirovecii from respiratory specimens of immunocompromised patients[J]. J Clin Lab Anal, 2007, 21(6): 382-386. DOI: 10.1002/jcla.20200
[5] Moscoso H, Thayer SG, Hofacre CL, et al. Inactivation, storage, and PCR detection of mycoplasma on FTA filter paper[J]. Avian Dis, 2004, 48(4): 841-850. DOI: 10.1637/7215-060104
[6] Inoue R, Tsukahara T, Sunaba C, et al.Simple and rapid detection of the porcine reproductive and respiratory syndrome virus from pig whole blood using filter paper[J]. J Virol Methods, 2007, 141(1): 102-106. DOI:10.1016/j.jviromet.2006.11.030
[7] Abdelwhab EM, Lschow D, Harder TC, et al. The use of FTA filter papers for diagnosis of avian influenza virus[J]. J Virol Methods, 2011, 174(1): 120-122. DOI:10.1016/j.jviromet.2011.03.017
[8] Moscoso H, Raybon EO, Thayer SG, et al. Molecular detection and serotyping of infectious bronchitis virus from FTA filter paper[J]. Avian Dis, 2005, 49(1): 24-29. DOI: 10.1637/7220
[9] Nagamine K, Watanabe K, Ohtsuka K, et al. Loop-mediated isothermal amplification reaction using a nondenatured template[J]. Clin Chem, 2001, 47(9): 1742-1743.
[10] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nuleic Acids Res, 2000, 28(12): e63-e63. DOI: 10.1093/nar/28.12.e63
[11] Iwamoto T, Sonobe T, Hayashi K. Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex, M. avium, and M. intracellulare in sputum samples[J]. J Clin Microbiol, 2003, 41(6): 2616-2622. DOI:10.1128/JCM.41.6.2616-2622.2003
[12] Parida M, Horioke K, Ishida H, et al. Rapid detection and differentiation of dengue virus serotypes by a real-time reverse transcription-loop-mediated isothermal amplification assay[J]. J Clin Microbiol, 2005, 43(6): 2895-2903.DOI: 10.1128/JCM.43.6.2895-2903.2005
[13] Hill J, Beriwal S, Chandra I, et al. Loop-mediated isothermal amplification assay for rapid detection of common strains of Escherichia coli[J]. J Clin Microbiol, 2008, 46(8): 2800-2804.DOI: 10.1128/JCM.00152-08
[14] Curtis KA, Rudolph DL, Owen SM. Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification (RT-LAMP)[J]. J Virol Methods, 2008, 151(2): 264-270. DOI:10.1016/j.jviromet.2008.04.011
[15] Lu CB, Luo L, Yang MJ, et al. Colorimetric Detection of HPV6 and HPV16 by Loop Mediated Isothermal Amplification[J].Chinese Journal Of Virology, 2011, 27(1): 64-70. (in Chinese)
芦春斌, 罗乐, 杨梦婕, 等. 基于颜色判定的环介导等温扩增技术检测 HPV6 和 HPV16[J]. 病毒学报, 2011, 27(1): 64-70.
[16] Toriniwa H, Komiya T. Rapid detection and quantification of Japanese encephalitis virus by real-time reverse transcription loop-mediated isothermal amplification[J]. Microbiol Immunol, 2006, 50(5): 379-387. DOI: 10.1111/j.1348-0421.2006.tb03804.x
[17] Yu CX, Yin XR, Wang J, et al. Creation and use of a LAMP kit to rapidly detect snails infected with Schistosoma japonicum[J].Journal of Pathogen Biology, 2011, 6(2): 121-124.(in Chinese)
余传信, 殷旭仁, 王介, 等. 快速检测日本血吸虫感染性钉螺 LAMP 试剂盒的建立及应用兴[J]. 中国病原生物学杂志, 2011, 6(2): 121-124.
[18] Wang C, Yu CX, JI MJ, et al. Use of loop-mediated is othermal amplification ( LAMP)to detect whole blood samples infected withSchistosoma japonicum[J].Journal of Pathogen Biology,2010, 5(10): 749-753.(in Chinese)
王岑, 余传信, 季旻珺, 等. 环介导同温扩增检测全血日本血吸虫 DNA 的研究[J]. 中国病原生物学杂志, 2010, 5(10): 749-753.
DOI:10.3969/j.issn.1002-2694.2016.05.004
通信作者:陈家旭,Email: chenjiaxu1962@163.com
中图分类号:R382
文献标识码:A
文章编号:1002-2694(2016)05-435-07
收稿日期:2015-12-16修回日期:2016-02-26
Development of loop-mediated isothermal amplification (LAMP) assay combined with FTA card for detectingBabesiamicroti
WU Fen, CAI Yu-chun, QIN Zhi-qiang, AI Lin, LU Yan,CHEN Shao-hong, WU Xiu-ping, CHEN Jia-xu
(NationalInstituteofParasiticDiseases,ChineseCenterforDiseaseControlandPrevention,KeyLaboratoryofParasiteandVectorBiology,MinistryofHealth,WHOCollaboratingCenterforMalaria,SchistosomiasisandFilariasis,Shanghai200025,China)
Abstract:The aim was to establish sensitive, specific and high-performance method of loop-mediated isothermal amplification (LAMP) combined with Flinders Technology Associates (FTA) card for detection of Babesia microti. According to the published sequences of B. microti in GenBank, many pairs of primers were designed targeting the conserved region of Cytochrome B gene of B. microti. The amplification was monitored by LAMP Real Time Turbidimeter LA-320. Through optimizing the LAMP primers and reaction conditions, a rapid and specific detection of B. microti was established. Meanwhile, the amplified products were colored by Calcein that could be detected with naked eyes, and also detected by agarose gel electrophoresis. The method of LAMP showed a highly efficient amplification for B. microti target gene which performed at 64 ℃ for 1h by the LAMP Real Time Turbidimeter LA-320. The detection limit was 0.687 fg/μL higher than PCR, no cross reaction with Plasmodium vivax, P. falciparum, P. ovale, P. malariae, P. knowlesi, Toxoplasma gondii, Leishmania donovani, and Trypanosoma gambiense. Blood samples of twenty individuals of positive for B. microti detection with PCR were detected by the established LAMP assay, and the coincidence rate was 100%. FTA-LAMP method for testing the specific cytochrome B gene of Babesia microti is successfully established, with high sensitivity, specificity andsimplicity,and is suitable for field detection.
Key words:Babesia microti; loop-mediated isothermal amplification (LAMP); FTA card; cytochrome B gene Corresponding author: Chen Jia-xu,Email:chenjiaxu1962@163.com
公益性卫生行业科研专项经费资助项目(No.201202019)和上海市卫生计生委青年基金项目(No.20154Y0155)联合资助
