食品中致病微生物检测结果的不确定度评定
2016-07-27邓晓鸿强敏朱新生王韦岗镇江市产品质量监督检验中心江苏镇江212132
邓晓鸿,强敏,朱新生,王韦岗(镇江市产品质量监督检验中心,江苏镇江212132)
食品中致病微生物检测结果的不确定度评定
邓晓鸿,强敏,朱新生,王韦岗
(镇江市产品质量监督检验中心,江苏镇江212132)
摘要:了解本地区抽查的速冻面米制品的微生物指标状况,并探讨金黄色葡萄球菌的定量检测的数值结果的不确定度评定方法。按照国标法GB 4789.1-2010《食品安全国家标准食品微生物学检验总则》、GB 4789.4-2010《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》、GB4789.10-2010《食品安全国家标准食品微生物学检验沙门氏菌检验》和GB 19295-2011《食品安全国家标准速冻面米制品》进行抽样和检测,依据JJF1059.1-2012《测定不确定度评定与表示》,泊松分布及相关统计学方法对检测结果数字不确定度进行评定。抽检的142批次速冻面米制品,两种制品抽检合格率都为100%,得出的两份样品检测结果平均数分别为290 CFU/g和20 CFU/g,相对应该的标准不确定度分别为30 CFU/g和4 CFU/g。本文采用的评定方法,可以对面米制品金黄菌定量检测结果平均数不确定度作出估计,用于速冻面米制品的安全评估。
关键词:速冻面米制品;金黄色葡萄球菌;不确定度
速冻面米制品以小麦粉、大米、杂粮等谷物为主要原料,或同时配以肉、禽、蛋、水产品、蔬菜、果料、糖、油、调味品等单一或多种配料为馅料,经加工成型(或熟制),速冻而成的食品。它包括生制品(即产品冻结前未经加热成熟的制品)和熟制品(即产品冻结前经加热成熟的非即食制品[1]。
根据我国速冻面米制品产业发展和居民消费的特点,GB 19295-2011《食品安全国家标准速冻面米制品》的范围包括了饺子、馄饨、包子、粽子、汤圆等速冻预包装食品。随着年底的临近,各种速冻食品即将也将大量生产,有的企业很早就准备,由于管理不到位,及摆放时间过长,及摆放环境的因素,各种食品受到污染的情况,层出不穷。
金黄色葡萄球菌广泛分布于环境中,人和动物是主要携带者,通常存在于50%或更多健康人群的鼻腔、咽喉、头发和表皮中,对热敏感,一般烹饪煮熟即可杀灭。金黄色葡萄球菌食物中毒主要是由其产生的致病性肠毒素导致的,通常在数量大于105 CFU/g时可能产生致病性肠毒素,引起食物中毒[2]。
2011年12月21日速冻面米制品食品安全国家标准实施以来微生物指标是GB 19295-2011《食品安全国家标准速冻面米制品》的重要内容,分为致病性微生物和指示菌。根据速冻面米制品检验和监测情况,借鉴国际组织和相关国家管理规定,GB 19295-2011《食品安全国家标准速冻面米制品》采用了国际食品微生物标准委员会采样原则[3-4]。
1 材料与方法
1.1材料
1.1.1样品来源
累计2013~2014两年4次监督抽查共142批次速冻面米制品,其中生制品Y188批次,熟制品Y254批次,所有制品中包括水饺,汤圆和速冻包子等类型。
1.1.2培养基
BP计数琼脂:由杭州微生物试剂有限公司提供,按照说明配制;脑心浸出液肉汤(BHI)、兔血浆、营养琼脂小斜面:由绍兴天恒生物技术有限公司提供;生理盐水缓冲液由镇江产品质量监督检验中心微生物制配。
1.1.3仪器
BILON-08比朗均质器:上海比朗仪器公司;Brand移液器:大龙兴创实验仪器(北京)有限公司。
1.1.4微生物限量
速冻面米制品在-18℃以下保存时,不利于金黄色葡萄球菌繁殖和产生肠毒素。国际食品微生物标准委员会根据致病菌及其致病风险,将金黄色葡萄球菌列为一般性危害致病菌,通常采用三级采样方案。三级采样方案具体意义是:规定同一批次产品采样数(n)、微生物指标可接受水平的限量值(m)、最大可允许超出m值的样品数(c)、微生物指标的最高安全限量值(M)[3]。
根据GB19295-2011《食品安全国家标准速冻面米制品》要求,生制品微生物限量见表1。
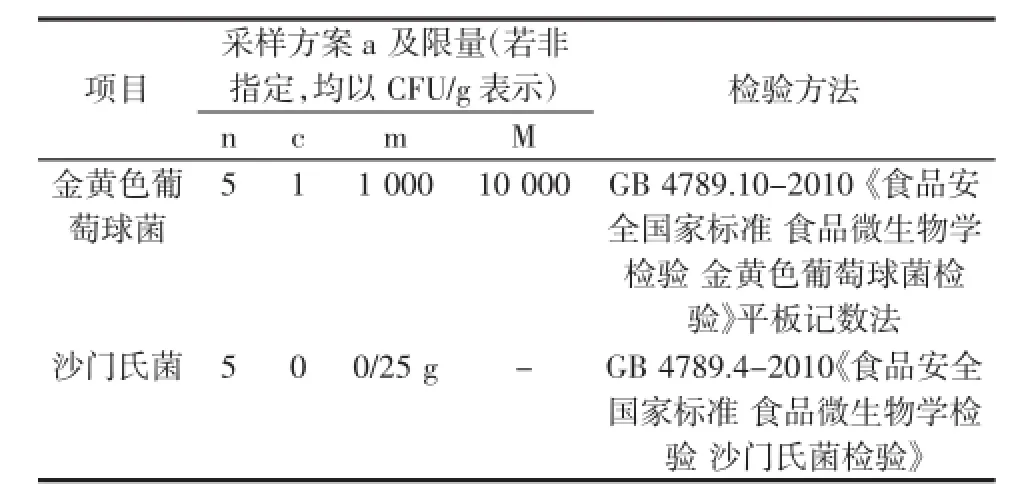
表1 生制品的微生物的限量Table 1 Microbial limit of raw products
由表1可知:新标准采用了三级采样方案,用多个样品定量检测结果进行综合判定,具体规定为:生制速冻预包装面米制品中金黄色葡萄球菌限量为(n=5,c=1,m=103CFU/g,M=104CFU/g)。
根据GB19295-2011《食品安全国家标准速冻面米制品》要求,熟制品微生物限量见表2。

表2 熟制品的微生物的限量Table 2 Microbial limit of cooked products
由表2可知:熟制速冻预包装面米制品金黄色葡萄球菌为(n=5,c=1,m=100 CFU/g,M=1 000 CFU/g),即在同一批次采5个样品,允许全部样品检验值小于或等于100CFU/g,允许1个样品检验值在100CFU/g至1000CFU/g之间;不允许有样品检验值大于103CFU/g;不允许2个及以上样品检测值大于100 CFU/g。
1.2方法
1.2.1金黄色葡萄菌定量检测法的基本步骤[2]
检样按照GB4789.10-2010《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》第二法Baird-Parker平板记数法进行。每稀释度按0.3、0.3、0.4 mL 做3块平板,选择同一稀释度3个平板所有菌落数在20CFU~200CFU的平板,计典型菌落数和典型菌落确认试验,Baird-Parker平板记数法检测的基本程序见图1。

图1 金黄色葡萄球菌Baird-Parker平板法检验程序Fig.1 Staphylococcus aureus Baird-Parker tablet test procedures
1.2.2数学模型的建立及金黄色葡萄菌落总数计算方法[3]
1)只有一个稀释度平板的菌落数在20CFU~200CFU之间且有典型菌落,计数该稀释度平板上的典型菌落;
2)最低稀释度平板的菌落数小于20 CFU且有典型菌落,计数该稀释度平板上的典型菌落;
3)某一稀释度平板的菌落数大于200 CFU且有典型菌落,但下一稀释度平板上没有典型菌落,应计数该稀释度平板上的典型菌落;
4)某一稀释度平板的菌落数大于200 CFU且有典型菌落,且下一稀释度平板上有典型菌落,但其平板上的菌落数不在20 CFU~200 CFU之间,应计数该稀释度平板上的典型菌落;
以上按公式(1)计算。
公式(1):

式中:T为样品中金黄色葡萄球菌菌落数;A为某一稀释度典型菌落的总数;B为某一稀释度血浆凝固酶阳性的菌落数;C为某一稀释度用于血浆凝固酶试验的菌落数;D为稀释因子。
5)2个连续稀释度的平板菌落数均在20 CFU~ 200 CFU之间,按公式(2)计算。

式中:T为样品中金黄色葡萄球菌菌落数;A1为第一稀释度(低稀释倍数)典型菌落的总数;A2为第二稀释度(高稀释倍数)典型菌落的总数;B1为第一稀释度(低稀释倍数)血浆凝固酶阳性的菌落数;B2为第二稀释度(高稀释倍数)血浆凝固酶阳性的菌落数;C1为第一稀释度(低稀释倍数)用于血浆凝固酶试验的菌落数;C2为第二稀释度(高稀释倍数)用于血浆凝固酶试验的菌落数;1.1为计算系数;d为稀释因子(第一稀释度)。
1.2.3金黄色葡萄球定量检测结果的不确定度来源
1)基质及培养条件[标准菌种,培养基质量及培养箱参数(培养时间,温度)]。
2)取样操作(样品取样均匀,溶解均质,样品的逐级稀释)。
3)结果处理(确证试验判定,平板记数,数字修约)。
2 结果与分析
2.1本次抽查样品致病菌检测结果
本次抽查的142批次生熟制品的微生物检测结果见表3。

表3 面米制品的致病菌检测结果Table 3 Pathogenic bacteria detection results of rice products
由表3可知,在本次统计的已检测的142批次的速冻面米制品中,对于沙门氏菌指标,生熟制品所检样品都未检出;对于金黄色葡萄球菌指标,生熟制品所检样品都在国家标准限定值范围内;88份生制品和54份熟制品依据GB 19295-2011《食品安全国家标准速冻面米制品》都符合要求,合格率都为100%。
2.2选定两份样品Y1和Y2检测的结果报告
选定的两份样品Y1(生制品)和Y2(熟制品)检测记录见表4。

表4 样品Y1和Y2检测记录Table 4 Samples Y1 and Y2 detection records
由表4可知:样品Y1和样品Y2都定性地检出了金黄色葡萄球菌,在样品Y1中同批次的5个独立包装中,根据公式(2)生制品有两个连续稀释度(10-1,10-2)平板所有菌落数合计在20 CFU~200 CFU之间,经计算数字分别为:270、410、260、330、190 CFU/g。
在样品Y2中同批次的5个独立包装中,根据公式(1)熟制品结果数字分别为:18、3、0、44 CFU/g和37 CFU/g。结果表明,样品Y1和Y2金黄色葡萄球菌定量未超标,符合国家标准要求且平均报告数分别为:290 CFU/g和20 CFU/g。
2.3各分量不确定度分量[5]
金黄色葡萄球菌计数的不确定度主要由系统性效应和随机性效应引起。本文主要分析稀释度、加样体积、菌落数、个人计数重复性、确证实验人员计数的不确定度。金黄色葡萄球菌计数各分量合成的相对标准不确定度为:

式中:WN为金黄色葡萄球菌计数的相对标准不确定度;WD为稀释过程中相对标准不确定度;WV为样品加样体积的相对标准不确定度;WC为平板金黄菌落数的相对标准不确定度;WT为个人重复计数所产生的不确定度;WQ为血浆凝固酶阳性菌落数的比例所引入的不确定度。
取k=2,U(WN)为扩展标准不确定度,U(WN)=k×WN,而金黄色葡萄球菌总数扩展不确定度为:UN=U(WN)× N,(N为样品一次检测中金黄色葡萄球菌检验平均值。)
2.3.1稀释过程中相对标准不确定度
稀释过程中相对标准不确定度包括:首步10倍稀释(25 g检样+225 mL生理盐水)和后续连续10倍系列稀释(1 mL首步稀释悬液+9 mL生理盐水)所产生的不确定度,每步稀释所产生的相对不确定度平方可由下式计算

式中:a为被稀释固体样品质量或样品稀释液体积;b为生理盐水体积。
试验中除首步外,其余各步稀释均相同。则稀释度的相对不确定度平方为:

在本次试验检测中,用电子天平称取样品25 g(分度0.01 g)加入225 mL生理盐水中(250 mL量筒),它们的容许误差分别为0.01 g和2 mL。两者允差属于矩形分布;后续的稀释中,所用的量器为1 mL和10 mL移液枪,依据JJG 646-2006《移液器检定规程》,吸取1 mL和9 mL时容量允差分别为±1.0%和±0.6%,属于矩形分布[7]。则:
1)天平的相对标准不确定度为:

2)量筒的相对标准不确定度为:

3)移液枪的相对标准不确定度为:

根据公式,则首步稀释的相对不确定度的平方为:

后续稀释各步的相对不确定度的平方:

本次试验中,用于金黄色葡萄球菌平板计数的样品Y1(生制品)稀释度10-1和10-2在计数范围内。
W2D=2W2d1+W2d2=4.271 908×10-5+2.708 7×10-5= 6.980 6×10-5
样品Y2(熟制品)稀释度10-1在计数范围内。W2D=W2d1=2.1360×10-5
2.3.2样品加样体积的相对标准不确定度
分别用1 mL移液器取,每个稀释度分别吸取1 mL样品匀液按0.3、0.3、0.4 mL接种量加入到Baird-Parker平板。依据JJG 646-2006《移液器检定规程》,则本次试验加样过程中,1个独立包装的1个梯度产生的相对标准不确定为:
U2V1mL=U2V0.4mL+U2V0.3mL+U2V0.3mL=3×0.005 772=5.376×10-7
对于样品Y1(生制品),以第一稀释度为准。则加样总体积为5.5 mL。因涉及到稀释度,根据公式(6),则相对标准不确定度为:

对于样品Y2(熟制品),加样总体积为5mL,则相对标准不确定度为:

W2V=1.152 6×10-7
2.3.3平板金黄菌落数的相对标准不确定度
胡巅[8]等认为平板法测金黄菌数的相对标准不确定度宜按照普松分布理论计算,由于泊松分布的可加性,平板上菌落数总和的泊松分布(相对方差)可以由公式W2c=1/C估计得到。则本次试验中:
样品Y1(生制品)相对不确定度平方为:
W2c=1/(270+510+260+330+190)=6.41×10-4
样品Y2(熟制品)相对不确定度平方为:
W2c=1/(18+3+44+37+0)=9.81×10-3
2.3.4个人重复计数所产生的不确定度
本次试验,以重复测量的平均值的相对标准不确定度作为依据,通常的做法是取对数以后在用常规的贝塞尔方法进行计算合成标准不确定度[9]。
生制品Y1组合的平均值,重复次数为10次,每次5个独立包装食品平板菌落总平均值分别为:290、240、180、220、390、360、310、190、210、370 CFU/g。这组数据的平均值为:=280故平均值的标准不确定度为:
则W2T=1.473×10-3
熟制品Y2组合的平均值,重复次数为10次,每次5个独立包装食品平板菌落总平均值分别为:20、35、17、59、44、18、25、40、22、23 CFU/g这组数据的平均值为:=31CFU/g故平均值的标准不确定度为:

2.3.5血浆凝固酶阳性菌落数的比例所引入的不确定度[10]
每个梯度BP平板上长出来的典型菌落任选5个菌落(小于5个全选),做血浆凝固酶试验进行验证[2],因为挑选的差异,则会产生不确定度。
本次试验,重复次数为10次,每次5个独立包装食品平板菌落总数,从典型菌落中样品Y1确证阳性菌落数的比例分别为:0.92、0.96、1.0、0.96、0.88、0.8、 0.92、0.96、1.0、1.0。这组数据的平均值为:0.94
故平均值的标准不确定度为:

对于熟制品Y2,阳性菌落数的比例分别为:1.0、1.0、0.96、1.0、0.92、1.0、0.96、0.96、1.0、0.96。这组数据的平均值为:=0.976故平均值的标准不确定度为:

2.3.6样品中金黄葡萄球菌合成不确定度和扩展不确定度
综合2.3.1-2.3.5各分量不确定度结果,可以得出,样品金黄色葡萄球菌计数合成的相对标准不确定度。
对于样品Y1(生制品),相对标准不确定度为:

对于样品Y2(熟制品),相对标准不确定度为:

在置信概率p=0.95时,取k=2则扩展不确定度为:
样品Y1:U95uel=kp×WN=1.02×10-1,
样品Y2:U95uel=kp×WN=2.32×10-1
根据以上数样品Y1检测结果报告为:平均菌落为290 CFU/g;不确定度为30 CFU/g;样品Y2检测结果报告为:20 CFU/g;不确定度为4 CFU/g。
3 结论
影响金黄色葡萄球菌平板记数法结果不确定度的因素很多,本次试验中主要讨论了稀释度、加样体积、菌落数、个人计数重复性、确证实验人员计数过程中的不确定度。在其整个检测过程中除了上述不确定度之外,结果还受标准菌种、培养基质量、培养箱参数、样品取样均匀、菌落的重叠和菌落的计数误差等因素的影响[10]。
通过对各不确定度分量进行分析和计算表明,样品金黄色葡萄球菌平板记数,重复计数及确证试验血浆凝固酶中阳性菌比例及计数产生的不确定度所占分量最大。
通过选择合适的、可行的试验方案,规范操作就可以减小关键步骤的不确定度分量值,保证检验结果的准确、可靠。该方法可以广泛应用于各类食品中大肠菌群平板计数不确定度的评定[10]。
参考文献:
[1]中华人民共和国卫生部.GB 19295-2011食品安全国家标准速冻面米制品[S].北京:中国标准出版社,2011:1-2
[2]中华人民共和国卫生部.GB 4789.10-2010食品安全国家标准食品微生物学检验金黄色葡萄球菌检验[S].北京:中国标准出版社,2010:1-14
[3]中华人民共和国卫生部.GB 4789.4-2010食品安全国家标准食品微生物学检验沙门氏菌检验[S].北京:中国标准出版社,2010:1-20
[4]中国实验室国家认可委员.ISO-IEC 17025-2005检测和校准实验室能力认可准则[S].北京:中国标准出版社,2005:1-30
[5]国家质量技术监督局.JJF 1059.1-2012测量不确定度评定与表示[S].北京:中国标准出版社,2012:1-55
[6]Seppo I Niemela.Uncertainty of quantitative determinations derived by cultivation of microorganisms[S].Helsink:J4 Advisory Commission for Microbiology,2003:1-76
[7]全国流量容量计量技术委员会.JJF 196-2006常用玻璃量器检定规程[S].北京:中国计量出版社,2007:1-27
[8]胡巅,丁武,李素芳.食品的菌落数检测结果不确定度之评定[J].中国卫生检验杂志,2008,18(8):1494-1497
[9]张卫军,王洪艳.食品中菌落总数检测结果不确定度的评定[J].现代预防医学,2013,40(3):533-535
[10]凌云,王李宝,沈辉,等.食品中大肠菌群平板计数结果不确定度的评定[J].食品与机械,2010,26(5):75-77
DOI:10.3969/j.issn.1005-6521.2016.11.038
作者简介:邓晓鸿(1986—),男(汉),工程师,硕士研究生,研究方向:食品微生物。
收稿日期:2015-05-14
Uncertainty Evaluation for Palte Counts of Pathogenic Bacteria Colonies in Foods
DENG Xiao-hong,QIANG Min,ZHU Xin-sheng,WANG Wei-gang
(Zhenjiang Center for Products Quality Supervision&Inspection,Zhenjiang 212132,Jiangsu,China)
Abstract:To understand the microbial indicators of frozen rice products in the region and probe the uncertainty assessment methods for testing the results of Staphylococcus aureus.the products were sampled and test accord
ing to GB 4789.1-2010,GB 4789.4-2010,GB 4789.10-2010 and GB 19295-2011 and evaluated uncertainty of the samples based on JJF1059.1-2012,poisson scatter and related statistical methods to evaluate uncertainty of the samples.142 quick-frozen product of wheat flour and rice,including 88 samples of Frozen without cook
ing and 54 samples of Cooked before frozen,both qualified rate of them was 100%.According to the methods used,it was concluded that the average results of two samples was 290 CFU/g and 20 CFU/g.Also the relative standard uncertainty of test results of was 30 CFU/g and 4 CFU/g respectively.Evaluation method used in this paper could estimate the uncertainty of test results of Staphylococcus aureus coming form quick-frozen products of wheat flour and rice,which was suitable to evaluate the safety of them.
Key words:quick-frozen product of wheat flour and rice;Staphylococcus aureus;Uncertainty evaluation
