毕赤酵母表达蒜酶及其体外抗氧化功能研究
2016-07-27韩杨孙同韦刘会杰郭伟王洪彬刘逸寒路福平天津科技大学生物工程学院天津300457
韩杨,孙同韦,刘会杰,郭伟,王洪彬,刘逸寒,路福平(天津科技大学生物工程学院,天津300457)
毕赤酵母表达蒜酶及其体外抗氧化功能研究
韩杨,孙同韦,刘会杰,郭伟,王洪彬,刘逸寒,路福平*
(天津科技大学生物工程学院,天津300457)
摘要:从大蒜鳞茎中克隆蒜酶基因,构建蒜酶真核表达载体,并在毕赤酵母系统中诱导表达,探讨重组蒜酶的活性及其催化蒜氨酸分解产生蒜素的抗氧化活性。利用RT-PCR方法克隆大蒜鳞茎蒜酶基因,通过pPIC9K载体构建pPIC9K-alliinase真核表达质粒,电转化法导入毕赤酵母GS115,筛选阳性克隆,经甲醇诱导后取发酵上清液进行SDSPAGE分析。利用丙酮酸法检测重组蒜酶的活性。并采用DPPH·法,分别研究有氧及无氧条件下蒜酶催化蒜氨酸分解产生蒜素的抗氧化活性。从大蒜中克隆出蒜酶基因,重组酶存在于毕赤酵母表达上清液中,形成糖蛋白,酶的比活力为(115.81±1.93)U/mg;无氧条件下蒜酶催化蒜氨酸分解产生蒜素的抗氧化能力高于有氧条件。克隆了蒜酶编码基因,并成功实现在毕赤酵母中的有效表达。无氧条件下蒜酶催化蒜氨酸分解产生蒜素抗氧化能力比有氧条件下高,为体内利用蒜酶和蒜氨酸制备高抗氧化能力的制剂提供基础。
关键词:蒜酶;毕赤酵母;蒜氨酸;抗氧化
在现代医学领域中,人们对抗氧化剂的研究越来越多。众所周知,适当补充外源抗氧化剂,或给予能够促使机体内源性抗氧化物恢复到一定水平的药物,可改善衰老以及疾病的情况[1]。
大蒜(Allium sativum L.)又名胡蒜、独蒜等,单子叶植物百合科葱属植物,为香辛类蔬菜。大蒜能够增强人体免疫力,同时具有抗氧化、抗肿瘤、降胆固醇、预防心血管疾病、降血压等功效,这些药用价值都是由大蒜的独特成分蒜素(allicin)决定的。在完整的大蒜细胞内,产生蒜素的底物蒜氨酸和蒜氨酸酶(简称蒜酶)是分隔存在的,蒜氨酸存在于细胞质中,蒜酶存在于液泡中。细胞受伤时,蒜酶和蒜氨酸相遇,发生反应,产生丙酮酸、氨以及包括蒜素在内的含硫化合物[2-3]。蒜素相当不稳定,遇到光、热或有机溶剂易转化为其他硫化物,称为大蒜油,研究表明,蒜素比大蒜油具有更好的抗氧化等生物活性[4]。
目前,国内外研究思路是从鲜蒜中提取化学性质相对稳定的蒜氨酸及蒜酶,然后科学组方,制成蒜氨酸/蒜酶复合制剂,让其在受体内释放蒜素充分发挥疗效[5-10]。该研究思路减少了蒜素在外界环境中的滞留时间,对于发挥蒜素的抗氧化等药理作用很有意义,但是溶液提取获得的蒜酶量较低,且由于蒜酶不稳定,在提取过程中,活性容易丧失导致蒜素生成能力降低[11]。
随着大蒜生产和应用领域的不断扩大,大蒜的抗氧化作用逐渐被人们了解和重视。本研究拟用分子生物学方法克隆蒜酶基因,在毕赤酵母系统表达重组蒜酶蛋白,对重组蒜酶进行活性分析,并采用DPPH·法研究重组蒜酶催化蒜氨酸形成的蒜素在有氧和无氧两种条件下的抗氧化能力,以期为进一步开发高效能的蒜氨酸/蒜酶复合制剂在功能性食品领域的应用提供参考。
1 材料与方法
1.1材料
新鲜大蒜鳞茎:购买于天津当地市场;毕赤酵母Pichia pastoris(Guillierm.)GS115、大肠杆菌DH5α、pET22b(+)载体、pPIC9K载体:天津科技大学生物工程学院实验室;二苯代苦味酰基自由基(1,1-pheny-2-picrylhydrazyl,DPPH·)、Trizol试剂、PCR纯化试剂盒、凝胶回收试剂盒、质粒小量提取试剂盒、Reverse Transcriptase XL反转录酶、限制性内切酶、蒜氨酸:Takara公司;Bradford蛋白浓度测定试剂盒:碧云天生物技术有限公司。
1.2方法
1.2.1大蒜鳞茎总RNA的提取及pET22b-alliinase重组质粒的构建及鉴定
取新鲜大蒜鳞茎于液氮中研碎,按照Trizol试剂说明书进行总RNA的提取并进行RT-PCR。以合成的cDNA第一链为模板,根据Genbank序列号S73324.1登录的蒜酶序列,在其ORF框上下游设计一对引物。上游引物:5'-CGCGGATCCGATGATCTGCCTAGTGATTTTG-3',含BamHI酶切位点;下游引物:5'-CCCAAGCTTAATGAAAGGACGACGG-3',含HindIII酶切位点,扩增蒜酶序列。PCR参数为95℃、5 min,94℃、40 s,55℃、45 s,72℃、1 min 30 s,30个循环,72℃延伸10 min。1%琼脂糖电泳检测PCR产物,PCR产物纯化后克隆到pET22b(+)载体。并转化至大肠杆菌DH5α,挑取阳性克隆于37℃过夜震荡培养,按照质粒提取试剂盒说明书提取重组质粒,由北京奥科鼎盛生物科技有限公司进行DNA测序。
1.2.2pPIC9K-alliinase重组质粒的构建
重新设计上下游引物。上游引物:5'-CGGGAATTCATGATCTGCCTAGTGATTTTG-3',含EcoRI酶切位点;下游引物:5'-AAGGAAAAAAGCGGCCGCTTAAATGAAAGGACGACGG-3'。含NotI酶切位点。以pET22b-alliinase为模板进行PCR,PCR产物和pPIC9K载体分别经EcoRI和NotI双酶切进行连接构建,重组质粒pPIC9K-alliinase经双酶切鉴定,由北京奥科鼎盛生物科技有限公司进行DNA测序。
1.2.3重组蒜酶在毕赤酵母中的表达及其SDS-PAGE分析
接种毕赤酵母GS115于5 mL YPD培养基中30℃培养过夜。取0.5 mL培养物接种于150 mL新鲜YPD培养基中,摇至吸光度OD600值为1.3~1.5。4℃,1 500 r/min,离心5 min,收集菌体细胞,用100 mL冰预冷的无菌水重悬细胞,同上离心。用50 mL 1 mol/L山梨醇溶液重悬细胞,同上离心,洗涤两次,再用1 mL 1 mol/L山梨醇重悬细胞至终体积为1.5 mL,制得毕赤酵母GS115感受态细胞。混合80 μL感受态细胞与5 μg~20 μg经SacI线性化的pPIC9K-alliinase质粒,转移至冰预冷的0.2 cm电转杯中,冰上放置5 min,电压1 500 V,电击6 ms~9 ms,立即加入1 mL冰预冷的1 mol/L山梨醇溶液,取200 μL~600 μL溶液涂布于MD平板,30℃培养72 h。从MD平板上挑取单克隆分别接种于5 mL YPD培养基中,于30℃200 r/min条件下培养过夜,提取基因组,以alliinase上下游引物进行PCR鉴定重组的阳性克隆。取含有alliinase基因的重组菌接种于100 mL BMMY培养基中,30℃,250 r/min~300 r/min,培养至OD600值为2.0~3.0。1 500 r/min,室温离心5 min,收集细胞。将细胞重悬于30 mL BMMY培养基中,继续振摇培养。加100%甲醇使终体积分数为0.5%,每隔24 h取样。样品1 500 r/min室温离心5 min。收集上清液为粗酶液,进行SDS-PAGE电泳分析及酶活测定。以pPIC9K空载体表达菌发酵上清为空白对照。
1.2.4蒜酶酶活分析
参考苟萍[11]的方法,绘制丙酮酸标准曲线,如图1所示,求得回归方程为Y=0.024 4X+0.016 7,相关系数为R2=0.999 0。酶活测定方法:1.0 mL酶液加2.0 mL 3 mmol/L蒜氨酸底物在35℃下反应5 min,加3 mL 10%三氯乙酸终止反应,吸取2.0 mL反应物与0.5 mL 2,4-二硝基苯肼充分反应后,加入5 mL 1 mol/L NaOH摇匀显色,于520 nm测定吸光值。酶活定义为在35℃条件下,产生1 μg/min丙酮酸为1个活力单位(U)。
1.2.5自由基清除能力的测定
参照Brand-Williams W.[12]的方法。以下操作分别在有氧条件和无氧条件下进行:用超纯水混合蒜氨酸及重组蒜酶粗酶液,制成蒜氨酸/蒜酶混合物溶液(蒜氨酸终浓度为10 mmol/L,蒜酶粗酶液总蛋白含量为0.275 mg/mL),于37℃水浴中酶催化反应不同时间,取1 mL样品及4 mL浓度为0.12 mmol/L的DPPH乙醇溶液,混匀,室温下避光反应30 min,如有沉淀在5 000 r/min条件下离心5 min。用95%(体积分数)乙醇溶液作参比,于517 nm测定吸光值。根据下式计算样品液对DPPH·的清除率:
清除率/%=[1-(Ai-Aj)/Ac]×100
式中:Ai为加样品液后DPPH溶液的吸光值;Aj为样品液的吸光值;Ac为未加样品液时DPPH溶液的吸光值。
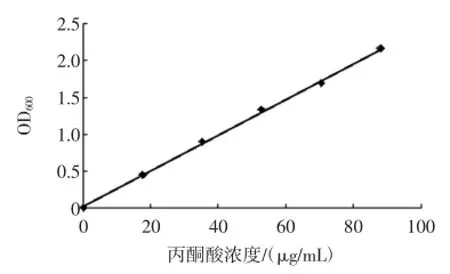
图1 丙酮酸标准曲线Fig.1 Standard curve of pyruvic acid
2 结果
2.1蒜酶基因RT-PCR扩增结果及pET22b-alliinase重组质粒酶切鉴定结果
根据GenBank登录序列,RT-PCR蒜酶产物大小预期为1 422 bp(碱基对),如图2A所示,约在1 500 bp以下可见一条明显的特异性条带,与预期大小基本一致。将蒜酶基因连接到载体pET22b上,转入E.coli DH5α中,提取重组质粒pET22b-alliinase,经BamHI及HindIII双酶切后,出现5 000 bp以上载体条带及1 500 bp左右的特异性目的条带,与预期大小基本一致,如图2B所示。
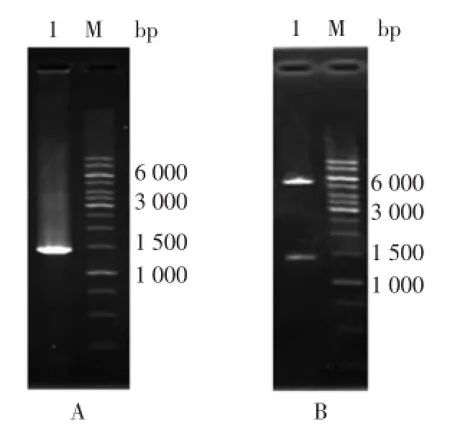
1:重组质粒双酶切产物;M:1kb DNA Ladder Marker。
2.2pPIC9K-alliinase重组质粒的鉴定
pPIC9K-alliinase重组质粒经EcoRI和NotI双酶切在1 500 bp以下出现一条明亮特异性条带,如图3所示,大小与预期基本相符,经测序鉴定后氨基酸序列与原始序列相似性为100%。重组质粒pPIC9K-alliinase构建成功。
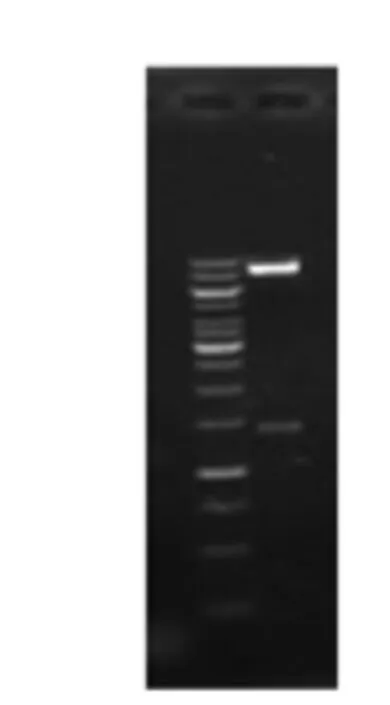
图3 pPIC9K-alliinase重组质粒EcoRI,NotI双酶切鉴定电泳图Fig.3 The agarose gel electrophoresis identification of recombinant plasmid pPIC9K-alliinase digested with EcoRI and NotI
2.3蒜酶在毕赤酵母中的表达及活性测定
取蒜酶毕赤酵母诱导表达72 h上清进行SDSPAGE分析,在7 200 u与12 654 u之间见到一条蛋白条带,如图4所示。

图4 Alliinase重组蛋白SDS-PAGE电泳图Fig.4 SDS-PAGE analysis of solubility of recombinant alliinase
而对照组(pPIC9K空载体重组菌)在相应位置未见明显条带。将不同时间诱导表达的重组蒜酶粗酶液进行活性检测,重组酶得到了有效表达,在诱导表达72 h后,酶的比活力达到(115.81±1.93)U/mg,如图5所示。
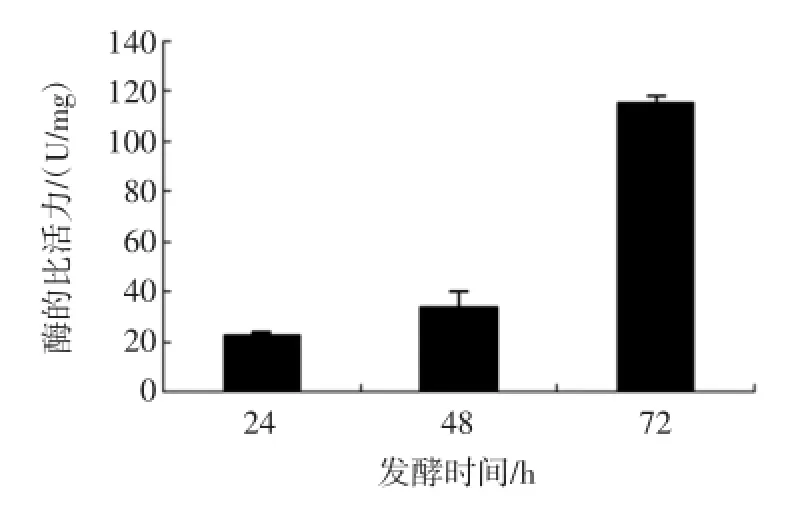
图5 不同诱导时间重组蒜酶的活性检测Fig.5 AIliinase activity in different induced time
2.4体外抗氧化活性分析
蒜酶催化蒜氨酸反应生成的蒜素,具有较高的抗氧化活性,但是蒜素容易被氧化失活。本研究分别在有氧和无氧条件下,考察了蒜氨酸/蒜酶反应物的抗氧化活性。结果如图6所示。

图6 有氧和无氧环境下蒜氨酸/蒜酶反应物对DPPH·的清除率Fig.6 The DPPH·scavenging rate of alliin/alliinase in different environments
由图6可以看出,蒜氨酸/蒜酶反应物在有氧条件下的DPPH·清除能力明显不如无氧条件下的清除能力,且随着时间的延长两种条件下自由基清除率都呈下降趋势。有氧条件下,反应物放置1 h后DPPH·清除能力为25.2%,5 h后下降到10.5%,下降幅度达到了58.3%。无氧条件下,反应物放置1 h后DPPH·清除能力为30.3%,5 h后下降到22.7%,下降幅度为24.8%,下降速度明显小于有氧条件下的速度。
3 讨论
根据Genbank登录的蒜酶序列(目的蛋白相对分子质量约为5 688 u)设计引物,通过RT-PCR技术合成蒜酶基因,在毕赤酵母表达系统中获得表达。SDSPAGE检测发现,表达产物分子量较理论相对分子质量5 688 u的蒜酶大,而接近8 727 u(蛋白条带在7 200 u~12 654 u之间)的表达产物。经蛋白糖基化位点预测软件NetNGlyc 1.0 Server分析发现,分泌到胞外的重组蒜酶蛋白序列中存在4个明显的N-糖基化位点。分析可能原因是蒜酶在毕赤酵母表达过程中发生了糖基化,因此经SDS-PAGE检测重组蛋白的分子量高于理论分子量。
本研究中重组酵母菌表达的蒜酶,发酵液上清酶的比活力为(115.81±1.93)U/mg,高于吴晓丽等报道的重组蒜酶比活力(82.09±3.89)U/mg,但低于天然蒜酶比活力(176.49±5.06)U/mg[13]。分析原因可能是,毕赤酵母GS115非蛋白酶缺陷型宿主菌,重组蛋白受酵母自身蛋白酶降解影响导致重组蛋白表达量较低;序列中的4个糖基化位点的糖基化都可能导致生物活性的降低。因此今后的研究工作主要是提高重组蛋白的生物活性和表达量。
通过测定DPPH·清除能力比较了有氧和无氧条件下蒜氨酸/蒜酶反应物的抗氧化性能。结果表明,氧气的存在和作用对蒜氨酸/蒜酶反应物的抗氧化能力有很大影响,导致其随着时间的延长抗氧化能力不断下降。但是,无氧条件下蒜氨酸/蒜酶反应物的抗氧化能力随着时间的延长也呈现下降趋势,该下降与氧气无关,我们推测是因为蒜酶能够在催化生成蒜素之后,能够继续对蒜素进行作用生成其他物质,进而导致抗氧化能力呈现一定的下降趋势。鉴于开放环境下氧的存在不利于蒜素抗氧化能力的保持,可以猜想,若能分别制备蒜氨酸和蒜酶的包被制剂,使之服用后在人体内释放并相互反应生成蒜素,则能更充分地发挥蒜素的疗效和保健功能。本研究对抗氧化能力受氧影响的试验结果,为将来科学组方蒜氨酸/蒜酶复合制剂提供了理论参考。
4 结论
本文实现了蒜酶在毕赤酵母中的表达。酶的比活力达到(115.81±1.93)U/mg。体外抗氧化研究结果表明,无氧条件下蒜酶催化蒜氨酸形成的蒜素的抗氧化能力比有氧条件下高,为体内利用蒜酶和蒜氨酸制备高抗氧化能力的制剂提供理论参考。
参考文献:
[1]段耀华,陈浩,郑巍.大蒜抗氧化活性的初步研究[J].护理研究,2005,19(2):226-228
[2]Lancaster J E,H A Collin.Presence of alliinase in isolated vacuoles and of alkyl cysteine sulphorides in the cytoplasm of bulbs of onion [J].Plant Sci Lett,1981,22(22):169-176
[3] Whitetaker J R.Development of flavour,odor and plungency in onion and garlic[J].Adv Food Res,1976,22:73-74
[4]Arnault I,J P Christides,N Mandon,et al.High-performance ionpair chromatography method for simultaneous analysis of alliin,deoxyalliin,allicin and dipeptide precursors in garlic products using multiplemassspectrometryandUVdetection[J].JChromatogrA,2003,991(1):69-75
[5]Williams D M,C M Pant.Process for the production of allicin:US,0247711A1[P].2004-12-09
[6]Krueger S K,Williams D E.Mirelman D,et al.Garlic alliinase covalently bound to carrier for continuous production of allicin:US,6689588[P].2004-02-10
[7]Rabinkov A,T Miron,D Mirelman,et al.In situ generation of allicin for the treatment of cancers and infectious diseases:US,02058624 [P].2002-01-08
[8]Rabinkov A,T Miron,D Mirelman,et al.Site-specific in situ generation of allicinusing a targeted allinase delivery system for the treatment of cancers,tumors,infectious diseases and other allicinsensetive diseases:US,0115183A1[P].2004-06-17
[9]Miron T,M Mironchik,D Mirelman,et al.Inhibition of tumor growth by a novel approach:In situ allicin generation using targeted alliinase delivery[J].Mol Cancer Ther,2003,2(12):1295-1301
[10]Miron T,H S Raman,A Rabinkov,et al.A method for continuous production of allicin using immobilized alliinase[J].Anal Biochem,2006,358(1):152-154
[11]苟萍.蒜氨酸酶的研究[J].生物学通报,2004,39(8):9-10
[12]Brand-walliams W,M E Cuvelier and C Barset.Use of a free radical method to evaluate antioxidant activity[J].Lebensmittel-Wissenschaft and Technologie,1995,28(1):25-30
[13]吴晓莉,张婷,边金铎,等.大蒜鳞茎蒜氨酸酶基因克隆及其在毕赤酵母中的表达[J].中草药,2012,43(1):143-147
DOI:10.3969/j.issn.1005-6521.2016.11.040
作者简介:韩杨(1983—),女(回),博士研究生,研究方向:应用微生物与酶工程。
*通信作者:路福平(1967—),男(汉),教授,研究方向:应用微生物与酶工程。
收稿日期:2015-05-28
Expression of Alliinase Gene in Pichia pastoris and Its Antioxidant Activity in Vitro
HAN Yang,SUN Tong-wei,LIU Hui-jie,GUO Wei,WANG Hong-bin,LIU Yi-han,LU Fu-ping*
(The College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
Abstract:To clone the alliinase gene from the garlic bulb and construct the eukaryote expression plasmid for expressing the recombinant alliinase in Pichia pastoris system and analyzing its bioactivity and antioxidant activity of alliin/alliinase mixture.The alliinase gene was cloned from the garlic bulb by RT-PCR and the eukary-ote expression plasmid of alliinase was constructed with the pPIC9k vector.The recombinant plasmid was transformed into Pichia pastoris GS115 by eletroporation.The positive clones were screened and were induced by methanol.Supernatants after induction were analyzed by SDS-PAGE.The activity of the recombinant protein was detected by the pyruvic acid method.Antioxidant activities of the alliin/alliinase mixture in vitro were analyzed by DPPH·in aerobic and anaerobic conditions respectively.The alliinase gene was successfully cloned from the garlic bulb,the recombinant alliinase existed in the supernatant of Pichia pastoris in the forming of glycoprotein.The specific activity of the recombinant protein was(115.81±1.93)U/mg.The total antioxidant capacity of alliin/alliinase mixture in anaerobic condition was higher than in aerobic condition.The alliinase gene is successfully expressed in Pichia pastoris system.alliin/alliinase mixture showed very good oxidation resistance is a very prospect for development with the material.
Key words:alliinase;pichia pastoris;alliin;antioxidation
