金纳米棒免疫传感器检测不同感染周期日本血吸虫循环抗原的研究
2016-07-27汪世平周云飞黄成铭闾丘思嘉宁水兵
何 鑫,汪世平,周云飞,黄成铭,闾丘思嘉,宁水兵
金纳米棒免疫传感器检测不同感染周期日本血吸虫循环抗原的研究
何鑫,汪世平,周云飞,黄成铭,闾丘思嘉,宁水兵
中南大学基础医学院寄生虫学系,长沙410078
摘要:目的利用金硫共价键成功构建固相金纳米棒免疫传感器,检测不同感染周期的日本血吸虫循环抗原,并分析宿主体内抗体的消长变化。方法晶种生长法制备金纳米棒溶液,与表面带有巯基基团的ITO玻片以金硫共价键组装成固相金纳米棒免疫传感器。聚4-苯乙烯磺酸钠(PSS)和聚丙烯胺盐酸盐(PAH)修饰固相金纳米棒免疫传感器表面,并结合日本血吸虫未成熟卵可溶性抗原26-28 kDa单链抗体(SIEA26-28kDaSjscFv),检测日本血吸虫不同感染周期兔血清循环抗原。结果固相金纳米棒免疫传感器分别与1~8周的感染血清反应,并设立阴性血清对照组;结果显示,表面等离子共振吸收峰峰值分别呈现出17 nm,52 nm,28 nm,11 nm,13 nm,23 nm,45 nm,43 nm的位移,阴性对照组未出现位移;同时,根据传感器表面等离子共振波峰对不同感染周期血清反应后的位移变化推断抗体在宿主体内呈现出先上升,后下降,再上升的变化规律。结论通过对固相金纳米棒免疫传感器的研究,证明其能够通过表面等离子共振波峰的移动来检测日本血吸虫感染血清循环抗原;同时,对抗原抗体在宿主内的变化提供了数据支撑。固相金纳米棒免疫传感器的高特异性、灵敏度为日本血吸虫病的诊断及抗原抗体的研究提供了新的手段。
关键词:日本血吸虫;循环抗原;金纳米棒;传感器
Supported by the National Natural Science Foundation of China (No. 81271862),the Key Project of Hunan Province Innovation Platform and Talent Project (Application Basic Research)(No.2015JC3022),and the Fundamental Research Funds for the Central Universities(No.2012zzts028)
血吸虫病(Schistosomiasis)是一种严重危害健康的人兽共患寄生虫病[1]。据世界卫生组织报道[2],全球仍然有很多地区受到血吸虫病感染的威胁,特别是在一些公共卫生条件较差、医学技术较为落后的国家和地区尤为严重。近年来,我国公共环境卫生得到了改善,血吸虫病的疫情也逐渐得到控制,流行区人畜感染率、感染度均逐年降低。目前常规病原学和免疫学诊断方法,其灵敏度已经难以满足新流行趋势传染源监测的需要[3],粪检法虽是诊断血吸虫病的“金标准”,但漏检率高,其敏感性在轻度流行区已大受质疑[4]。如何在血吸虫病轻度流行区(人畜感染率<1%),针对低感染度人群进行传染源监测,是开展高灵敏血吸虫循环抗原检测方法研究原创的动力,也是目前血吸虫病防治工作深入的实际需求。
目前,国内外学者研究证明,血吸虫循环抗原(CAg,circulating antigen)可作为血吸虫病现症感染的重要标志,亦可作为病人治疗效果的考核指标[5]。但其在血液和体液中的含量极低,导致常规的免疫学方法很难检测出来。开发高灵敏的检测方法是当下血吸虫病流行趋势。
生物传感器是一种能够将生物物质之间的微弱信号转化成光电信号的检测系统,常规生物传感器由固定化的生物敏感材料(如酶、抗体、抗原等生物活性物质)与适当的理化换能器(如电极等)及信号放大装置构成[6]。生物纳米传感器是基于生物传感器平台,采用纳米材料的光电特征制备出高效、稳定的传感器。众多纳米材料中,金纳米棒[7](GNRs,gold nanorods)因其具有尺寸小、比表面积大,形貌可控,对周围介质环境变化较为敏感等特点,加之其合成方法简单、产率较高、可稳定保存,且具有特殊的光学性质,备受研究者亲睐[8]。金纳米棒的局部表面等离子共振(LSPR,Localized surface plasmon resonance)现象是自由电子在金纳米棒长轴与纵轴的集体震荡形成表面等离子效应,该现象不仅能够反应金纳米棒长径比变化,而且也是影响消光峰变化的主要因素。金纳米棒传感器正是利用其局部表面等离子共振特征检测抗原抗体的反应信号。目前,液相传感器的应用已经十分的普遍[9-11],但其在纯化过程中因反复分散而改变了自身的浓度,从而影响检测结果;固相金纳米棒免疫传感器利用固相载体将金纳米棒组装于其表面,再与抗原抗体结合进行检测。本文通过构建固相金纳米棒免疫传感器,并组装日本血吸虫未成熟卵可溶性抗原26-28kDa单链抗体(SIEA26-28kDaSjscFv)于固相金纳米棒免疫传感器表面,对不同感染周期的日本血吸虫兔血清进行检测。
1材料与方法
1.1材料氯金酸(HAuCl4·4H2O,99%),CTAB (cetyltrimethylammonium bromide,分子量:364.45),丙烯酰胺均购自美国阿拉丁公司;硼氢化钠(NaBH4)购自天津化学试剂研究所有限公司;硝酸银(AgNO3,分子量:169.87)购自化学试剂国药控股有限公司;抗坏血酸(Ascorbic Acid),TEMED,十二烷基硫酸钠购自Sigma公司;聚4-苯乙烯磺酸钠,分子量:70 000 PSS(C8H9NaO3S)n;聚丙烯胺盐酸盐,分子量:15 000 PAH(C3H8ClN)n;3-(巯基丙基)三甲氧基硅烷,分子量:196.34 MPTES(C6H16O3SSi)均购自Sigma-Aldrich上海分公司;ITO玻片(型号:7 mm×50 mm×1 mm)购自深圳华南湘城科技有限公司;SDS-PAGE凝胶配制试剂盒购自北京鼎国昌盛生物技术有限责任公司。
1.2方法
1.2.1金纳米棒制备及修饰
1.2.1.1金纳米棒的制备[12]往EP管中依次加入7.5 mL 0.1 mol/L 的表面活性剂(CTAB)溶液、0.25 mL 0.01 mol/L 氯金酸溶液,磁力搅拌30 s;随后逐滴加入0.6 mL 0.1 mol/L硼氢化钠溶液,磁力搅拌器搅拌3 min,至颜色呈现浅棕色,25 ℃,放置2 h后使用。然后依次加入4.75 mL 0.1 mol/L 的表面活性剂(CTAB)溶液,0.2 mL 0.01 mol/L氯金酸溶液,0.030 mL 0.01 mol/L硝酸银溶液,0.032 mL 0.1 mol/L抗坏血酸溶液于新的EP管中,翻转混匀,待溶液完全透明后加入0.01 mL种子液,25 ℃,静置24 h后使用。
1.2.1.2金纳米棒的修饰将制备好的金纳米棒溶液分装成2 mL/管,8 500 r/min,30 min,弃上清;加入1 mL双蒸水(18.2 MΩ·cm),充分混匀后,14 000 r/min,10 min,弃上清;加入1 mL,0.5 mmol/L表面活性剂(CTAB),充分混匀后,14 000 r/min,10 min,弃上清;加入1 mL,5 mmol/L氯化钠溶液,25 ℃下保持备用。
1.2.2固相金纳米棒传感器的组装
1.2.2.1ITO玻片清洗及修饰选取特制的ITO玻片若干,并配置Piranha 洗液对玻片表面清洗和修饰;先向玻璃烧杯中倒入30 mL 98%的硫酸,在玻璃棒引流下往烧杯中加入10 mL 30%的双氧水,边加边搅拌,加入完成后待其冷却至常温使用;加热Piranha洗液至沸腾,将ITO玻片放入洗液中,25 min后完成清洗步骤,待其冷却后取出;新配置Piranha洗液,水浴加热至70 ℃,放入清洗后的ITO玻片,40 min后完成羟基化修饰步骤,待其冷却后取出;随后配置3-(巯基丙基)三甲氧基硅烷溶液(MPTMS),取10 mL 95%的无水乙醇,再加入1 mL的3-(巯基丙基)三甲氧基硅烷溶液,充分混匀后4 ℃放置,2 h后使用;再将羟基化后的ITO玻片放入预冷的MPTMS溶液中,4 ℃,7 h后完成巯基化修饰;至此,ITO玻片的清洗及修饰完成。
1.2.2.2固相金纳米棒免疫传感器的组装取纯化后的金纳米棒溶液(分装 1 mL/管),将修饰后的ITO玻片浸入到金纳米棒溶液中,25 ℃水浴,放置7 h后,取出,洗净,干燥,紫外分光光度计检测。
1.2.3固相金纳米棒传感器表面修饰取出固相金纳米棒传感器(ITO),双蒸水反复清洗3次,自然干燥后,先浸入到2 mg/mL的聚4-苯乙烯磺酸钠(PSS)溶液中30 min,取出,清洗3次,自然干燥;再浸入到2 mg/mL聚丙烯胺盐酸盐(PAH)溶液中30 min,取出,清洗3次,干燥后备用。
1.2.4SIEA26-28kDaSjscFv的制备将重组质粒pET43.1a/SjscFv的E.coliBL21(DE3)从-80 ℃冰箱取出,复苏后划板,挑选单克隆接种至10 mL LB液体培养基(Amp+,100 μg/mL)中,37 ℃摇床振荡培养,待其OD600为0.4~0.6之间时停止培养。据本科室报道,PET43.1a/SIEA26-28 kDa-SjscFv质粒的E.coliBL21(DE3)的最佳表达温度为28 ℃、IPTG最佳诱导时间为16 h,其IPTG最佳诱导浓度为0.05 mmol/L。在此条件下,我们进行蛋白的大量诱导表达。随后进行离心,4 ℃ 8 000 r/min,10 min后获得菌体沉淀,弃除上清液,用PBS洗涤沉淀;然后继续离心,弃上清。再将沉淀置于-80 ℃冰冻30 min,37 ℃水浴3 min,反复冻融3~5次,根据菌体量加入适量PBS,在冰浴条件下进行超声破碎,1 mL PBS重悬液设定工作4 s,间隔6 s,15次,功率180 W。设定4 ℃,12 000 r/min高速离心15 min,弃上清,沉淀,-20 ℃保存备用。
1.2.5SIEA26-28kDaSjscFv与金纳米棒传感器的结合及条件优化从-20 ℃冰箱中取出1 mL SIEA26-28kDaSjscFv,待完全溶解后室温放置备用。取干燥的ITO-金纳米棒玻片,将其浸入到SIEA26-28kDaSjscFv溶液中,常温下,分别反应30 min,2 h,4 h,6 h后,利用紫外分光光度计检测不同时间段的吸光值,记录结果。
1.2.6检测不同感染周期阳性兔血清循环抗原取1.5~2 kg的家兔,并将其仰面固定于兔台上,剃除腹部体毛,以去氯水湿润皮肤,将粘有尾蚴的盖玻片(500±10尾/只)覆于其上,保留15 min,完成感染。分别取感染1~8周的阳性兔血清各2 mL,将带有SIEA26-28kDaSjscFv单链抗体的固相金纳米棒免疫传感器分别浸入到不同感染周期的血清中,4 ℃ 2 h,随后将固相金纳米棒传感器取出,反复冲洗3次,自然干燥后,进行紫外分光光度检测。
2结果
2.1金纳米棒溶液表面等离子共振图谱和扫描电镜图本文采用晶种子生长法成功制备出了横波峰为550 nm,纵波峰为785 nm的金纳米棒溶液,见图1,扫描电镜结果显示其长径比为3.2,见图2。

图1 金纳米棒溶液紫外分光光度计图谱 Fig.1 UV-Vis absorption spectrum of chemically synthesized gold nanorods showing a transverse surface plasmon resonance at 550 nm and longitudinal resonance at 785 nm

图2 金纳米棒溶液扫描电镜图Fig.2 SEM image of monodispersed GNRs in solution
2.2固相金纳米棒传感器的表面等离子共振图谱
金纳米棒通过金硫共价键组装到ITO玻片表面,进行紫外分光光度计检测,结果显示其在689 nm处有吸收峰值,见图3。
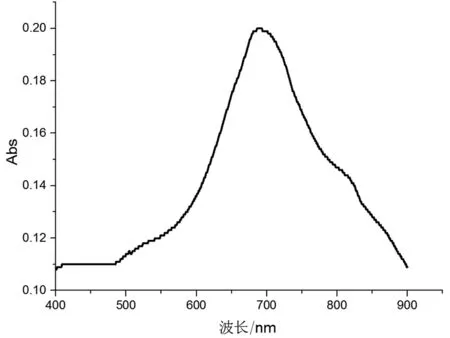
图3 固相(ITO)金纳米棒表面等离子共振光谱Fig.3 UV-Vis absorption spectrum of surface of solid phase (ITO) gold nanorod
2.3ITO-金纳米棒传感器与单链抗体组装时间优化结果通过观察常温下不同时间点单链抗体ScFv与ITO-金纳米棒表面结合后,其表面等离子共振图谱的变化进行分析,见图4。结果发现:在未结合ScFv时,其吸收峰在713 nm(黑色曲线);30 min后,其曲线红移至727 nm(红色曲线);2 h后该曲线红移至753 nm(蓝色曲线);4 h后该曲线未出现移动(梅红色曲线);6 h后该曲线仍然未有移动出现(绿色曲线)。
2.4固相金纳米棒免疫传感器检测日本血吸虫不同感染周期的阳性兔血清采用固相金纳米棒免疫传感器对不同感染周期的阳性兔血清进行检测(如图5)。结果显示,不同感染周期的阳性血清与固相金纳米棒免疫传感器结合后,其吸收峰纵波峰呈现出不同程度的位移,如17 nm(感染1周),52 nm(感染2周),28 nm(感染3周),11 nm(感染4周),13 nm(感染5周),23 nm(感染6周),45 nm(感染7周),43 nm(感染8周,见图5A-H),而横波峰结合前后没有任何移动;阴性血清与固相金纳米棒免疫传感器结合后并未发生任何移动,见图5I。

图4 ITO-金纳米棒与单链抗体ScFv不同结合时间段的吸收峰峰值变化Fig.4 Changed of UV-Vis absorption spectrum of ITO-gold nanorods after assembly with ScFv


(A)感染1周的阳性血清(位移:17 nm);(B)感染2周的阳性血清(位移:52 nm);(C)感染3周的阳性血清(位移:28 nm);(D)感染4周的阳性血清(位移:9 nm);(E)感染5周的阳性血清(位移:13 nm);(F)感染6周的阳性血清(位移:23 nm);(G)感染7周的阳性血清(位移:45 nm);(H)感染8周的阳性血清(位移:43 nm);(I)阴性对照组(没有任何移动)。(A) Infection serum for 1 week (shift: 17 nm); (B) Infection serum for 2 week (shift: 52 nm); (C) Infection serum for 3 week (shift: 28 nm); (D) Infection serum for 4 week (shift: 9 nm); (E) Infection serum for 5 week (shift: 13 nm); (F) Infection serum for 6 week (shift: 23 nm); (G) Infection serum for 7 week (shift: 17 nm); (H) Infection serum for 8 week (shift: 43 nm);(I)Control group (shift: 0 nm)图5 金纳米棒传免疫感器检测不同感染周期的日本血吸虫感染血清Fig.5 UV-Vis absorption spectrum change before and after reacting with serum from different infection periods by gold nanorod sensor
3讨论
本文将日本血吸虫未成熟卵可溶性抗原单链抗体(SIEA26-28kDaSjscFv)成功的组装到ITO-固相金纳米棒免疫传感器表面。ITO-金纳米棒固相免疫传感器分别与日本血吸虫阴性和阳性兔血清结合,通过观察结合前后传感器表面等离子共振吸收峰峰值的变化,来分析日本血吸虫循环抗原在宿主体内的变化规律。
构建成功的ITO-固相金纳米棒免疫传感器检测日本血吸虫不同感染周期的兔阳性血清。结果显示,随着时间的推移,ITO-固相金纳米棒传感器表面等离子共振吸收峰位移呈现出先增加再减小,然后再增加的规律。众所周知,循环抗原可作为血吸虫病现症感染的重要标志,亦可作为活虫寄生的标志物以及病人治疗效果的考核指标。但是血吸虫循环抗原在宿主体内受到宿主的生理功能和免疫作用后,其质和量都在发生变化。Nash等[13-14]认为宿主清除血吸虫循环抗原方式有两种:①抗原与相应抗体结合成免疫复合物,由抗体的Fc段与Fc受体的各种细胞(如巨噬细胞等)结合,通过吞噬作用而消除抗原;②具有半乳糖受体的肝细胞及具有甘露糖和N-乙酰葡萄糖胺受体的巨噬细胞与具有相应成分的抗原结合,可使抗原降解为低分子抗原最终经尿排出体外。本试验结果显示,ITO-金纳米棒免疫传感器与感染1周兔阳性血清反应后,其吸光值位移为17 nm,而2周后,其吸光值的位移为52 nm,较其他感染周期的吸光值位移都要大,这可能是由于血吸虫感染早期释放的大量循环抗原还未被宿主体内的免疫系统所清除,而与ITO金纳米棒免疫传感器表面的SIEA26-28kDaSjscFv结合,使得其吸光值变化较大;随着宿主免疫系统识别并消除体内循环抗原的增加,导致感染3周和4周的阳性血清呈现吸光值递减的现象,而感染5周,6周,7周,8周的阳性血清的吸光值骤增,可能是因为该时间段即产卵高峰期伴有大量的血吸虫循环抗原产生,导致出现吸光值骤增。该检测结果与刘世国[15]等应用Dot-ELISA进行日本血吸虫循环抗原检测滴度与感染度关系的动态观察结果一致,但ITO金纳米棒免疫传感器检测优于前者,能够检测到早期感染(14 d)时所释放于宿主体内的循环抗原。
本文成功构建固相金纳米棒免疫传感器,分别对血吸虫阳性和阴性血清识别,并且对日本血吸虫不同感染周期的阳性兔血清进行检测。结果证实,基于ITO固相金纳米棒免疫传感器是一种能够识别日本血吸虫阳性和阴性血清的有效检测工具,且对早期感染有较好的识别能力。该方法为早期日本血吸虫病的诊断提供有效的工具的同时,也为其他寄生虫病的诊断带来新的思路。
参考文献:
[1] Dang H,Xu J,Li SZ,et al. Monitoring the transmission ofSchistosomajaponicumin potential risk regions of China,2008-2012[J]. Int J Environ Res Public Health,2014,11(2): 2278-2287. DOI: 10.3390/ijerph110202278
[2] Chitsulo L,Engels D,Montresor A,et al. The global status of schistosomiasis and its control[J]. Acta Trop,2000,77(1): 41-51. DOI: 10.1016/S0001-706X(00)00122-4
[3] Chitsulo L,Loverde P,Engels D. Schistosomiasis[J]. Nat Rev Microbiol,2004,2(1): 12-13. DOI: 10.1038/nrmicro801
[4] Kongs A,Marks G,Verle P,et al. The unreliability of the Kato-Katz technique limits its usefulness for evaluatingS.mansoniinfections[J]. Trop Med Int Health,2001,6(3): 163-169. DOI: 10.1046/j.1365-3156.2001.00687.x
[5] Wen ZL,Wang SP,Wu ZY,et al. A novel liquid-phase piezoelectric immunosensor for detectingSchistosomajaponicumcirculating antigen[J]. Parasitol Int,2011,60(3): 301-306. DOI: 10.1016/j.parint.2011.05.001
[6] Zhang XE. Biosensor[M]. Beijing: Chemical Industry Press,2006: 1-15. (in Chinese)
张先恩.生物传感器[M].北京:化学工业出版社,2006:1-15.
[7] Lakhani PM,Rompicharla SV,Ghosh B,et al. An overview of synthetic strategies and current applications of gold nanorods in cancer treatment[J]. Nanotechnology,2015,26 (43): 432001. DOI: 10.1088/0957-4484/26/43/432001
[8] Che HL,Wang SP,Wu ZM,et al. A new fluorescence immunoassay based on magnetic nanoparticles forSchistosonajaponicumantibodies[J]. Chin J Analytical Chem,2008,36(11): 1455-1459. (in Chinese)
车宏莉,汪世平,吴争鸣,等. 基于磁性纳米颗粒的日本血吸虫抗体荧光免疫分析[J].分析化学,2008,36(11):1455-1459.
[9] Chen CD,Cheng SF,Chau LK,et al. Sensing capability of the localized surface plasmon resonance of gold nanorods[J]. Biosens Bioelectron,2007,22(6): 926-932. DOI: 10.1016/j.bios.2006.03.021
[10] Huang H,Liu F,Huang S,et al. Sensitive and simultaneous detection of different disease markers using multiplexed gold nanorods[J]. Anal Chim Acta,2012,755: 108-114. DOI: 10.1016/j.aca.2012.10.020
[11] Jain PK,Eustis S,El-Sayed MA. Plasmon coupling in nanorod assemblies: optical absorption,discrete dipole approximation simulation,and exciton-coupling model[J]. J Phys Chem B,2006,110(37): 18243-18253. DOI: 10.1021/jp063879z
[12] Sau TK,Murphy CJ. Self-assembly patterns formed upon solvent evaporation of aqueous cetyltrimethylammonium bromide-coated gold nanoparticles of various shapes[J]. Langmuir,2005,21(7): 2923-2929. DOI: 10.1021/la047488s
[13] Nash TE. Factors that modulate clearance and ultimate fate of a specific schistosome antigen (GASP) in schistosome infections[J]. J Immunol,1982,128(4): 1608-1613.
[14] Nash TE. Fate and mechanism of clearance of PSAP,a schistosome antigen,in schistosomiasis[J]. J Immunol,1983,131(5): 2520-2523.
[15] Liu SG,Song L,Xie LP,et al. Dynamic observation on the relationship betweenSchistosomajaponicuminfectiosity and ITS titers of circulating antigens detected with Dot-ELISA[J]. Chin J Parasit Dis Ctrl,1998,11(3): 204-206. (in Chinese)
刘世国,宋力,谢来平,等.应用Dot-ELISA进行日本血吸虫循环抗原检测时其滴度与感染度关系的动态观察[J].中国寄生虫病防治杂志,1998,11(3):204-206.
DOI:10.3969/j.issn.1002-2694.2016.04.001
通讯作者:汪世平,Email:wsp4373383@126.com
中图分类号:R383
文献标识码:A
文章编号:1002-2694(2016)04-0315-06
Corresponding author:Wang Shi-ping,Email: wsp4373383@126.com
收稿日期:2015-06-11修回日期:2015-11-29
Detection onSchistosomajaponicumcirculating antigen from rabbit serum in different periods using gold nanorod biosensors
HE Xin,WANG Shi-ping,ZHOU Yun-fei,HUANG Cheng-ming,LYUQIU Si-jia,NING Shui-bing
(DepartmentofParasitology,XiangyaSchoolofMedicine,CentralSouthUniversity,Changsha410078,China)
Abstract:In order to detect Schistosoma japonicum circulating antigen and to analyze the change of antibody in host,gold nanorods were prepared by seed-mediated growth and were deposited onto the ITO-glass slide. SIEA26-28k DaSjscFv antibody was bound onto the solid phase sensor and identified from the longitudinal plasmon of the GNRs wavelength shift as the optical signature. The biosensor was used to detect S.japonicum circulating antigens by employing Local Surface Plasmon Resonance (LSPR) changes,which subsequently resulted in better optical recognition of antigen-antibody binding. We demonstrate that the biosensor could accurately distinguish between S.japonicum-positive and -negative serum samples under the same conditions. We detected the infection serum with S.japonicum in different periods (1 to 8 week,respectively),and the results showed the different red shift was 17 nm,52 nm,28 nm,11 nm,13 nm,23 nm,45 nm and 43 nm respectively,and the change rule of antibody can be provided by these data. Meanwhile,the sensor,with high sensitivity and specificity,can offer a new monitoring method to study the antigen-antibody and diagnosis of schistosomiasis,and also bring new ideas for other parasite prevention and treatment.
Keywords:Schistosoma japonicum; circulating antigens; gold nanorod; sensor
国家自然科学基金(No.81271862),湖南省创新平台与人才计划(应用基础研究)重点项目(No.2015JC3022),中南大学中央高校基础研究业务费专项资金(No.2012zzts028)联合资助
