浅谈VEGF的相关研究进展
2016-07-25李骏刘旭东
李骏刘旭东
浅谈VEGF的相关研究进展
李骏1刘旭东2
【摘要】血管内皮生长因子(vascular endothelial growth factor,VEGF),是研究人员在20世纪末期发现的,是通过内皮细胞分离出的特异性促细胞分裂原。近几十年来,人们通过不断的研究,对VEGF有了更为深入的了解与认识。本文通过对VEGF的结构、功能及亚基进行简单的总结,并分析VEGF与血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)结合后的信号传导通路过程及相关参与因子。从而探讨针对VEGF/VEGFR目前的分子靶向治疗的优缺点及未来的发展情况。
【关键词】血管内皮生长因子;血管内皮细胞生长因子受体;信号通路;分子靶向治疗
1 引言
血管内皮生长因子(vascular endothelial growth factor,VEGF),是20世纪末期的研究人员从内皮细胞分离出的特异性促细胞分裂原,并通过实验证明其具有诱导生理性和病理性血管生成的能力。在过去的一段时期,血管通透性因子成为最新发现的具有促进血管渗透性增加的因子,但分离提取后被证明出与血管内皮生长因子(VEGF)是相同的。近几十年来,人们通过不断的研究,对VEGF有了更深层次的认识,如今提到的VEGF又被称为VEGFA,其家族成员还包括所述VEGFB,VEGFC,VEGFD和胎盘生长因子(PLGF)的成员。这些家族成员有着不同的表达方式,不同的受体特异性和不同的生物学功能。VEGFA,它通常被称为血管内皮生长因子,是家族生长因子分子量较大的一个,人类的VEGFA基因结构中包含了八个外显子,它们被七个内含子分离。随着对VEGF研究的深入,研究者们发现几个明显的变体,这些变体发生的原因可能是由于选择性剪接形成的。正因如此,它们的受体特异性和生物学功能也是不同的。
1.1 血管新生与疾病
血管新生主要在原有的毛细血管与/或微静脉基础上通过血管内皮细胞的增殖和迁移,从先前存在的血管处以芽生或非芽生(套叠)的形式生成新的毛细血管。有些疾病的发生发展和治疗与血管新生有密切的联系。血管新生与成人疾病关系较大,如肿瘤、类风关、子宫内膜异位症、动脉粥样硬化斑块等。血管新生受到促血管生成因子和抑血管生成因子的调控。血管内皮生长因子(VEGF)就是最重要的促血管生成因子之一,而且VEGF/VEGFR信号通路在病理性血管生长的过程中也起到非常关键的作用。相关研究表明,转染后癌基因通过增加肿瘤的VEGF表达进入肿瘤细胞后,会显著增加血管生成的活性。
1.2 VEGF家族受体
VEGF的结合位点是在体内、外血管内皮细胞的表面上。与VEGF结合存在两个重要的受体-酪氨酸激酶(RTKs),VEGFR-1和VEGFR-2。因此VEGFR-1和VEGFR-2具有相似的结构,均有7免疫球蛋白样胞外结构域,一个跨膜区和一个激酶插入区,而激酶插入区中断了共识酪氨酸激酶结构域的序列。VEGFR-2(KDR/Flk-1)是 VEGF的主要功能受体,介导 VEGF促进内皮细胞增殖、促内皮细胞存活作用与抗凋亡、促进内皮细胞迁移、提高血管通透性等效应。VEGFR-3(Fms-like-tyrosine kinase,Flt-4)也属于受体酪氨酸激酶(RTKs),是RTKs的同一种类的家庭成员之一,但它不是与VEGFA结合的受体而是与VEGFC、VEGFD结合[1]。除了这些RTKs之外,血管内皮生长因子与共同的受体家族——Neuropilins(NRP)。 综上所述,目前发现的 VEGF受体(VEGFR)主要有VEGFR-1、VEGFR-2、VEGFR-3、Neuropilin(NRP1/NRP2)。而VEGF 主要结合在两类酪氨酸激酶受体上:VEGFR-1 和 VEGF-2。
1.2.1 VEGFR-1(Flt-1)的分子量为180KDa,主要表达于单核细胞、滋养层细胞、肾系膜细胞和内皮细胞。虽然在10年之前,VEGFR-1是第一个被确定为血管内皮生长因子受体RTKs,但这种分子的确切作用目前仍在争论。最近的证据表明,VEGFR-1的功能和信号属性是可以根据不同动物的不同细胞的发育阶段来决定的。VEGFR-1的表达由于缺氧导致HIF-1依赖机制激活而得到上调的。VEGFR-1不仅与VEGFA而且与PLGF和VEGFB都会结合,但是它不与VEGFR-2结合。结合依赖于VEGFR-1的胞外免疫球蛋白(Ig)。VEGFR-1存在形式包括全长形式,可变剪接形式和可溶形式(sFlt-1)。全长形式和可溶性VEGFR-1两者与VEGFA结合比VEGFR-2具有更高的亲和力。因此VEGFA结合VEGFR-1可能会间接地阻止VEGFR-2的激活,特别是在血管新生初期。因此,sFlt-1已经涉及到了血管生成的负调节剂的研究。经过相关研究表明,VEGFR-1通过酪氨酸自身磷酸化来应答血管内皮生长因子[2],这对于VEGF/VEGFR-1结合后的信号通路研究具有重大的生物学意义。目前,VEGFR-1的信号已被证实诱导基质金属蛋白酶9(MMP-9)产生,进而可以促进肺癌内皮细胞生长和肺癌转移。VEGFR-1在造血祖细胞和原始内皮细胞募集反应中也起到了重要的作用,它的活化是通过PLGF招募VEGFR-1-阳性造血干细胞引起的,进而来重建造血功能。
1.2.2 VEGFR-2是VEGF的主要功能受体。虽然它与其配体的亲和力较低,但VEGFR-2的作用却不容忽视。VEGFR-2分布较为广泛,主要分布于内皮细胞表面,其他细胞还包括造血干细胞、视网膜前体细胞、巨核细胞。它的胞外Ig样结构域与可VEGFA抗原结合,VEGFR-2与VEGFA结合后会促进受体二聚化并通过通过同种近膜Ig样结构域间的亲和力作用来达到长久的稳定,使细胞内的酪氨酸残基磷酸化/自身磷酸化。VEGFR-2在完整细胞内经过二聚化和配体依赖的酪氨酸激酶磷酸化后,将导致细胞的有丝分裂、细胞趋化和释放存活信号。它的激活可以使VEGF诱导几种蛋白质在内皮细胞内磷酸化,其中包含有磷脂酶C-γ (protein kinase C-γ),PI-3激酶,Ras GTPase激活蛋白和SRC家族。还可以通过激活Raf/MeK/ErK通路,VEGFR-2的特征也是激活该通路并诱导内皮细胞增长,而在此过程中起决定作用的是蛋白激酶C而不是Ras,但是其间存在另一个途径蛋白激酶C(PKC)介导鞘氨醇激酶(SPK)激活从而使RAS途径激活[3-4]。VEGF/ VEGFR-2结合后通过酪氨酸激酶磷酸化位点Y1175磷酸化后激活PLC-γ,前者进一步激活PKC。同时磷酸化的PLC-γ水解膜磷脂的PIP2产生DAG和IP3。IP3的逐渐积累将导致的细胞内Ca2+增加,同时DAG激活PKC家族成员。PKC的激活也将导致PKD的活化,后者与磷酸化后的cAMP反应元件结合蛋白(CREB)以及热休克蛋白27(HSP27)一同激活组蛋白脱乙酰酶的核转位酶(HDAC)5和7从而增加核转运。VEGFR-2酪氨酸激酶磷酸化位点Y1214激活后会引起NCK/FYN复合物聚集并介导 PAK-2的磷酸化,随后激活Cdc42以及p38MAPK,与此同时在MAPKAPK2依赖性HSP27也被激活,从而促进内皮细胞的侵袭性。GAB1含有一个PI3K中的p85亚基结合位点。因此,GAB1/PI3K两者的结合及血管内皮生长因子刺激均可导致的PIP3的增加,这一过程还可激活GTP结合的RAC,导致膜的皱褶的形成和细胞运动性增强[5]。
综上所述,VEGFA/VEGFR-2(KDR)结合后会介导VEGF促进内皮细胞增殖、促内皮细胞存活作用与抗凋亡、促进内皮细胞迁移、提高血管通透性等效应。与VEGFR-2结合后VEGF突变体可以全面地增强内皮细胞的有丝分裂原和通透性,而与VEGFR-1结合的突变体缺乏这两种功能。
2 VEGF的靶向治疗
在确定VEGF具有促进血管生成和淋巴管生成的作用以来,这些功能就一直占据着VEGF研究领域的主导地位,并且这些研究对血管生成时复杂过程及机制有着深刻的见解及认识。重要的是,这些研究为针对VEGF和VEGFR靶向治疗的发展奠定了基础。目前,此类抗血管生成治疗的药物已应用于临床治疗当中。抗VEGF中和抗体(贝伐单抗,雷珠单抗),VEGF-165-RNA核酸适体(哌加他尼),VEGFR-1/R-2融合肽(VEGF-A-trap)和VEGFR TK多激酶抑制剂(索拉非尼,舒尼替尼等)已被批准用于临床,见图1。贝伐单抗和VEGFR TK多激酶抑制剂可用于治疗癌症[6]。
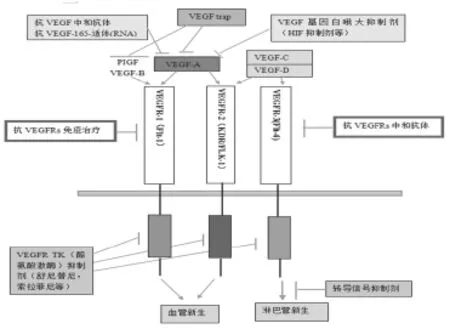
图1 部分抗血管生成药物图
针对于VEGF RTKs的靶向治疗:大量的临床研究表明,以VEGF/VEGFR信号通路发挥血管生成过程中的中心作用的各种疾病,如癌症,各种血管内皮生长因子信号抑制剂,包括抗VEGF中和抗体及VEGFR激酶/多激酶抑制剂,已研制成功并现已广泛应用于临床。这些药物在癌症治疗中有效的延长无进展生存率以及总生存期,并已被批准用于多种实体肿瘤如结肠直肠癌,肺癌(非小细胞肺癌),乳腺癌,胶质母细胞瘤,肝癌和肾癌[7]。有关研究在皮肤癌的小鼠移植瘤模型中通过抗体介导抑制VEGFR-2,发现肿瘤体积消缩减、新生肿瘤细胞被损害以及微血管密度降低。此外,VEGFR-2的表达或活性的抑制阻断了VEGF-VEGFR-2-NRP1信号轴,这种抑制作用可以在体外阻碍胶质瘤干细胞的生存力和增加神经胶质瘤异种移植瘤小鼠的生存时间。这次研究是以细胞内VEGFR-2的信号发生和抑制VEGFR-2酪氨酸激酶活性,并未通过贝伐单抗等药物[8]。
3 结论
多细胞生物体细胞内的信号传递是高度复杂的网络过程。不同的外界或内在刺激会引发不同的信号传导和信号偶联,从而对生物的生命活动进程进行调控。信号通路的异常往往与肿瘤发生相关。由于胆管癌的发病率在全世界范围内表现出一个逐渐增加同时又缺乏有效的治疗措施,因此找到治疗胆管癌的关键靶位点以及靶向药物成为目前研究热点之一。在众多疾病中VEGF的信号通路都扮演者重要的角色,其中最为熟知的应为癌症,目前针对于癌症的VEGF相关的分子靶向治疗已经得到进一步的完善,但许多问题有待解决,例如严重的副作用,难以预知的不良反应及药物之间复杂的药理作用等等。不过许多新型的VEGF/VEGFR的抑制剂正在被研究探讨。sFlt-1(可溶性VEGFR-1)、sFlk-1(可溶性VEGFR-2/sKDR)也VEGF NRPs逐步被人们所重视和研究。相信随着对VEGF及其受体信号通路的不断研究,针对于VEGF的靶向治疗或药物开发都会有更为稳定的发展。
参考文献
[1]Koichi Hattori, Beate Heissig,Yan Wu,et al. Placental growth factor reconstitutes hematopoiesis by recruiting VEGFR-1(+) stem cells from bone-marrow microenvironment[J]. Nat. Med.,2002,8 (8):841-849.
[2]Cain RJ,Ridley AJ. Phosphoinositide 3-kinases in cell migration[J].Biol Cell,2009,101(1):13-29.
[3]Zhao R,Liu XQ,Wu XP,et al. Vascular endothelial growth factor (VEGF) enhances gastric carcinoma invasiveness via integrin alpha (v) beta6[J]. Cancer Lett.,2010,287:150-156.
[4]Chung AS,Ferrara N. Developmental and pathological angiogenesis[J]. Annu Rev Cell Dev Biol.,2011(27):563-584.
[5]Beck B, Driessens G, Goossens S,et al. A vascular niche and a VEGF-Nrp1 loop regulate the initiation and stemness of skin tumours[J]. Nature,2011,478(7369):399-403.
[6]Adham SA,Sher I,Coomber BL. Molecular blockade of VEGFR-2 in human epithelial ovarian carcinoma cells[J]. Lab Invest.,2010,90(5):709-723.
[7]Snuderl M,Batista A,Kirkpatrick ND,et al. Targeting placental growth factor/neuropilin 1 pathway inhibits growth and spread of medulloblastoma[J]. Cell,2013,152(5):1065-1076.
[8]Bottsford-MillerJN,ColemanRL,SoodAK. Resistance and escape from antiangiogenesis therapy:clinical implications and future strategies[J]. J Clin Oncol.,2012,30(32):4026-4034.
【中图分类号】R735.7
【文献标识码】A
【文章编号】1674-9308(2016)09-0201-03
doi:10.3969/j.issn.1674-9308.2016.09.141
基金项目:内蒙古自治区科技厅科技计划项目资助课题(项目编号:kjt15sf03)
作者单位:1 内蒙古医科大学研究生学院,内蒙古 呼和浩特 010059;2 内蒙古医科大学附属医院急诊外科,内蒙古 呼和浩特 010059
通讯作者:刘旭东,E-mail:nmliuxudong@163.com
The Research Progress of VEGF
LI Jun1LIU Xudong2, 1 Inner Mongolia medical university Graduate faculty, Hohhot Inner Mongolia 010059, China, 2 Inner Mongolia medical university People's hospital affiliated Emergency surgical department, Hohhot Inner Mongolia 010059, China
[Abstract]Vascular endothelial growth factor (VEGF), researchers foundthat in the late 20thcentury, is separated by the endothelial cell-specific mitogen. In recent decades, people through continuous research on VEGF have a more in-depth understanding and knowledge. This paper was given a brief summary based on the VEGF structure, function and subunit simple. Analysis of the signal VEGF and vascular endothelial growth factor receptor (VEGFR) pathway upon binding to participate in the process and related factors. So as to explore the advantages and disadvantages for the future development of the VEGF / VEGFR current molecular targeted therapy.
[Key words]Vascular endothelial growth factor, Vascular endothelial growth factor receptor (VEGFR), Signaling pathway, Molecularly targeted therapy
