前列腺特异性抗原密度预测前列腺癌包膜侵犯的价值研究
2016-07-25翁锡君谢立平郑祥义蔡柏森项尖尖尤启汉
翁锡君,谢立平,郑祥义,汪 朔,蔡柏森,项尖尖,尤启汉
·论著·
前列腺特异性抗原密度预测前列腺癌包膜侵犯的价值研究
翁锡君,谢立平,郑祥义,汪 朔,蔡柏森,项尖尖,尤启汉
310003浙江省杭州市,浙江大学附属第一医院泌尿外科〔翁锡君(现任职于浙江省宁波市泌尿肾病医院),谢立平,郑祥义,汪朔〕,超声科(蔡柏森,项尖尖),病理科(尤启汉)
【摘要】目的探讨前列腺特异性抗原密度(PSAD)预测前列腺癌包膜侵犯的价值。方法选取2007年3月—2014年1月于浙江大学附属第一医院泌尿外科治疗的局限性前列腺癌患者222例为研究对象,根据术后病理分期将患者分为包膜侵犯组(pT3a期,110例)和局限包膜内组(pT2期,112例)。采用Gleason评分评价前列腺癌的分化程度。采集患者外周静脉血,以化学发光微粒子免疫法检测总前列腺特异性抗原(tPSA)、游离前列腺特异性抗原(fPSA),计算游离前列腺特异性抗原与总前列腺特异性抗原比值(f/t)。经直肠B超测定前列腺体积,计算PSAD。结果两组年龄比较,差异无统计学意义(P>0.05)。两组Gleason评分、tPSA、f/t及PSAD比较,差异均有统计学意义(P<0.05)。Gleason评分、tPSA、f/t、PSAD预测前列腺癌包膜侵犯的ROC曲线下面积(AUC)分别为0.623〔95%CI(0.549,0.697)〕、0.653〔95%CI(0.582,0.725)〕、0.338〔95%CI(0.267,0.408)〕、0.708〔95%CI(0.641,0.775)〕,且均有统计学意义(P<0.05)。PSAD最佳界点为0.27 μg·L-1·cm-3,灵敏度和特异度分别为83.6%、48.2%,阳性预测值和阴性预测值分别为47.0%、84.2%。多因素Logistic回归分析显示,高PSAD是前列腺癌包膜侵犯的危险因素〔OR=4.639,95%CI(1.303,16.514),P=0.018〕。结论PSAD预测前列腺癌包膜侵犯具有一定的准确性,有一定的临床应用价值。
【关键词】前列腺肿瘤;前列腺特异性抗原;前列腺特异性抗原密度;包膜侵犯
翁锡君,谢立平,郑祥义,等.前列腺特异性抗原密度预测前列腺癌包膜侵犯的价值研究[J].中国全科医学,2016,19(20):2406-2409.[www.chinagp.net]
WENG X J,XIE L P,ZHENG X Y,et al.Prediction value of prostate-specific antigen density in capsular invasion of prostate cancer[J].Chinese General Practice,2016,19(20):2406-2409.
随着前列腺癌早期筛查工作的开展,前列腺癌发病率逐年增加,越来越多的患者接受了根治性前列腺切除术。然而部分患者术后病理提示肿瘤存在前列腺外侵犯,如包膜侵犯、精囊侵犯或淋巴转移等,是术后生化复发和不良预后的重要预测因子[1]。因此,如何在术前预判肿瘤的侵犯情况至关重要。现有的影像学检查技术,如计算机断层扫描(CT)、磁共振成像(MRI)、正电子发射计算机体层显像(PET/CT)等,尚无法在早期准确诊断肿瘤是否存在前列腺外的微转移。一般认为MRI的诊断准确性最高,可达75%~90%[2]。临床需要在术前借助一些预测工具来判断肿瘤是否存在前列腺外的侵犯,其中Partin tables应用最广泛,但对包膜侵犯的预测准确性较低[3-5]。
前列腺特异性抗原密度(PSAD)是指单位体积前列腺的前列腺特异性抗原(PSA)水平,其在前列腺癌的早期筛查中,提高了PSA的灵敏度。近期国外研究发现,PSAD与前列腺癌根治术后的病理特征存在相关性[6],但其是否能够帮助预测肿瘤存在前列腺外的侵犯仍存在争议[7-11],国内尚未见较大样本量的相关报道。本研究旨在通过回顾性分析浙江大学附属第一医院泌尿外科前列腺癌随访数据库中的患者临床资料,探讨PSAD对前列腺癌包膜侵犯的预测价值。
1对象与方法
1.1研究对象选取2007年3月—2014年1月于浙江大学附属第一医院泌尿外科治疗的局限性前列腺癌患者222例为研究对象,年龄45~83岁。纳入标准:(1)因PSA异常或影像学检查提示肿瘤可疑,而后行组织活检确诊,具有Gleason评分,且术前临床分期为T1~T2c;(2)术前均未行新辅助化疗或使用可能影响PSA水平的药物,如5α-还原酶抑制剂等;(3)接受开放或腹腔镜下的根治性前列腺切除术,手术标本送组织病理学检查,术后病理分期≤pT3a,即病理未提示合并存在精囊侵犯、淋巴转移等;(4)临床资料完整。根据术后病理分期将患者分为包膜侵犯组(pT3a期,110例)和局限包膜内组(pT2期,112例)。
1.2方法
1.2.1Gleason评分B超定位下行前列腺组织穿刺获取病理标本,采用Gleason评分评价前列腺癌的分化程度,将前列腺癌组织分为主要分级区和次要分级区,每区评分为1~5分,评分越高,分化越差。主要分级区和次要分级区评分之和为该患者的Gleason评分。
1.2.2术前PSA水平测定于前列腺按摩后1周,膀胱镜检查、导尿等操作48 h,射精24 h,前列腺穿刺1个月后,无急性前列腺炎、尿潴留等疾病时测定PSA水平。采集患者外周静脉血3~5 ml,采用全自动微粒子化学发光免疫分析仪及其配套免疫试剂(美国雅培公司),以化学发光微粒子免疫法检测总前列腺特异性抗原(tPSA)、游离前列腺特异性抗原(fPSA),计算游离前列腺特异性抗原与总前列腺特异性抗原比值(f/t)。
1.2.3前列腺体积测定经直肠B超测定前列腺左右、前后、上下径,按照球形体积计算公式,将半径换算为三径并简化,前列腺体积=最大横向直径×最大前后直径×最大纵向直径×0.52[12]。PSAD=tPSA/前列腺体积。
1.3统计学方法采用SPSS 19.0进行统计学分析,非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验[11,13];采用ROC曲线分析各指标预测前列腺癌包膜侵犯的价值,ROC曲线下面积(AUC)>0.700提示评价指标具有一定的诊断价值[14];采用多因素Logistic回归分析前列腺癌包膜侵犯的影响因素。以P<0.05为差异有统计学意义。
2结果
2.1临床资料比较两组年龄比较,差异无统计学意义(P>0.05)。两组Gleason评分、tPSA、f/t及PSAD比较,差异均有统计学意义(P<0.05,见表1)。

表1 两组患者临床资料比较〔M(P25,P75)〕
注:tPSA=总前列腺特异性抗原,f/t=游离前列腺特异性抗原与总前列腺特异性抗原比值,PSAD=前列腺特异性抗原密度
2.2ROC曲线分析Gleason评分、tPSA、f/t、PSAD预测前列腺癌包膜侵犯的AUC分别为0.623〔95%CI(0.549,0.697)〕、0.653〔95%CI(0.582,0.725)〕、0.338〔95%CI(0.267,0.408)〕、0.708〔95%CI(0.641,0.775)〕,且均具有统计学意义(P<0.05)。PSAD最佳界点为0.27 μg·L-1·cm-3,预测列腺癌包膜侵犯的灵敏度和特异度分别为83.6%、48.2%,阳性预测值和阴性预测值分别为47.0%、84.2%(见图1)。
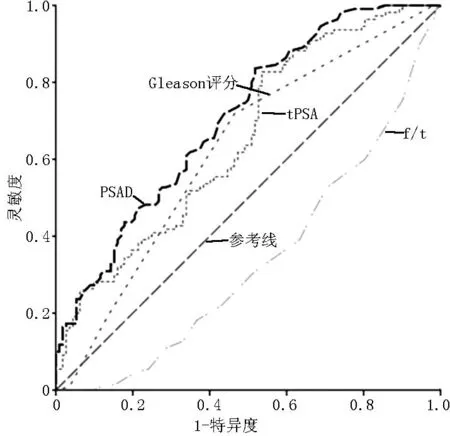
注:tPSA=总前列腺特异性抗原,f/t=游离前列腺特异性抗原与总前列腺特异性抗原比值,PSAD=前列腺特异性抗原密度
图1Gleason评分、tPSA、f/t、PSAD预测前列腺癌患者包膜侵犯的ROC曲线
Figure 1ROC curves of Gleason score,tPSA,f/t and PSAD predicting capsular invasion of prostate cancer
2.3多因素Logistics回归分析以Gleason评分、tPSA、f/t、PSAD为自变量,以包膜侵犯(是=1,否=0)为因变量行多因素Logistics回归分析。结果显示,高PSAD是前列腺癌包膜侵犯的危险因素〔β=1.534,SE=0.648,Wald χ2值=5.611,OR=4.639,95%CI(1.303,16.514),P=0.018〕。
3讨论
自PSA临床应用以来,前列腺癌检出率逐步增加。前列腺癌治疗策略的选择依赖于临床分期,因此如何于治疗前准确评估前列腺癌患者的疾病发展至关重要。目前根治性前列腺切除术仍是治疗早期局限性前列腺癌最有效的手段,尤其是针对预期生存时间超过10年的患者[15]。然而现有的诊断方法,如直肠指检、血清PSA、肿瘤活检病理分级、影像学检查及盆腔淋巴结活检等,均无法准确判定肿瘤是否存在前列腺外的微侵犯和微转移。
有学者通过分析患者术前临床资料对局限性前列腺癌的术后病理特征进行预测[3-5]。其中Partin tables最具代表性,其通过前列腺癌患者PSA水平、术前组织活检Gleason评分等来预测前列腺癌根治术后的病理特征,其准确性已得到多国多中心的验证[3],Partin tables 2012版预测包膜侵犯、精囊侵犯、淋巴转移的AUC分别为0.702、0.853、0.917[16]。高旭等[17]研究发现,将Partin tables应用于我国前列腺癌患者也得出类似结论,其中预测包膜侵犯的AUC为0.665。在本研究中,PSAD预测前列腺癌包膜侵犯的AUC为0.708,提示其具有较好的预测效能。
生理情况下,PSA是由前列腺上皮细胞分泌产生,直接分泌到前列腺导管系统内。由于前列腺导管系统周围的血-上皮细胞屏障,避免PSA直接进入血液,从而维持血液中PSA处于低水平。前列腺癌组织破坏血-上皮细胞屏障,致使PSA直接进入血液,前列腺癌恶性程度越高,对于正常前列腺组织破坏越大,血清PSA水平越高。PSAD指单位体积前列腺的PSA水平,即血清总PSA水平与前列腺体积的比值。因此,PSAD兼顾了PSA与前列腺体积,也间接反映了癌腺体的体积。
国外多项研究表明了PSAD在预测前列腺癌根治术后病理特征中的价值。KUNDU等[6]在由一项1 662例患者参与的研究中指出,PSAD随术后病理特征的恶化程度增加而升高。RADWAN等[8]也发现,无论PSAD的测量是通过术后病理标本质量计算或术前经超声测量所得,均是预测术后病理特征和生化复发的重要预测因子。MAGHELI等[9]更是在一项13 434例患者参与的大样本研究中发现,虽然当Gleason评分≥7分时,PSAD较tPSA在预测前列腺癌包膜侵犯时无明显优势,但当Gleason评分<7分时却有明显优势。近期SFOUNGARISTOS等[11]在一项285例患者参与的研究中表示,PSAD能准确预测前列腺癌根治术后的病理特征,且预测价值高于PSA和Gleason评分,可作为评价前列腺癌侵袭力的指标。
然而也有学者认为,PSAD对前列腺癌包膜侵犯的预测价值有限。HORNINGER等[7]在一项102例患者参与的研究中指出,tPSA预测前列腺癌包膜侵犯时的价值优于PSAD,且当其联合f/t时更具优势。GIANNARINI等[10]也在一项109例患者参与的研究中发现,PSAD预测前列腺癌根治术后病理特征的价值不优于tPSA。近期LIN等[13]在一项188例的研究中更是发现,tPSA仍然是预测前列腺癌包膜外侵犯的重要预测因子,但当Gleason评分为7分时,PSAD则可能有一定的优势。
目前,国内关于PSAD预测前列腺癌病理分期价值的相关研究较少。朱虹等[18]在一项92例患者参与的研究中发现,与tPSA比较,PSAD对前列腺癌患者病理分期有更好的预测价值,病理分期预测模型可考虑以PSAD替代tPSA。冯衍飞等[19]通过一项50例患者参与的研究也认为,PSAD可作为前列腺癌根治术后不良病理的预测指标。而刘帅等[20]在一项124例患者参与的研究中指出,与tPSA、PSAD及Gleason评分比较,tPSA对前列腺癌病理分期具有较好的预测价值,其联合Gleason评分可提高预测准确性。
本研究发现,PSAD预测前列腺癌包膜侵犯具有一定的准确性,PSAD取最佳预测界点0.27 μg·L-1·cm-3时,其灵敏度和特异度分别为83.6%和48.2%,在临床应用需谨慎。本研究为目前国内PSAD预测前列腺癌包膜侵犯价值相关研究样本量相对较大的研究,但本研究为回顾性分析,也存在一定的局限性,如剔除了较多临床资料不完整的患者、经直肠超声测量前列腺体积有一定的误差,本研究结论尚需进一步验证。
作者贡献:翁锡君进行课题设计与实施、资料收集整理、成文并对文章负责;汪朔、蔡柏森、项尖尖、尤启汉进行课题设计与实施、评估、资料收集整理;谢立平、郑祥义进行质量控制及审校。
本文无利益冲突。
参考文献
[1]THOMPSON I M,VALICENTI R K,ALBERTSEN P,et al.Adjuvant and salvage radiotherapy after prostatectomy:AUA/ASTRO guideline[J].J Urol,2013,190(2):441-449.
[2]孙颖浩.我国前列腺癌的研究现状[J].中华泌尿外科杂志,2004,25(2):77-80.
[3]PARTIN A W,KATTAN M W,SUBONG E N,et al.Combination of prostate-specific antigen,clinical stage,and Gleason score to predict pathological stage of localized prostate cancer.A multi-institutional update[J].JAMA,1997,277(18):1445-1451.
[4]D′AMICO A V,WHITTINGTON R,MALKOWICZ S B,et al.The combination of preoperative prostate specific antigen and postoperative pathological findings to predict prostate specific antigen outcome in clinically localized prostate cancer[J].J Urol,1998,160(6 Pt 1):2096-2101.
[5]GILLILAND F D,HOFFMAN R M,HAMILTON A,et al.Predicting extracapsular extension of prostate cancer in men treated with radical prostatectomy:results from the population based prostate cancer outcomes study[J].J Urol,1999,162(4):1341-1345.
[6]KUNDU S D,ROEHL K A,YU X,et al.Prostate specific antigen density correlates with features of prostate cancer aggressiveness[J].J Urol,2007,177(2):505-509.
[7]HORNINGER W,ROGATSCH H,REISSIGL A,et al.Correlation between preoperative predictors and pathologic features in radical prostatectomy specimens in PSA-based screening[J].Prostate,1999,40(1):56-61.
[8]RADWAN M H,YAN Y,LULY J R,et al.Prostate-specific antigen density predicts adverse pathology and increased risk of biochemical failure[J].Urology,2007,69(6):1121-1127.
[9]MAGHELI A,RAIS-BAHRAMI S,TROCK B J,et al.Prostate specific antigen versus prostate specific antigen density as a prognosticator of pathological characteristics and biochemical recurrence following radical prostatectomy[J].J Urol,2008,179(5):1780-1784.
[10]GIANNARINI G,SCOTT C A,MORO U,et al.Are PSA density and PSA density of the transition zone more accurate than PSA in predicting the pathological stage of clinically localized prostate cancer?[J].Urol Oncol,2008,26(4):353-360.
[11]SFOUNGARISTOS S,PERIMENIS P.PSA density is superior than PSA and Gleason score for adverse pathologic features prediction in patients with clinically localized prostate cancer[J].Can Urol Assoc J,2012,6(1):46-50.
[12]TERRIS M K,STAMEY T A.Determination of prostate volume by transrectal ultrasound[J].J Urol,1991,145(5):984-987.
[13]LIN S,ZHANG Q,LI P,et al.Prediction of extraprostatic extension in patients with clinically organ-confined prostate cancer[J].Urol Int,2014,92(3):282-288.
[14]李康,林一帆.评价判别模型诊断效果的ROC分析[J].中国卫生统计,1996,11(3):9-12.
[15]HEIDENREICH A,BASTIAN P J,BELLMUNT J,et al.EAU guidelines on prostate cancer.part 1:screening,diagnosis,and local treatment with curative intent-update 2013[J].Eur Urol,2014,65(1):124-137.
[16]EIFLER J B,FENG Z,LIN B M,et al.An updated prostate cancer staging nomogram(Partin tables) based on cases from 2006 to 2011[J].BJU Int,2013,111(1):22-29.
[17]高旭,孙颖浩,许传亮,等.应用Partin tables预测国人前列腺癌术后病理特征准确性的研究[J].中华泌尿外科杂志,2007,28(9):614-618.
GAO X,SUN Y H,XU C L,et al.Accuracy of Partin tables to predict final pathological features in prostate cancer of Chinese population[J].Chinese Journal of Urology,2007,28(9):614-618.
[18]朱虹,章青,吴登龙,等.分析血清PSA系列及Gleason评分在前列腺癌分期中的预测价值[J].肿瘤,2008,28(7):613-616.
[19]冯衍飞,刘勇,孟令雪,等.PSA密度对前列腺癌病理结果的预测价值[J].现代生物医学进展,2013,13(15):2959-2962,2856.
FENG Y F,LIU Y,MENG L X,et al.Predictive value of PSA density in pathologic features of prostate cancer[J].Progress in Modern Biomedicine,2013,13(15):2959-2962,2856.
[20]刘帅,吕家驹,傅强,等.血清tPSA、PSAD及Gleason评分在前列腺癌分期中的应用价值[J].中华男科学杂志,2010,16(5):415-419.
(本文编辑:吴立波)
Prediction Value of Prostate-specific Antigen Density in Capsular Invasion of Prostate Cancer
WENGXi-jun,XIELi-ping,ZHENGXiang-yi,etal.
DepartmentofUrology,theFirstAffiliatedHospital,ZhejiangUniversity,Hangzhou310003,China
【Abstract】ObjectiveTo discuss the predictive value of prostate-specific antigen density(PSAD) in capsular invasion of prostate cancer.Methods222 patients with localized prostate cancer,who were treated in the Department of Urology of the First Affiliated Hospital of Zhejiang University from March 2007 to January 2014,were selected as the study subjects.According to their postoperative pathological stages,we divided the patients into capsular invasion group(stage pT3a,n=110) and localized in-capsule group(stage pT2,n=112).The differentiation degree of prostate cancer was assessed by adopting Gleason score.After the collection of the peripheral venous blood,we detected the total prostate-specific antigen(tPSA) and the free prostate-specific antigen(fPSA),and calculated the ratio of the two(f/t).The prostate volume was measured by transrectal B ultrasonography to calculate PSAD.ResultsThere was no significant difference in age between the two groups(P>0.05).There were significant differences in Gleason score,tPSA,f/t and PSAD(P<0.05).The areas under the ROC curve(AUC) of Gleason score,tPSA,f/t,PSAD in predicting the capsular invasion of patients with prostate cancer were 0.623 〔95%CI(0.549,0.697)〕,0.653 〔95%CI(0.582,0.725)〕,0.338 〔95%CI(0.267,0.408)〕 and 0.708 〔95%CI(0.641,0.775)〕 respectively,showing significant differences(P<0.05).The best critical point of PSAD was 0.27 ng·ml-1·cm-3with a sensitivity and specificity degree of 83.6% and 48.2% respectively,and the positive and negative predictive value were 47.0% and 84.2% respectively.The multivariate Logistic regression analysis showed that high PSAD was the risk factor of capsular invasion of prostate cancer〔OR=4.639,95%CI(1.303,16.514),P=0.018〕.ConclusionThere is certain accuracy of PSAD in predicting capsular invasion of prostate cancer,which has certain clinical application value.
【Key words】Prostatic neoplasms;Prostate-specific antigen;Prostate-specific antigen density;Capsular invasion
基金项目:国家临床重点专科建设项目(2012泌尿外科);浙江省中西医结合前列腺病学重点学科(2012-XK-A23)
通信作者:谢立平,310003浙江省杭州市,浙江大学附属第一医院泌尿外科;E-mail:xielp@zjuem.zju.edu.cn
【中图分类号】R 737.25
【文献标识码】A
DOI:10.3969/j.issn.1007-9572.2016.20.009
(收稿日期:2015-12-11;修回日期:2016-05-06)
