一株猪繁殖与呼吸综合征病毒野毒株的基因序列分析
2016-07-25刘道泉吴波平福州市动物疾病预防控制中心福建福州350003福建省动物疾病预防控制中心福建福州350003
刘道泉,吴波平(. 福州市动物疾病预防控制中心,福建福州 350003;. 福建省动物疾病预防控制中心,福建福州 350003)
一株猪繁殖与呼吸综合征病毒野毒株的基因序列分析
刘道泉1,吴波平2
(1. 福州市动物疾病预防控制中心,福建福州350003;2. 福建省动物疾病预防控制中心,福建福州350003)
摘要:为了解福建省福州市的猪繁殖与呼吸综合征病毒(PRRSV)的分子流行病学情况,对从一例猪繁殖与呼吸综合征临床疑似病例中分离的PRRSV,特异性扩增了其ORF3、ORF5、NSP2片段,然后进行基因测序和分析。结果表明:该毒株NSP2编码区、ORF3基因、ORF5基因与国内流行的PRRSV变异株核苷酸同源性分别在94.9%~97.7%、95.2%~97.7%和96.1%~96.7%。由此推断,该株由国内流行的变异毒株演化而来。
关键词:猪繁殖与呼吸综合征;基因序列分析;进化树
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是一种危害当前养猪业的主要病毒之一,可引起母猪繁殖障碍,断奶仔猪发生肺炎、生长迟缓以及高死亡率[1-3]。感染猪只通过唾液、鼻分泌物、尿液、精液以及粪便排毒[4];怀孕后期感染母猪可通过乳汁排毒;公猪精液带毒期可达90 d。PRRSV具有高度宿主依赖性,主要在猪肺泡巨噬细胞以及其他组织巨噬细胞中生长,也能在睾丸细胞中生长[5-6]。由于PRRSV是一种小RNA病毒,其基因组易于变异且不同毒株仅有部分具有交叉保护作用,因此基因测序成为PRRSV的常规诊断方法,同时对疫苗毒株的选择有重要意义[7]。NSP2除了在病毒的复制中发挥作用外,其含有大量抗原决定簇,可以被感染宿主的免疫系统识别[8]。
研究表明,全球大多数生猪养殖国家中普遍存在PRRSV重组株,其可产生嵌合病毒株[9-10]。境外新毒株的传入已造成不少猪场感染和发病,成为近年来的流行毒株之一,NADC30-like毒株已在我国多个地区流行和传播[11]。当前由于盲目使用、长时间使用、高频度免疫而导致猪场出现临床发病、猪群不稳定的现象十分普遍,许多猪场的 蓝耳病已由疫苗毒所致,而非野毒感染[11-13]。
当前由于猪场生物安全难以做到位,以及高致病性减毒活疫苗的误用和不正确使用,使得猪繁殖与呼吸综合征病毒毒株的多样性急剧攀升、变异程度加快,出现了不少新的毒株、重组毒株。其与猪繁殖与呼吸综合症病毒野毒株在猪场共存,难以区分是野毒感染还是疫苗毒感染[11,14-15]。为此,进行分离株的基因测序分析是非常有必要的,这不仅为进一步研究猪繁殖与呼吸综合征病毒的生物学信息奠定基础,也为探索有效的防控方案奠定基础。
1 材料与方法
1.1病料
病料来源于福州市某规模化猪场免疫过猪繁殖与呼吸综合征(PRRS)疫苗(经典株)的50~60日龄保育猪。临床表现为体温升高至41℃左右,腹式呼吸,部分出现腹泻症状;剖检可见肺间质增宽、淤血,脾脏肿大梗死,淋巴结肿大出血等。选择临床症状典型的病猪,采集扁桃体、肺脏、脾脏、淋巴结、血液等样品。
1.2主要试剂
Premix Ex Taq(TaKaRa Ex Taq Version 2.0 plus dye)、Primer Script One Step RT-PCR Kit ver.2、6 Loading buffer、分子量标准DL2000 Marker、克隆载体pMD-18T Vector,购自宝生物工程(大连)有限公司;Hight Pure Viral RNA Kit,购自Roche;PRRSV荧光RT-PCR检测试剂盒,购自北京生科尚仪;琼脂糖(Agarose)、感受态细胞DH5α大肠杆菌(Escherichia coli),购自北京全式金生物技术有限公司;Goldview染料,购自赛百盛;胶回收(小量)试剂盒、质粒小量抽提试剂盒,以及常规化学试剂、耗材和药品,购自生工生物工程(上海)股份有限公司。
1.3病毒核酸的提取
采集患病猪只的肺部组织、肺门淋巴结,充分剪碎后置于2 mL离心管中,加入800 μL高盐溶液;用漩涡振荡器充分震荡混匀后,反复冻融3次,离心3 000 rpm 2 min,取上清。按照动物组织基因组RNA提取试剂盒(Hight Pure Viral RNA Kit)操作方法提取组织RNA,洗脱核酸,后置于-20 ℃备用。
1.4引物设计
参考杨汉春等[8-9]文献,设计引物并由上海生工生物工程技术服务有限公司合成。
1.5病毒的检测、克隆、测序和序列分析
PRRSV的检测按照北京生科尚仪的方法进行。确诊为PRRSV阳性后,对ORF3、ORF5、ORF7、NSP2片段进行克隆,PCR扩增体系为25 μL,其中Primer Script 1 Step Enyzyme Mix 1 μL、2 1 Step Buffer 12.5 μL、上下游引物(20 μm/mL)各1 μL、DNA模板9.5 μL。PCR产物经胶回收试剂盒Gel Extraction Kit切胶回收后,与pMD18-T载体连接,转化DH5α感受态细胞。随机选择8个克隆,用质粒提取试剂盒UNIQ-10提取质粒,用PCR方法鉴定重组质粒。随机选择3份阳性重组质粒送由上海生工生物工程技术服务有限公司测序。用DNAStart软件,将测序结果与GenBank中收录的国内外参考毒株进行比较分析,绘制遗传进化树。
2 结果
2.1目的基因扩增结果
应用特异性引物,扩增出PRRSV ORF3、ORF5、ORF7、NSP2基因片段,大小与预期相符,结果见图1。
2.2基因序列的拼接与同源性比较

图1 目的片段1%琼脂糖凝胶电泳
将该毒株(MX-2015)序列测序结果,经BLAST分析验证后,和GenBank中登录的PRRSV代表株进行核苷酸同源性比较。其ORF3基因核苷酸序列长度为765 bp,编码255个氨基酸;其核苷酸与其他毒株比对,发生点状变异,与国内其他PRRSV变异株核苷酸同源性为97.1%~97.8%,与国外毒株同源性为62.7%~91.9%,与国内最新分离毒株NADC-30同源性仅为84.1%(图2~3)。
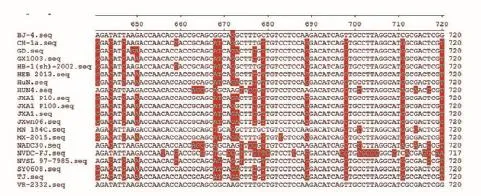
图2 PRRSV ORF3核苷酸序列比对

图3 PRRSV ORF3核苷酸同源性比较

图4 PRRSV ORF5核苷酸序列比对

图5 PRRSV ORF5核苷酸同源性比较
其ORF5核苷酸序列长度为603 bp,编码201个氨基酸,核苷酸序列在第87~150位发生明显点状突变,与国内其他PRRSV变异株核苷酸同源性为97.2%~97.7%,与JXA1同源性最高,为97.7%,同国内经典株CH-1a株同源性为87.7%,同国外分离株同源性为63.3%~90.7%,与国内最新分离毒株核苷酸同源性为85.4%(图4~5)。
其NSP2核苷酸序列长度为2 827 bp,与其他流行毒株的核苷酸比对,在第570~640位发生明显点状突变,与国内其他PRRSV变异株核苷酸同源性为96.1%~96.7%,同国内经典株CH-1a株同源性为89.9%,同国外分离株同源性为52%~86.5%(图6~7)。
3 讨论
PRRSV是世界范围内影响生猪生产的最重要病毒之一,可产生严重的经济损失和公共卫生问题[16]。关于PRRSV的一个关键问题源于其基因多样性,其被认为可直接影响免疫生物学、流行病学、诊断和疫苗效果。造成这种基因多样性的一个重要原因是不同病毒株之间的重组[17-19]。一直以来,PRRSV NSP2、GP5和GP3的变异特征为该毒株分子衍化分析的重要指标[20],故本研究对一株PRRSV毒株与毒株(MX-2015)的NSP2、ORF5、ORF3进行序列分析。结果表明,该毒株NSP2编码区、ORF3基因、ORF5基因与我国主要的PRRSV变异株核苷酸同源性分别在94.9%~97.7%、95.2%~97.7%、96.1%~96.7%, 与国外分离株的核苷酸同源性分别为 62.7%~91.9%、63.3%~90.7%、52%~86.5%。

图6 PRRSV NSP2核苷酸序列比对

图7 PRRSV NSP2核苷酸同源性比较
通过遗传进化树的分析比对, MX-2015株与国内PRRSV变异株JX株、TJ株、HUN株、GD株等均处于同一分支,推断该毒株仍是由这些毒株变异演化而来。本试验结果丰富了福建省PRRSV的基因组数据。
参考文献:
[1]安同庆. 猪繁殖与呼吸综合征病毒与宿主细胞受体之间相互作用的研究及病毒遗传变异分析[D]. 北京:中国农业科学院,2007.
[2]高志强. 猪繁殖与呼吸综合征病毒全基因组分子遗传特征分析[D]. 北京:中国农业大学,2003.
[3]董建国. 猪繁殖与呼吸综合征病毒Nsp9与宿主细胞蛋白pRb相互作用的分子机制[D]. 北京:中国农业大学,2014.
[4]韦天超. 高致病性猪繁殖与呼吸综合征病毒人工感染模型的建立及其部分生物学特性研究[D]. 北京:中国农业科学院,2009.
[5]刘灿. 猪繁殖与呼吸综合征高致病性毒株的致弱评价与相关分子机制研究[D]. 北京:中国农业大学,2015.
[6]郝晓芳,周艳君,田志军,等. 高致病性猪繁殖与呼吸综合征病毒RT-PCR鉴别诊断方法的建立[J]. 中国预防兽医学报,2007(9):704-709.
[7]冷雪. 高致病性猪繁殖与呼吸综合征病毒分离鉴定、遗传变异及致病性分析[D]. 北京:中国农业科学院,2012.
[8]希尼尼根. 猪繁殖与呼吸综合征病毒ORF5核酸疫苗的研究[D]. 成都:四川农业大学,2004.
[9]王凤雪. 高致病性猪繁殖与呼吸综合征病毒非结构蛋白Nsp2对病毒致弱及复制影响的研究[D]. 北京:中国农业科学院,2012.
[10]马平. 猪繁殖与呼吸综合征病毒国内流行毒株的分离、鉴定及其遗传变异分析[D]. 北京:中国农业科学院,2008.
[11] 周磊,杨汉春,姜平,等. 猪繁殖与呼吸综合征综合防控技术与应用[J]. 中国畜牧杂志, 2015,51 6):62-67.
[12]蔡雪辉. PRRSV流行毒株NSP2遗传变异分析及其活疫苗的安全性评价[D]. 长春:吉林大学,2012.
[13]江云波. 猪繁殖与呼吸综合征病毒新型基因工程疫苗研究[D].武汉:华中农业大学,2007.
[14]徐彦召. 高致病性猪繁殖与呼吸综合征病毒致弱毒株NSP2复制非必需区的鉴定及其表达外源基因的研究[D]. 北京:中国农业科学院,2012.
[15]魏津. 高致病性猪繁殖与呼吸综合征活疫苗(JXA1-R株)国家参考品的研制及定值方法的建立[D].北京:中国兽医药品监察所,2013.
[16]周峰. 2012-2013年河南地区猪繁殖与呼吸综合征病毒分子流行病学调查及河南流行株的分离、鉴定[D]. 郑州:河南农业大学,2014.
[17]程群. 猪繁殖与呼吸综合征病毒SHxx13/2013株分离鉴定及致病性分析[D]. 北京:中国农业科学院,2014.
[18] 鲁韦韦. 猪繁殖与呼吸综合征病毒实时荧光RT-PCR检测方法的建立[D]. 南京:南京农业大学,2008.
[19]游一. 规模化猪场猪繁殖与呼吸综合征综合防制措施研究[D]. 郑州:河南农业大学,2010.
[20] 严安. 猪繁殖与呼吸综合征病毒Nsp2基因和ORF5基因变异分析[D]. 北京:中国农业大学,2004.
(责任编辑:朱迪国)
Genetic Analysis on One Wild Strain of Porcine Reproductive and Respiratory Syndrome Virus
Liu Daoquan1,Wu Boping2
(1.Fuzhou Animal Disease Control Center,Fuzhou,Fujian 350003;2. Fujian Provincial Animal Disease Control Center,Fuzhou,Fujian 350003)
Abstract:In order to understand the molecular epidemiological situation of porcine reproductive and respiratory syndrome virus(PRRSV)in Fuzhou city of Fujian province,one virus strain from suspected cases of PRRS was isolated and the ORF3,ORF5 and NSP2 were sequenced. The data showed that the NSP2,ORF3 and ORF5 of this strain shared the nucleotide identity with 94.9%~97.7%,95.2%~97.7% and 96.1%~96.7% respectively,compared with main PRRSV strains in China. Therefore, it was inferred that this strain was evolved from popular variant strains in China.
Key words:PRSSV;genetic analysis;phylogenetic tree
中图分类号:S851.3
文献标识码:A
文章编号:1005-944X(2016)07-0086-04
DOI:10.3969/j.issn.1005-944X.2016.07.026
基金项目:福建省农业科学技术项目(2014-01)
通讯作者:吴波平
