非洲猪瘟病毒RPA等温检测方法的建立
2016-07-25王建昌王金凤刘立兵孙晓霞袁万哲河北出入境检验检疫局技术中心河北石家庄05005河北农业大学动物医学院河北保定0700
王建昌,王金凤,刘立兵,孙晓霞,袁万哲(.河北出入境检验检疫局技术中心,河北石家庄 05005;.河北农业大学动物医学院,河北保定 0700)
非洲猪瘟病毒RPA等温检测方法的建立
王建昌1,王金凤1,刘立兵1,孙晓霞1,袁万哲2
(1.河北出入境检验检疫局技术中心,河北石家庄050051;2.河北农业大学动物医学院,河北保定071001)
摘要:为建立一种简单、快速的非洲猪瘟病毒(ASFV)分子检测方法,基于ASFV P72基因保守序列,设计并合成引物,建立了一种ASFV重组酶聚合酶扩增(RPA)等温检测方法。结果表明,所建立的RPA方法在38℃水浴锅中恒温反应30 min,即可实现对目的片段的有效扩增;以包含ASFV P72基因的ORF质粒为模板,RPA的检测限达到102copies,同世界动物卫生组织(OIE)推荐的实时荧光PCR方法检测限一致,但比OIE推荐方法的检测限高10倍;RPA仅特异性扩增ASFV P72基因,对FMDV、CSFV、PRRSV、PRV和PCV-2基因组cDNA或DNA没有扩增。本研究所建立的RPA方法操作简单、反应快速、检测成本低、结果确实可靠,为非洲猪瘟的一线防控提供了一种新的、可靠的技术支持。
关键词:非洲猪瘟病毒;分子检测;等温扩增;聚合酶重组酶扩增;快速
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪的一种烈性、高度接触性传染病[1]。ASF具有高发病率、高死亡率特点,一旦发生,经济损失巨大。再加上目前对其缺乏有效疫苗和特异性治疗手段,使ASF成为目前危害养猪业的最严重疫病之一。ASFV是非洲猪瘟病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)唯一成员,也是目前已知唯一的DNA虫媒病毒[1]。ASFV基因组为线性dsDNA分子,大小为170~193 kb,编码蛋白在151~167个之间[2]。通过对病毒VP72基因C末端测序,将目前分离的ASFV分为22个基因型[3]。
目前对ASF的控制只能依赖于快速的实验室诊断、对发病动物的捕杀,以及采取有效的检疫措施和严格的卫生措施。ASFV的快速检测对于控制ASF,防止其造成巨大经济损失,具有极其重要的意义。随着分子诊断技术的发展,目前已经建立了多种具有不同特异性和敏感性的ASFV检测方法,如PCR[4]、real-time PCR[5]、LAMP[6]等。但上述方法或者需要昂贵的仪器设备、技术娴熟的技术人员,比较费时,或者需要复杂的引物和探针设计,反应试剂需要冷链运输和保存,从而不能有效应用于野外现场检测。
重组酶聚合酶扩增(RPA)是一种等温基因扩增技术[7]。重组酶结合引物形成蛋白-DNA混合物并启动寻找模板DNA上的同源序列。同源序列定位后,则会引发链置换反应。引物结合到对应模板上,聚合酶进而从引物3 末端开始启动DNA合成。同PCR一样,两条引物可以启动对靶基因的几何级数扩增。RPA反应体系中,对引物和探针碱基突变具有较强的耐受性。目前表明在引物9个碱基突变后,RPA反应依然可以顺利进行[8]。目前RPA已经在一系列病原微生物的分子检测中得到应用,如结核分枝杆菌[9]、口蹄疫病毒[10]、犬细小病毒[11]等。但是未见RPA技术在ASFV检测中的应用。
目前ASF在俄罗斯持续存在和蔓延,在非洲国家也不断发生。随着中非贸易以及联系的进一步加强,非洲猪瘟传入我国的风险将进一步增加。因此,建立一种简便、快速、有效的ASFV RPA检测方法,对于我国ASF的监控具有重要意义。
1 材料与方法
1.1主要试剂与设备
1.1.1主要试剂。TwistAmpTMDNA amplification kit,购自英国TwistDx公司;病毒DNA提取试剂盒、DNA 纯化回收试剂盒、2 Taq PCR MasterMix,均购自天根生化科技(北京)有限公司;质粒DNA小量抽提试剂盒,购自生工生物工程(上海)股份有限公司;PrimeScriptⅡ1st strand cDNA Synthesis Kit、Premix Ex Taq,均购自Takara公司。1.1.2 主要设备。T-Gradient梯度PCR仪(MCO-18AIC),德国Biometra公司生产;实时荧光定量PCR仪(ABI 7500),美国ABI公司生产;核酸蛋白分析仪(BioPhotometer Plus),德国Eppendorf公司生产;核酸电泳仪(PowerPac Basic),美国Bio-rad公司生产;凝胶成像系统(Fusion Fx7),法国VIBER LOURMAT公司生产。
1.2病毒株与临床样品
PRRSV cDNA和PRV、PCV-2 基因组DNA由本实验室保存; CSFV 基因组RNA提取自瑞普商品化兔脾淋活疫苗;O型FMDV基因组RNA提取自兰州兽医研究所商品化试剂盒抗原。20份临床样品包括全血、淋巴结、脾、肺均来自河北不同地区养猪场。
1.3病毒RNA反转录及临床样品病毒DNA提取
按照Takara first strand cDNA合成试剂盒使用说明,将CSFV、FMDV基因组RNA反转录为cDNA,并测定其浓度;按照天根病毒DNA提取试剂盒使用说明,提取临床样品病毒DNA。所有病毒DNA和cDNA模板保存于-20℃备用。
1.4ASFV P72基因重组质粒的合成及拷贝数确定
根据Genbank中ASFV(AY578706)参考序列,确定P72基因(1 941 bp)序列信息,由上海生工合成并克隆至pUC57载体,命名为pUC57-P72。将pUC57-P72质粒转化至感受态细胞DH5α,过夜培养后提取质粒并测定浓度。使用OIE推荐的PCR和实时荧光PCR方法[12]对合成质粒进行鉴定,同时送上海生工进行测序。
根据下列公式,计算重组质粒pUC57-P72拷贝数:拷贝数(copies/μL)=6.02 1023质粒浓度(ng/μL) 10-9/(质粒碱基数 660)。
1.5引物设计
参 考GenBank中ASFV P72基 因 序 列(AY578706),选择特异性保守区域,设计RPA引物,目的片段大小为220 bp。同时合成OIE推荐PCR和实时荧光PCR方法使用的引物和探针。所有引物和探针均由上海生工合成(表1)。
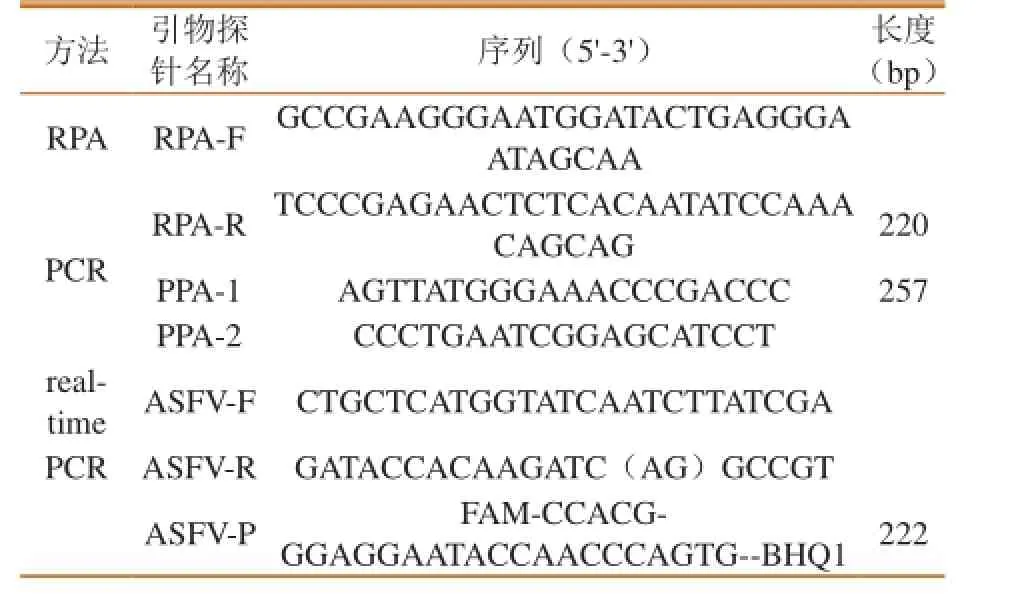
表1 引物和探针序列
1.6RPA反应体系及程序
使用TwistAmp Basic kit配制50 μL RPA反应体系,其中RPA-F和RPA-R(均10 μM)各2.4 μL,Rehydration Buffer 29.5 μL,ddH2O 12.2 μL,模板1 μL,280 mM MgAc 2.5 μL。将模板和MgAc之外的所有试剂预混后转入含有冻干酶制剂的0.2 mL反应管中,并充分混匀。将1 μL 模板加入反应管中,并将2.5 μL MgAc加在反应管盖中,盖紧后瞬时离心并涡旋后,放入38 ℃水浴锅中反应10 min、20 min、30 min和40 min。
使用天根DNA纯化试剂盒对RPA产物进行纯化,取5μL产物进行2%琼脂糖凝胶电泳,并在紫外灯下观察电泳结果。
1.7PCR和实时荧光PCR反应体系及程序
反应体系和程序均按照OIE推荐方法进行。实时荧光PCR探针的淬灭基团由BHQ1替代TAMRA;PCR和实时荧光PCR反应体系中PCR buffer、DNA聚合酶和dNTPs,分别使用天根公司的2 Taq PCR MasterMix和Takara公 司 的Premix Ex Taq代替。
1.8特异性和敏感性试验
以FMDV、CSFV、PRRSV的cDNA,PRV、PCV-2的DNA,以及pUC57-P72为模板,进行RPA反应,确定是否出现特异性扩增条带。将重组质粒pUC57-P72进行10倍倍比稀释,使其浓度在106~100copies/μL之间,并将其作为模板进行RPA反应,确定该方法的最低检测浓度。同时比较与OIE推荐PCR、实时荧光PCR方法的敏感性。
1.9RPA方法的应用
以提取的20份临床样品病毒DNA为模板,应用建立的RPA方法进行ASFV检测。
2. 结果
2.1质粒的鉴定及拷贝数计算
对合成的质粒进行PCR鉴定,结果出现一条特异性条带,大小约257 bp;进行real-time PCR鉴定,结果出现一条特异性扩增曲线;测序结果表明序列同AY578706同源性为100%。
提取重组质粒pUC57-P72的浓度为89 ng/ μL,碱基数为4 651 bp,经计算得知提取质粒的拷贝数为1.7 1010copies/μL。经系列倍比稀释,使pUC57-P72拷贝数在106~100copies/μL之间。
2.2RPA反应时间的优化
为 确 定RPA反 应 时 间 ,以 105copies pUC57-P72为模板进行RPA扩增,并进行产物分析。结果发现,38℃下RPA反应时间为20 min时,电泳即可获得一条大小为220 bp、清晰的特异性条带。对RPA产物条带进行半定量分析,RPA反应30 min后条带约为20 min时条带的6倍,而与反应40 min后的条带没有显著差异(图1)。因此本研究的ASFV RPA最佳反应时间确定为30 min。
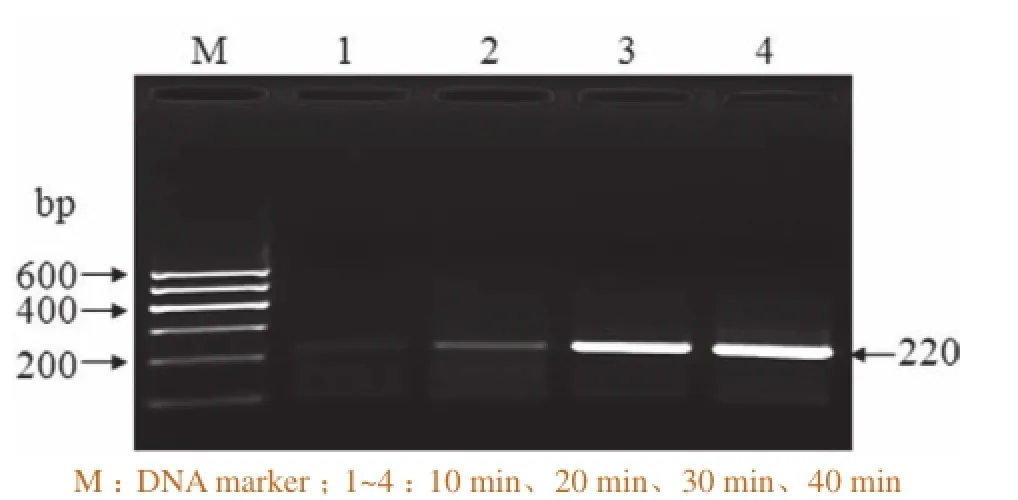
图1 ASFV RPA检测时间优化结果
2.3特异性试验
以FMDV、CSFV、PRRSV的cDNA,PRV、PCV-2的DNA,以及pUC57-P72为模板,进行ASFV RPA检测,结果只有pUC57-P72出现特异性扩增条带,说明该方法具有良好的特异性(图2)。
2.4敏感性试验
使用106~100copies系列浓度的pUC57-P72,进行RPA的敏感性试验,并与OIE推荐方法比较。结果发现,RPA最低可以检测到2 102copies质粒(图3-A),同OIE推荐的real-time PCR方法一致(图3-C),而PCR最低仅检测到2 103copies质粒(图3-B)。
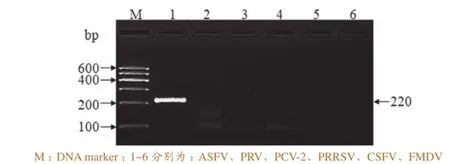
图2 ASFV RPA检测方法的特异性试验结果
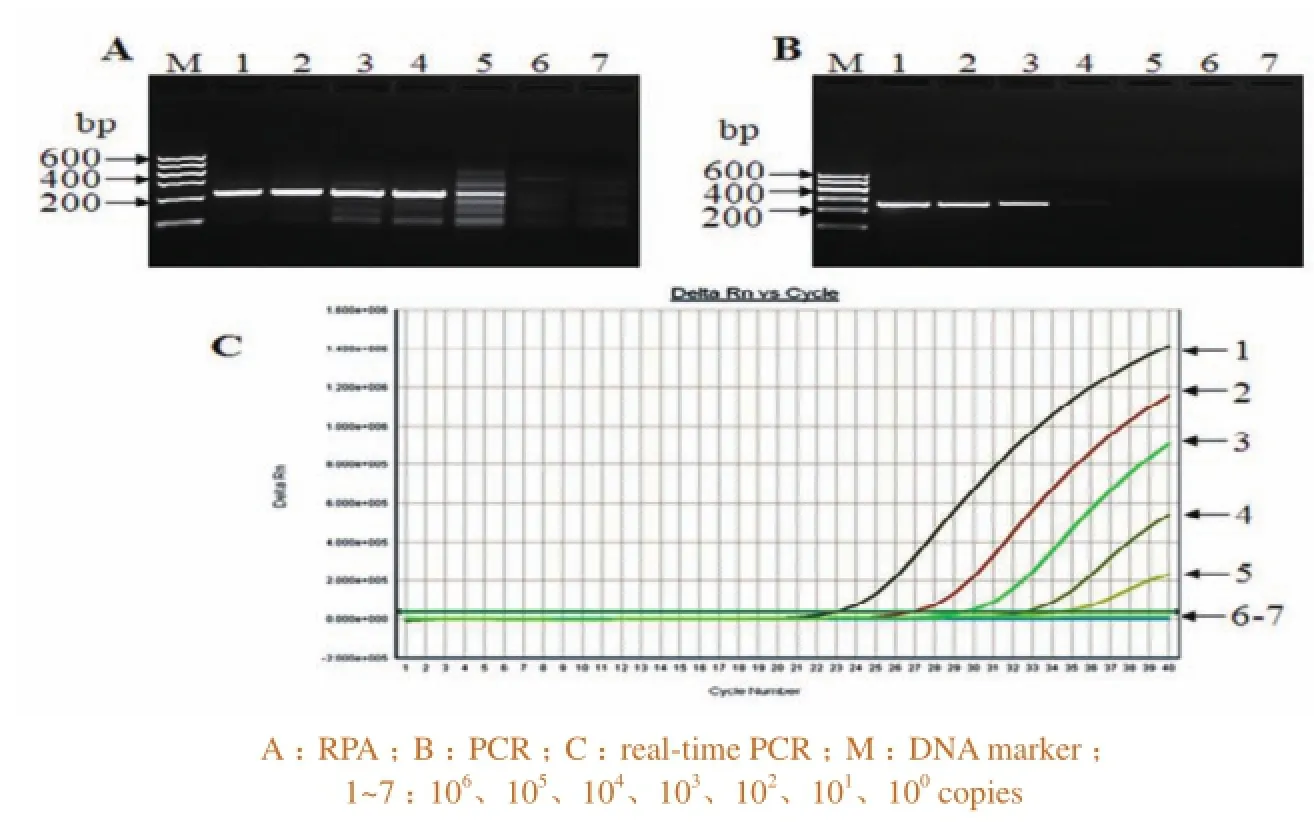
图3 ASFV 不同检测方法的敏感性试验结果
2.5临床样品的检测
对保存的20份样品通过本研究建立的RPA方法,以及OIE推荐的PCR和real-time PCR进行ASFV检测,结果所有样品均为阴性。
3 讨论
本研究首次报道了一种新的用于ASFV检测的RPA等温检测方法。目前RPA方法已经广泛应用于多种病原微生物的实验室或现场检测[10-11]。同PCR方法相比,RPA具有以下优势:第一,试剂使用方便,易于保存。RPA核心试剂以冻干颗粒形式保存,从而避免了冷藏保存和冷链运输。第二,RPA反应时间短。RPA一般少于30 min,而PCR反应时间一般需要60 min以上。第三,等温扩增。RPA属于等温扩增技术,对仪器设备要求低,一台水浴锅即可完成反应,不需要昂贵的仪器设备。这些特点使得本研究建立的RPA方法可以用于现场ASFV快速检测和诊断。
本研究人工合成ASFV P72基因全长序列并构建克隆载体pUC57-P72,以此作为试验的阳性模板。由图1可以看出,RPA反应10 min后,电泳即可得到特异性目的条带。反应时间延长至20 min后,RPA产物量增加1倍。RPA反应30 min和40 min后,产物量约为20 min产物量的6倍,但是两者之间没有明显差异。这是因为反应30 min后,反应体系中的能量已消耗完,重组酶和聚合酶活性降低或失活。特异性试验表明,所建立的ASFV RPA仅能特异性扩增pUC57-P72,而对其他常见重要猪病病毒核酸没有任何扩增。敏感性试验表明,RPA的敏感性同OIE推荐的real-time PCR一致,最低检测浓度均为102copies,比OIE推荐PCR敏感性高出10倍。三种方法对临床实际样品的检测结果一致,均为ASFV阴性。这和我国不存在ASF的事实一致。
本研究建立的用于检测ASFV的RPA等温检测方法特异性强、灵敏度高、操作简单、反应快速,对仪器设备要求低,结果确实可靠,为我国非洲猪瘟的一线监控提供了有效的技术支持。
参考文献:
[1] Fauquet C M,Mayo M A,Maniloff J,et al. In:Virus Taxonomy:VIIIth Report of the ICTV[M]. London:Elsevier/ Academic Press,2005:301-326.
[2] Villiers E P D,Carmina G,Marisa A,et al. Phylogenomic analysis of 11 complete African swine fever virus genome sequences[J]. Virology,2010,400(1):128-36.
[3] Chapman D A G,Vasily T,Chris U,et al. Comparison of the genome sequences of non-pathogenic and pathogenic African swine fever virus isolates[J]. Journal of General Virology,2008, 89(Pt 2):397-408.
[4] Aguero M,Fernandez J L,Sanchez M C,et al. Highly Sensitive PCR Assay for Routine Diagnosis of African Swine Fever Virus in Clinical Samples[J]. Journal of Clinical Microbiology, 2003,41(9):4431-4434.
[5] King D P,Reid S M,Hutchings G H,et al. Development of a TaqMan PCR assay with internal amplification control for the detection of African swine fever virus[J]. Journal of Virological Methods,2003,107(1):53-61.
[6] James H E,Ebert K,Mcgonigle R,et al. Detection of African swine fever virus by loop-mediated isothermal amplification[J]. Journal of Virological Methods,2009,164 (1/2)):68-74.
[7] Piepenburg O,Williams C H,Stemple D L,et al. DNA Detection Using Recombination Proteins[J]. Plos Biology,2006,4(7):e204.
[8] Boyle D S,Lehman D A,Lorraine L,et al. Rapid detection of HIV-1 proviral DNA for early infant diagnosis using recombinase polymerase amplification[J]. mBio,2012,4(2):49-52.
[9] Boyle D S,Mcnerney R,Teng L H,et al. Rapid detection of Mycobacterium tuberculosis by recombinase polymerase amplification[J]. Plos One,2014,9(8):e103091-e103091.
[10] Abd E W A,El-Deeb A,El-Tholoth M,et al. A portable reverse transcription recombinase polymerase amplification assay for rapid detection of foot-and-mouth disease virus[J]. Plos One, 2013,8(8):1-10.
[11] Wang J C,Liu L B,Li R W,et al. Rapid and sensitive detection of canine parvovirus type 2 by recombinase polymerase amplification [J]. Archives of Virology,2016,161 (4):1015-1018.
(责任编辑:朱迪国)
Rapid and Sensitive Detection of African Swine Fever Virus by Recombinase Polymerase Amplification
Wang Jianchang1,Wang Jinfeng1,Liu Libing1,Sun Xiaoxia1,Yuan Wanzhe2
(1.Technical Center of Hebei Entry-Exit Inspection and Quarantine Bureau,Shijiazhuang, Hebei 050051;2.College of Veterinary Medicine,Agricultural University of Hebei, Baoding,Hebei 071001)
Abstract:To develop an convenient and rapid molecular diagnostic method for the African swine fever virus(ASFV),the recombinase polymerase amplification(RPA)was developed using primers specific for the conserved region of the ASFV P72 gene. The RPA reaction was performed successfully at 38℃ for 30 min in a water bath. By using recombinant plasmid DNA carrying the P72 gene as template.The results showed that the detection limit of RPA was 102copies of plasmid DNA,which was the same as the real-time PCR recommended by OIE,and it was 10 times more sensitive than it. RPA could not amplify templates of FMDV,CSFV,PRRSV,PRV or PCV-2,demonstrating high specificity.The ASFV RPA developed in the study is simple,rapid,cost-effective and reliable,which can be an novel and reliable tool for the control of ASF.
Key words:African swine fever virus;molecular diagnosis;isothermal amplification;recombinase polymerase amplification;rapid
中图分类号:S852.65.9.1
文献标识码:A
文章编号:1005-944X(2016)07-0078-05
DOI:10.3969/j.issn.1005-944X.2016.07.024
通讯作者:袁万哲
