ATO增强As2S2抗小鼠Lewis肺癌效应的初步研究
2016-07-24顾亚琴杨召聪钱知知张良
顾亚琴,杨召聪,钱知知,张良Δ
(1.南京中医药大学 药学院,江苏 南京 210023;2.江苏省药效与安全性评价重点实验室,江苏 南京 210023)
ATO增强As2S2抗小鼠Lewis肺癌效应的初步研究
顾亚琴1,杨召聪2,钱知知2,张良1Δ
(1.南京中医药大学 药学院,江苏 南京 210023;2.江苏省药效与安全性评价重点实验室,江苏 南京 210023)
目的 观察三氧化二砷(ATO)对硫化砷(As2S2)抗肿瘤效应的影响。方法 选取4、2、0.5μM ATO,分别与不同浓度As2S2合用,MTT法观察不同浓度ATO对Lewis肺癌细胞的增殖抑制作用;以荷Lewis肺癌小鼠为模型,随机分为模型组,顺铂组[5 mg/(kg·d),ip],ATO组[1 mg/(kg·d),ip],As2S2高、中、低剂量组[8、2、0.4 g/(kg·d),ig],As2S2高、中、低剂量+ATO组,连续给药2周。观察小鼠体质量、肿瘤抑制率、胸腺及脾指数、脾组织CD4+/CD8+T细胞比值;RT-PCR法检测脾组织中穿孔素(Perforin)、颗粒酶B(Granzyme B)mRNA含量。结果 4μM ATO可显著增强As2S2对Lewis细胞的增殖抑制作用(P<0.05);As2S2中剂量+ATO组的抑瘤率显著高于As2S2单独给药组(P<0.05);与As2S2单独给药组相比,As2S2中剂量+ATO组小鼠脾组织中CD8+T细胞数及CD4+/CD8+比值均显著增高(P<0.05); As2S2中剂量+ATO组小鼠脾组织中Granzyme B mRNA表达显著高于模型组(P<0.05)。结论 ATO可显著增强As2S2对Lewis肺癌细胞的增殖抑制作用,可能是通过增强机体免疫反应发挥增效作用。
硫化砷;三氧化二砷;抗肿瘤增效;Lewis肺癌;T细胞免疫
雄黄为硫化物类矿物药[1-2],主要成分为硫化砷(As2S2),同时含有少量的三氧化二砷(ATO)。入药始载于《神农本草经》,在我国临床应用已有两千多年历史。雄黄在治疗多种肿瘤中显示出独特的疗效[3],并且随着对其抗肿瘤机制的深入研究,发现雄黄具有发展为新型抗癌药物的潜力,而如何使其进一步应用于临床成为研究者们非常关注的问题。其所含少量的ATO为可溶性成分,毒性较大,但同时抗肿瘤作用明确,究竟应将ATO作为有害物质完全去除,还是应制定限量标准予以保留,目前尚无定论。研究报道[4-5],低剂量ATO能在不影响放、化疗肿瘤治疗效果的同时降低其对正常组织的毒副作用。因此,本实验以低剂量ATO为切入点,初步观察ATO对雄黄抗肿瘤药效的影响,为进一步认识传统中药雄黄提供实验基础。
1 材料与方法
1.1 材料
1.1.1 细胞与动物:Lewis肺癌细胞由南京中医药大学陆茵教授馈赠;C57BL/6雄性小鼠,SPF级,6~8周龄,18~22 g,80只,由上海杰思捷实验动物有限公司提供[生产许可证号:SCXK(沪)2013-0006]。
1.1.2 药品:As2S2由南京中医药大学江苏省中药炮制重点实验室国家教育部中药炮制规范化及标准化工程研究中心李伟东老师提供并鉴定,As2S2含量>98%,符合药典规定;注射用ATO(北京双鹭药业股份有限公司,批号:20131002);注射用顺铂(DDP,齐鲁制药有限公司,批号:2WA2A1402009B)。
1.1.3 试剂:DMEM培养(HyClone,批号:NZM1303);胰蛋白酶(Gibco,批号:1627654);胎牛血清(Foundation TM,A46E00F);二甲基亚砜(Sigma);PBS(博士德生物工程有限公司,10B16B30);四甲基偶氮唑蓝干粉(MTT,Sigma);Anti-Mouse CD8 FITC、Anti-Mouse CD4 PE抗体均购自美国eBioscience公司。
1.1.4 仪器:Synergy HT型酶标仪(Bio-Tek,USA);BH2型生物显微镜(日本Olympus);Accuri C6流式细胞仪(BD,USA);游标卡尺(上海量具刃具有限公司);凝胶成像系统(美国BIO-Rad公司);精密分析天平(Sartorius公司);FA1104N电子天平(上海精密科学仪器有限公司);荧光定量PCR(罗氏公司 Lishtcycler96);TSZ5-WS型离心机(上海卢湘仪器有限公司);Allegra X-15R冷冻离心机(Beckman Coulter公司)。
1.2 方法
1.2.1 细胞培养:Lewis肺癌细胞培养于DMEM完全培养基(含10%的胎牛血清),37 ℃、5%CO2培养箱中,细胞呈贴壁状态,每1~2天以0.25%的胰蛋白酶消化后,传代,细胞贴壁3~4代,取指数生长期细胞进行实验。
1.2.2 MTT法检测ATO对Lewis肺癌细胞增殖影响:将5×104个/mL的对数生长期Lewis细胞接种于96孔板,每孔200 μL,次日分为空白对照孔,终浓度为(0,0.1,0.5,1,2,4,8,10) μM的ATO给药组,每组设6个平行孔。继续培养24 h后,MTT法检测(自动酶标仪490 nm波长检测各孔吸光度A值),计算细胞存活率及增殖抑制率,初步摸索并确定对Lewis细胞无影响的ATO剂量上限值。细胞存活率=给药组A值/空白对照组A值×100%。
1.2.3 MTT法观察ATO对As2S2的体外抗肿瘤效应影响:将5×104个/mL的对数生长期Lewis细胞接种于96孔板,每孔200 μL,次日分为空白对照孔,终浓度为(2,4,8,16,32,64,128)μg/mL的As2S2给药组以及各浓度As2S2分别与ATO(0.5,2,4)μM联合给药组,每组设6个平行孔。继续培养24 h后,MTT法检测(自动酶标仪490 nm波长检测各孔吸光度A值)。增殖抑制率=(1-给药组A值/空白对照组A值)×100%。
1.2.4 模型小鼠的建立、分组及给药:C57BL/6小鼠,80只,除正常对照组,其余每鼠接种0.2 mL Lewis肺癌细胞悬液(106/mL)于右腋窝皮下24 h后[6-7],随机分为模型组、DDP组(阳性药)、ATO组、As2S2(高、中、低)组、As2S2高、中、低剂量与ATO联合给药组,每组8只,顺铂组腹腔注射5 mg/(kg·d); ATO组腹腔注射1 mg/(kg·d); As2S2给药组按照(8、2、0.4)g/(kg·d)灌胃给药;As2S2与ATO联合给药组同时灌胃As2S2[8、2、0.4 g/(kg·d)]及腹腔注射ATO[1 mg/(kg·d)],正常对照组和模型组给予等体积0.9%NaCl,皆连续给药2周。
1.2.5 各给药组对荷Lewis小鼠体质量、瘤体及免疫器官的影响:给药期间,隔天记录小鼠体质量;末次给药1 h后,处死动物,剥取瘤块,脾脏,胸腺,分别称重,计算抑瘤率(IR)、脾指数、胸腺指数。抑瘤率(%)=[1-实验组瘤重(g)/模型组平均瘤重(g)]×100%;脏器指数(mg/g)=脏器重量/动物体质量×1000。
1.2.6 T细胞检测:每组随机取3只小鼠,处死置于75%乙醇中浸泡3~5 min;无菌条件下制备小鼠脾淋巴细胞单细胞悬液;根据细胞计数结果染抗体:FITC-CD8,PE-CD4,4 ℃避光30 min;每孔加200 μL staining buffer洗,4 ℃、1500 r/min、离心 5 min, 吸去上清,重复2次;孔里最终剩余的细胞转移至流式管,以500 μL 1%的多聚甲醛固定,放在暗处,2 ℃~8 ℃在24 h内检测。
1.2.7 小鼠脾脏组织中Perforin、Granzyme B mRNA含量检测:选取模型组、ATO(0.001 g/kg)组、As2S2中剂量组(2.00 g/kg)、As2S2+ATO中剂量组(2.00 g/kg+0.001 g/kg),每组随机取3只小鼠脾组织,提取组织RNA,经质量鉴定后,进行逆转录及Real-time PCR反应。参照说明书设定PCR程序:65 ℃ 5 min变性,65 ℃ 30 s,50 ℃ 30 s,40个循环。反应结束仪器自动生成CT值(threshold cycles)。每个样本设3个重复管,以2-△△Ct(Ct值代表循环阈值)表示基因的表达量。β-actin的双向引物序列为:F:5’ GTACCACCATGTACCCAGGC3’,R:5’ AACGCAGCTCAGTAACAGTCC3’;Prf1的双向引物序列:F:5’ TCCTATGGCACGCACTTTATC 3’,R:5’ TCAGGCAGTCTCCTACCTCATC3’;Gzmb的双向引物序列:F:5’ TGCTCTGATTACCCATCGTCC3’,R:5’ AGCCAGTCTTTGCAGTCCTTTA3’。

2 结果
2.1 ATO对As2S2抗Lewis肺癌细胞作用的影响
2.1.1 ATO对Lewis细胞的增殖抑制作用:MTT实验结果显示,ATO在10 μM时,可显著抑制Lewis细胞的增殖(P<0.05),在低于8 μM时,Lewis细胞活性大于95%,肿瘤抑制作用较低。见表1。

表1 不同浓度ATO对Lewis细胞的增殖抑制作用
*P<0.05,**P<0.01,与空白组比较,compared with blank group
2.1.2 ATO增加As2S2对Lewis肺癌细胞的增殖抑制作用:0.5、2、4 μM ATO分别与As2S2合用后,仅4 μM ATO与As2S2合用时,Lewis细胞活性显著低于As2S2单独用药各剂量组(P<0.05,P<0.01);4 μM ATO时,As2S2的IC50值(19.4±6.9 μM)显著低于As2S2单独给药组(33.8±7.1)μM(P<0.05,n=3),提示在4 μM浓度下,ATO在体外可显著增加As2S2的抗肿瘤作用。见图1。
2.2 ATO对As2S2抗Lewis体内移植瘤效应的影响
2.2.1 各给药组对荷瘤小鼠体质量的影响:与模型组相比:自给药后第8 d,DDP组小鼠体质量显著性下降(P<0.05,P<0.01);As2S2高剂量组小鼠自给药后12 d起,体质量显著下降(P<0.05);As2S2中剂量组及As2S2高剂量+ATO联合给药组小鼠体质量在给药中途即分别8~12 d、4~8 d时有显著下降(P<0.05),以上差异均具有统计学意义,而后期体质量均恢复至与模型组差异无统计学意义。见表2。

图1 不同浓度As2S2与ATO联合用药后对Lewis细胞的增殖抑制作用*P<0.05,**P<0.01,与As2S2组比较Fig.1 The inhibition effect of different concentrations of As2S2 combined with ATO on Lewis cell proliferation (±s,n=6)*P<0.05,**P<0.01, compared with the As2S2 group

组别只数剂量(mg/kg)给药前给药后4d给药后8d给药后12d实验末模型组8 —19.7±0.921.1±1.121.9±1.122.5±1.522.7±2.3DDP组8 5.020.3±1.121.4±1.617.9±3.1*15.8±1.3**16.4±2.1**ATO组8 1.019.1±1.021.9±1.021.4±1.322.2±1.422.0±1.3As2S2高剂量组88000.019.5±1.221.0±1.021.5±3.121.1±1.0*20.7±1.5*As2S2高剂量+ATO组88000.0+1.019.8±1.120.4±1.320.0±1.7*20.4±1.5*21.4±1.0As2S2中剂量组82000.019.7±1.319.7±0.5*19.9±0.7*21.31±1.121.3±1.5As2S2中剂量+ATO组82000.0+1.019.9±1.0720.4±1.621.0±1.721.1±5.821.3±2.8As2S2低剂量组8400.020.2±0.821.0±1.621.0±1.221.6±1.121.5±1.1As2S2低剂量+ATO组8400.0+1.019.5±1.021.2±2.021.5±1.522.1±1.322.0±1.3
*P<0.05,**P<0.01,与模型组比较,compared with model group
2.2.2 各给药组对荷瘤小鼠肉瘤的影响:除ATO及As2S2低剂量组,其余各给药组瘤重均低于模型组(P<0.05);联合给药组中,As2S2中剂量+ATO组抑瘤率显著高于相同剂量时As2S2单独给药组(P<0.05)。见表3。
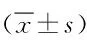
表3 各组荷瘤小鼠瘤重及抑瘤率比较Tab.3 Comparison of the tumor weight and inhibition rate in each group of mice(±s)
*P<0.05,**P<0.01,与模型组比较,compared with model group;#P<0.05,与同剂量As2S2单独给药组比较,compared with As2S2administered alone group of the same dose
2.2.3 各给药组对荷瘤小鼠免疫器官的影响:与模型组比较,DDP与As2S2高剂量组荷瘤小鼠脾指数均降低(P<0.05),其余各组未见显著差异;As2S2+ATO联合给药各剂量组脾脏指数均高于相同剂量下As2S2单独给药组;DDP组胸腺指数低于模型组(P<0.05),其余各给药组未见显著差异。见表4。
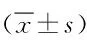
表4 各给药组对荷瘤小鼠脾脏及胸腺指数的影响Tab.4 Changes of the indexes of spleen and thymus of each group mice(±s)
*P<0.05,**P<0.01,与模型组比较,compared with model group;#P<0.05,与同剂量As2S2单独给药组比较,compared with As2S2administered alone group of the same dose
2.2.4 各给药组对荷瘤小鼠脾脏中CD4+/CD8+T细胞的影响:流式结果显示,与模型组比较,DDP显著提高荷瘤小鼠脾脏中CD8+T细胞比例;As2S2中剂量组小鼠脾组织中CD8+及CD4+T细胞表达均低于模型组;As2S2中剂量+ATO组小鼠脾组织中CD8+及CD4+T细胞表达均显著高于相同剂量下As2S2单独给药组;DDP组小鼠脾组织中CD4+/CD8+比值显著低于模型组,而ATO+As2S2联合给药中剂量组中CD4+/CD8+比值显著高于相同剂量的As2S2单独给药组及模型组(P<0.05)。见表5、图2。
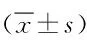
表5 不同给药组对荷瘤小鼠脾脏CD4+/CD8+T细胞的影响Tab.5 Effect of different administration group on mice spleen CD4+/CD8+T cells(±s)
*P<0.05,**P<0.01,与模型组比较,compared with model group;#P<0.05,与同剂量As2S2单独给药组比较,compared with As2S2administered alone group of the same dose
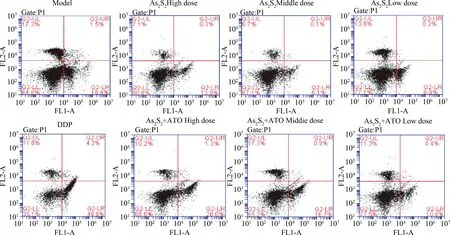
图2 不同给药组对荷Lewis肺癌小鼠脾脏CD4+/CD8+T细胞的影响Fig.2 Effects of different administration group on mice spleen CD4+/CD8+T cells
2.2.5 不同给药组对荷瘤小鼠脾脏中Perforin、Granzyme B mRNA表达的影响:RT-PCR结果显示ATO+As2S2联合给药后小鼠脾组织中Granzyme B mRNA水平显著增加(P<0.01)。见表6。
表6 各给药组对荷瘤小鼠脾脏中T淋巴效应分子Perforin、Granzyme B mRNA表达的影响
**P<0.01,与模型组比较,compared with model group
3 讨论
寻找高效低毒的抗癌药物以及抗癌辅助药物是肿瘤研究的重要内容。中药雄黄(As2S2)为传统中药砷剂的一种,研究显示[8-10]其具有拮抗急性早幼粒细胞白血病、多发性骨髓瘤、肝癌、乳腺癌、宫颈癌、胶质瘤等多种血液和实体肿瘤的效应。
雄黄所含的少量可溶性成分ATO抗肿瘤药效明确。有学者通过实验推测[11]:雄黄中As2S2既不被人体吸收,也无任何药理活性,认为可溶性As是雄黄的活性成分;又有实验报道[12]As2S2为难溶性组分,在体内难以吸收,应是雄黄中可溶性组分ATO在发挥药物效应。且早在上世纪70年代,张亭栋等[13]就采用现代科学的给药方式,以ATO为主要成分制成“癌灵”注射液,治疗APL;上海血研所研究报道了ATO诱导APL细胞凋亡和部分分化的重要机制;2000年美国食品药品监督管理局(FDA)批准ATO注射液作为复发性APL治疗药物。
雄黄所含的少量可溶性成分ATO毒性较大。高双荣等[14]通过文献整理分析,归纳汇总认为砷在体内主要以无机砷和有机砷等不同形态存在,且形态不同毒性不同,一般认为三价砷As(Ⅲ)毒性最大,可引起肝细胞的凋亡和灶状坏死,在体内长期蓄积可对肝脏、肾脏、膀胱、神经系统、皮肤、胎儿发育等造成不同程度的毒性损伤;而有机砷毒性较小。顾晶晶等[15]通过比较雄黄中可溶性As与小鼠急性毒性的关系发现:雄黄的毒性存在于其可溶性部分,LD50值与可溶性As呈负相关。国内大多学者[15-17],主张从炮制学的角度去除雄黄中所含ATO。但在炮制学的角度去除ATO的同时,雄黄抗肿瘤药效及在治疗剂量内的毒性如何变化?
本实验首先通过MTT结果显示:低剂量的ATO(<8 μM)处理24 h后,Lewis肺癌细胞活性大于85%,ATO对Lewis细胞活性影响较低。0.5、2、4 μM ATO分别与As2S2联合用药后,发现在与4 μM ATO联合给药时,Lewis细胞活性显著低于As2S2单独作用各剂量(P<0.05,P<0.01)。因此,初步认为4 μM ATO可增强As2S2对Lewis肺癌细胞的增殖抑制作用。有研究报道[4-5],低剂量的ATO(100 nM),可通过调节正常组织发生代谢转换,进行糖酵解,从而抵抗化疗药物的毒性作用。同时体内实验发现[10],低剂量的ATO(0.4 mg/kg),在作用12个月后,并没有产生致癌毒性。这些研究为ATO这种毒性组分的临床应用又提供了一个新的视角。
体内抑瘤实验结果显示:ATO联合给药后,可减轻As2S2高剂量给药时对荷瘤小鼠的体质量减轻作用;ATO联合给药后,可增强As2S2中剂量给药时对荷瘤小鼠的抑瘤率(P<0.05)。免疫系统的检测结果显示:ATO联合给药后,可增加As2S2高、中、低剂量给药时荷瘤小鼠的脾脏指数(P<0.05),但对胸腺指数无显著影响;ATO联合给药后,显著增加As2S2低剂量给药时小鼠脾脏CD4+/CD8+比值(P<0.05),可见其可能是通过增强荷瘤小鼠机体免疫功能而发挥抗肿瘤增效作用。穿孔素及颗粒酶B均为细胞毒性T细胞的效应分子,穿孔素可在靶细胞细胞膜上形成不同直径的小孔,使大分子物质流出而小分子如水分子、离子等物质进入靶细胞,诱导靶细胞渗透性坏死,而同时,颗粒酶B在穿孔素的条件下,入核,启动细胞凋亡程序。本实验RT-PCR结果也表明,联合给药后,脾组织中颗粒酶B mRNA表达显著性增高(P<0.05),进一步提示:联合给药增效的可能机制为免疫增强作用。
综上,低剂量ATO可增加As2S2的抗Lewis肺癌作用,其抗肿瘤增效作用可能与增强荷瘤小鼠机体免疫功能相关,但两者的联合抗肿瘤效应及其具体机制还需进一步研究。因此,在传统中药雄黄的炮制过程中,可考虑限量保留ATO,但具体的剂量范围还需要进一步的研究探讨,以更好地推进中药雄黄应用于临床。
[1] 陈朋,李红玉.雄黄的临床应用与炮制方法研究进展[J].中华中医药学刊,2014,32(7):1663-1666.
[2] 中华人民共和国药典[S].北京:中国医药科技出版社,2010:316.
[3] 张春敏,孟双荣,齐元富,等.雄黄抗肿瘤作用机制研究进展[J].山东中医杂志,2010,29(8):579-581.
[4] Baj G,Arnulfo A,Deaglio S,et al.Arsenic trioxide and breast cancer:analysis of the apoptotic,differentiative and immunomodulatory effects[J]. Breast Cancer Res Treat,2002,73(1):61-73.
[5] Thomas-Schoemann A,Batteux F,Mongaret C,et al.Arsenic trioxide exerts antitumor activity cancer[J].J Immunol,2012,189(11):5171-5177.
[6] 刘自军,马茜. 贺兰山紫蘑多糖联合5-Fu对H22荷瘤小鼠体内抗氧化酶系统的影响[J].宁夏医学杂志,2015,37(3):193-196.
[7] 于明薇,孙桂芝,张培彤,等.不同类型活血药及其与益气药配伍对小鼠Lewis肺癌生长转移的干预作用[J].北京中医药,2011(11):859-862.
[8] Zheng X,Rumie Vittar NB,Gai X,et al.The transcription factor GLI1 mediates TGF-β1 driven EMT in hepatocellular carcinoma via a SNAI1-dependent mechanism[J].Plos One,2012,7(11):e49581-e49581.
[9] Han JB,Sang F,Chang JJ,et al.Arsenic trioxide inhibits viability of pancreatic cancer stem cells in culture and in a xenograft model via binding to SHH-Gli[J].OncoTargets & Therapy,2013,6(8):1129-1138.
[10] Yuan ZM,Ganapathy S,Xiao S,et al.Low-dose arsenic induces chemotherapy protection via p53/NF-κB-mediated metabolic regulation[J].Oncogene,2013,33(11):1359-1366.
[11] 王晓波,袭荣刚,张治然,等.纳米级雄黄粉体药代动力学研究[J].解放军药学学报, 2002, 18(6): 324.
[12] 梁国刚,张启伟. 朱砂、雄黄中各成分的溶解度对其药效、毒副作用的影响[J].中国中药杂志, 2002, 27(5): 392.
[13] 张亭栋,张鹏飞,王守仁,等.“癌灵注射液”治疗6例白血病初步临床观察[J].黑龙江医学,1973 (3):66-67
[14] 高双荣,梁爱华,易艳,等.雄黄中砷的不同形态及其毒性研究进展[J].中国实验方剂学杂志, 2011, 17(24):243-247.
[15] 顾晶晶, 黄珍祯, 谷颖敏,等. 雄黄可溶性砷和价态砷与小鼠急性毒性关系的研究[J].中国实验方剂学杂志, 2011, 17(8):230-233.
[16] 张伟,余伯阳,寇俊萍,等. 雄黄活性物质的毒效相关性初步研究[J].中国天然药物,2004,2(2):62-64.
[17] 梁爱华,李春英,王金华,等.雄黄的毒性研究[J].中国中药杂志,2011,36(14):1889-1894.
(编校:王俨俨)
ATO enhanced anti-Lewis lung carcinoma effect of As2S2in mouse
GU Ya-qin1, YANG Zhao-cong2, Qian Zhi-zhi2, ZHANG Liang1Δ
(1. School of Pharmacy, Nanjing University of Traditional Chinese Medicine, Nanjing 210023, China; 2.Jiangsu Key Laboratory for Pharmocology and Safety Evaluation of Chinese Materia Medica, Nanjing 210023, China)
ObjectiveTo investigate the synergistic anti-tumor effect of arsenic trioxide (ATO) on realgar(As2S2). MethodsThe inhibition effect of different concentrations of ATO on proliferation of Lewis lung carcinoma were observed by MTT method with 4,2,0.5μM ATO combined with different concentrations of As2S2. The Lewis lung carcinoma mice model was established and randomly divided into model group, cisplatin group[5 mg/(kg·d),ip],ATO group[1 mg/(kg·d),ip], As2S2high-, middle-, low-dose group[8,2,0.4 g/(kg·d),ig], As2S2high-, middle-, low-dose combined with ATO group, with consecutive treatment of 14 days. The body mass, tumor inhibition rate, index of thymus and spleen, CD4+/CD8+T in spleen were observed, and the levels of Perforin and Granzyme B mRNA in spleen were detected by RT-PCR method. Results4μM ATO significantly increased the inhibition effect of As2S2on proliferation of Lewis cell(P<0.05); the inhibition rate of As2S2middle-dose+ATO group was higher than As2S2middle-dose group(P<0.05); compared with As2S2middle-dose group, the CD8+T and CD4+/CD8+levels in spleen of As2S2middle-dose+ATO group were higher (P<0.05); the expression of GranzymeB mRNA in spleen of As2S2middle-dose+ATO group was higher than model group (P<0.05). ConclusionATO could significantly increase the proliferation inhibition of As2S2on Lewis, probably by enhancing the immune response.
As2S2; ATO; synergies; Lewis lung carcinoma; T-cells immunity
顾亚琴,女,硕士,研究方向:中药毒理学,E-mail:guyaqin1991@126.com;张良,通信作者,博士,副教授,硕士生导师,研究方向:中药毒理学,E-mail:zhangl_1999@163.com。
R734.2;R73-3
A
10.3969/j.issn.1005-1678.2016.05.09
