小鼠动脉粥样硬化发展不同阶段巨噬细胞表型变化研究*
2016-07-22西安交通大学医学院第一附属医院心内科西安710061卓小祯马爱群
西安交通大学医学院第一附属医院心内科(西安710061) 龚 敏 卓小祯 马爱群
小鼠动脉粥样硬化发展不同阶段巨噬细胞表型变化研究*
西安交通大学医学院第一附属医院心内科(西安710061)龚敏△卓小祯马爱群▲
摘要目的:探讨动脉粥样硬化的形成(脂质条纹)和发展(进展的复合斑块)不同阶段巨噬细胞不同表型(Phenotype)的变化及表达。方法:将SD小鼠20只喂以高脂饮食,每隔2周分别处死10只,取全部主动脉观察斑块的组织形态学变化和斑块的稳定性,以了解动脉粥样硬化的发生、发展过程,此外用免疫组化法(Immunochemistry)重点观察斑块内巨噬细胞的分型情况。 结果:①随着动脉粥样硬化发展,斑块面积明显增加。②CD4+随着动脉粥样硬化发展明显增加;而CD8+无明显变化;③巨噬细胞M1表型在动脉粥样硬化的发展明显增加,M2表型在不同阶段变化不明显。结论:M1/M2比例失衡,动脉粥样硬化斑块的发展相关。
主题词动脉硬化/病理生理学动脉硬化/组织学巨噬细胞表型实验,动物小鼠
动脉粥样硬化是慢性炎症过程, 巨噬细胞在斑块内的堆积是其关键步骤。巨噬细胞为多向性细胞,替代激活(M1)和经典激活(M2)的巨噬细胞决定炎症进展。AS的转归不仅取决于巨噬细胞的数量更重要的是巨噬细胞的活性状态,因此调控M1/M2将对AS斑块进展和稳定性产生重要影响[1]。本研究观察动脉粥样硬化的形成(脂质条纹)和发展(进展的复合斑块)不同阶段,巨噬细胞不同表型(Phenotype)的变化及表达。
材料与方法
1动物与试剂实验用SD小鼠20只购自西安交通大学实验动物中心。喂以高脂饮食,每隔2周分别处死10只,取全部主动脉观察斑块的组织形态学变化和斑块的稳定性,以了解动脉粥样硬化的发生、发展过程,此外用免疫组化法(Immunochemistry)重点观察斑块内巨噬细胞的分型情况。
2研究方法① 病变血管动脉粥样斑块定量分析:取主动脉升部、弓部及胸主动脉纵形切开,1%福尔马林固定,油红O染色,2.5倍光镜下观察照像,图像扫描计算血管损害面积与血管总面积之比;② 粥样斑块稳定性分析:天狼星红(Sirius red)染色测定胶原蛋白表达,免疫组化染色检测CD4+和CD8+T细胞阳性细胞计数;③ 动脉粥样硬斑块不同发展阶段中的巨噬细胞表型(Phenotype)变化:免疫组化法以CD68(标记所有的组织巨噬细胞),CD86(标记M1),Detectin(标记M2)为细胞标志物标记不同类型的组织巨噬细胞,CD68+CD86+细胞则为促进炎症发展的巨噬细胞(Pro-inflammatory macrophages,M1),而CD68+detectin+细胞为促修复的旁路激活的巨噬细胞(Alternatively activated macrophages, M2)。
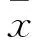
结果
1两组动脉斑块面积变化两周组阳性区域出现脂质条纹及少量脂质斑块,斑块面积为(10.10±1.57)%,4周组斑块面积为(19.08±2.35)%,4周组较两周组动脉斑块面积明显增加(P<0.05)。
2动脉粥样硬化不同阶段炎性细胞的变化见表1。4周组CD4+较两周组明显增加(P<0.05);4周组CD8+较两周组无明显变化(P>0.05);但4周组与两周组之间CD4+/CD8+比值明显增加(P<0.05)。
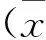
表1 动脉粥样硬化不同阶段炎性细胞的变化±s)
注:两组相比,P<0.05
3斑块不同发展阶段巨噬细胞表型变化见表2。CD68在两组之间无明显变化(P>0.05); 4周组CD68+CD86+为(7.06±1.77)% , 较两周组明显增加(P<0.05);4周组CD68+detectin+为(19.51 ±1.15)%,较两周组明显减少(P<0.05)。
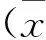
表2 斑块不同发展阶段巨噬细胞表型变化±s)
注:两组相比,P<0.05
讨论
动脉粥样硬化(Atherosclerosis, AS)是动脉壁的慢性炎症过程,巨噬细胞在斑块内的堆积,发挥促炎效应是其关键步骤。然而巨噬细胞是一种多向性细胞,不同活性的巨噬细胞对炎症损伤具有不同的作用,替代激活的巨噬细胞(Alternatively activated macrophages, M2reparative macrophages)促进炎症损伤的修复,而经典激活的巨噬细胞(Classically activated macrophages, M1destructive macrophages)则加重炎症损伤[1]。在炎症模型中,损伤性和修复性的巨噬细胞的比例总处于动态平衡,而疾病的转归不仅取决于巨噬细胞的数量更重要的是巨噬细胞的活性状态[2,3]。
新近发现:肥胖小鼠脂肪组织中的巨噬细胞主要是M1细胞,表现为促炎活性,介导胰岛素抵抗和代谢综合征;而体瘦小鼠脂肪组织中的巨噬细胞主要是M2细胞,表现为抗炎活性,抑制糖耐量减低[3]。既往研究发现在人颈动脉粥样斑块存在着M1/M2比例失衡,并与斑块的稳定性呈强相关,主要表现为M1活性过强,而M2活性低下[4]。
巨噬细胞是与动脉粥样硬化相关的炎症细胞。早在1815年发现:AS病变部位存在巨噬细胞。1979年ERRITY证实:在猪的AS斑块中存在大量巨噬细胞,巨噬细胞通过黏附浸润血管内皮细胞并形成泡沫细胞从而促进AS的发展。巨噬细胞被认为是AS发生和发展的“关键动力”[5]。在体内外不同的局部微环境影响下巨噬细胞可分化为M1型(经典活化型)或M2型(替代活化型)巨噬细胞。M1型和M2型巨噬细胞均存在于AS斑块内,但发挥的作用却不同。在LPS及INF-r的诱导下巨噬细胞可分化为M1型,同时分泌大量的LI-12、IL-23、IL-6及INF-a等炎性细胞因子,参与炎症反应、病原菌的清除以及活性氧的表达,促进AS的发展。在IL-4、IL-13 、IL-1或者维生素D3的诱导下巨噬细胞可分化为M2,IL-10、精氨酸酶、清道夫受体、甘露糖受体的分泌及表达增加,抑制炎症反应,促进组织损伤修复[6]。
根据是否表达CD4或者CD8分子将淋巴细胞分为CD4+和CD8+T细胞。两种细胞功能不同,CD4+细胞识别13~15个残基组成的外源性抗原肽,受自身MHCII类分子的限制,活化后形成的效应T细胞可分泌不同的细胞因子,在帮助免疫反应中其他免疫细胞发挥效应起到重要作用。CD8+T细胞识别8~12个残基组成的内源性抗原肽,受自身MHCI类分子限制、活化后,分化为Tc细胞,具有细胞毒作用,可特异性杀伤受感染细胞或者功能失调细胞,如瘤细胞等[7]。Chan[8]在研究中证实:CD4+T细胞在巨噬细胞亚型调节过程中起主要作用,并且相对于巨噬细胞本身成分,淋巴细胞诱导产生的细胞因子环境在诱导巨噬细胞向M2亚型转化过程中起到的作用更为关键。无论是在炎症的初始阶段还是维持阶段,CD8+T细胞均可降低M1特征性分子如IL-6、TNF-a的表达,但对M2指标均无影响。
本研究发现:动脉粥样硬化的形成(脂质条纹)和发展(进展的复合斑块)不同阶段,巨噬细胞不同表型(Phenotype)的变化及表达也不相同。在复合斑块期CD4+较脂质条纹期明显增加;而CD8+变化则不明显。在复合斑块期巨噬细胞M1表型较脂质条纹期明显增强;而M2表型则略减少。M1/M2比例失衡,动脉粥样硬化斑块的发展相关,这和既往研究结论相似。因此,调节或控制巨噬细胞的活性状态将对AS斑块进展、尤其是斑块的稳定性产生重要影响,并有可能成为一种新的潜在治疗靶点。
参考文献
[1]Hansson GK, Libby P. The immune response in atherosclerosis: a double-edged sword[J]. Nature Rev,2006,6(7): 509-519.
[2] Kluth DC, Erwig LP, Rees AJ. Multiple facets of macrophages in renal injury[J]. Kidney International,2004,66(2):542-557.
[3]Lumeng CN,Bodzin JL.Saltiel AR. Obesity induces a phenotypic switch in adipose tissue macrophage polarization[J].J Clin Invest,2007,117(1): 175-184.
[4]Bouhlel MA, Derudas B, Rigamonti E,etal. PPA Rgamma activation primes human monocytes into alternative M2macrophages with anti-inflammatory properties[J]. Cell Metab,2007,6(2):137-143.
[5]Weber C,Zerncke A,Libby P.The multifaceted contributions of leukocyte subsets to atherosclerosis:lessons from mouse models [J].Nat Rev Immuol,2008,8(10):802-815.
[6]Tailleux A,Haulon S,Zawadzki C,etal.Humman atherosclerotic plaque althernative macrophqges display low cholesterol handling but high phagocytosis because of distinct activities of the PPAR and LXR pathways [J].Circ Res,2011,108(8):985-995.
[7]Moser M,Leo O.Key concepts in immunology [J]. Vacine,2010,28(Suppl 3):C2-13.
[8]Chan T,Pe K,Huth K,etal.CD4+T-cell are important in regulating macrophage polarization in C57B2/6 wildtype mice [J]. Cell Immunol,2011,266(2):180-186.
(收稿:2015-12-28)
通讯作者▲
【中图分类号】R543.5
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.05.001
·论著·基础研究·
*陕西省科技厅自然科学基金项目(2014JM4151)
△西安市中心医院心内科