2个地理种群大银鱼COⅠ基因序列变异与遗传分化
2016-07-22赵琳张敏莹徐东坡周彦锋方弟安段金荣刘凯
赵琳,张敏莹,徐东坡,周彦锋,方弟安,段金荣,刘凯
(1.中国水产科学研究院淡水渔业研究中心农业部长江下游渔业资源环境科学观测实验站,江苏 无锡214081;2.南京农业大学渔业学院,江苏无锡214081)
2个地理种群大银鱼COⅠ基因序列变异与遗传分化
赵琳1、2,张敏莹1,徐东坡1,周彦锋1,方弟安1,段金荣1,刘凯1
(1.中国水产科学研究院淡水渔业研究中心农业部长江下游渔业资源环境科学观测实验站,江苏 无锡214081;2.南京农业大学渔业学院,江苏无锡214081)
摘要:为探究大银鱼Protosalanx hyalocranius不同地理种群的遗传变异情况,采用PCR产物纯化测序方法,测定了太湖、洪泽湖两个种群共96尾大银鱼线粒体细胞色素C氧化酶Ⅰ亚基 (cytochrome oxidaseⅠ,COⅠ)基因的部分序列。结果表明:在638 bp序列中共检测到6个变异位点,占核苷酸总数的0.94%;A、G、T、C平均含量依次为 26.2%、34.0%、21.3%和 18.5%,A+T含量 (47.5%)低于 G+C含量(52.5%);共发现7种单倍型,其中hap1、hap5和hap7为共享单倍型,hap6为洪泽湖种群特有,hap2、hap3和hap4为太湖种群特有,在7种单倍型中,hap1为明显的优势单倍体型,共54个个体(占总个体数的56.25%);平均单倍型多样性(Hd)和核苷酸多样性(Pi)分别为0.642和0.001 48,遗传多样性较低;AMOVA分析显示,种群内遗传变异为79.82%,种群间变异为20.18%,两种群间遗传分化系数(Fst)为0.201 79,表明两种群间遗传分化程度较高。本研究结果可为合理开发和利用大银鱼野生资源提供参考。
关键词:大银鱼;地理种群;线粒体细胞色素C氧化酶Ⅰ亚基 (COⅠ);遗传分化
大银鱼Protosalanx hyalocranius隶属于硬骨鱼纲 Osteicthyes、胡瓜鱼目 Osmeriformes、银鱼科Salangidae、大银鱼亚科Protosalanginae、大银鱼属Protosalanx Regan[1],主要分布于东海、黄海、渤海海域和长江、淮河中下游河道及湖泊水库,是中国银鱼科中分布广泛、产量与经济价值均较高的鱼类。大银鱼是太湖、洪泽湖的传统名特产之一,也是江苏省出口创汇的重要水产品。目前,关于大银鱼的研究主要集中在生物学特性[2]、移植增殖[3]、种群生态[4]等方面,而在分子生物学方面的研究较少[5-8]。
相较于核基因,线粒体基因具有单一的母性遗传模式、无内含子且重组现象发生概率低,更适合作为DNA条形码标记[9]。由于线粒体细胞色素C氧化酶Ⅰ亚基 (COⅠ)基因的序列进化速率较快,密码子的保守性高而且引物的通用性强[10],常被认为其可以如实反映物种之间的真实进化关系,因此,有学者提出可以利用这一特定基因来做动物DNA条形编码,并且已确立其在动物物种识别中的作用[11]。基于COⅠ基因分析,Ward等[12]有效地区分了澳大利亚207种海洋鱼类,Schlei等[13]对鲑科鱼类一个亚科的3个属进行了鉴定,王中铎等[14]鉴别了南海40种硬骨鱼类。郭立等[15]研究中所涉及的太湖新银鱼COⅠ基因多样性分析为本研究提供了重要启示。本研究中,测定了中国大银鱼2个地理种群的COⅠ基因序列,分析其遗传多样性和遗传结构,以期为保护和开发利用大银鱼种质资源提供理论依据。
1 材料与方法
1.1材料
试验用太湖大银鱼采集于2014年5月21日,共247尾,体长为32~71 mm,体质量为0.1~0.7 g;试验用洪泽湖大银鱼采集于2014年5月23日,共231尾,体长为31~72 mm,体质量为0.1~0.7 g。采样网具为银鱼拖网 (俗称飞机网)。样品采集后立即保存于95%乙醇中,带回实验室备用。
1.2方法
1.2.1DNA提取 参照文献[16]的方法并略作修改,具体如下。
取0.1 g大银鱼背部肌肉,剪碎放入1.5 mL
将上述加入冰乙醇的上清液置于冰箱中冷冻1 h后,以13 000 r/min离心15 min,弃上清液,留沉淀。用70%酒精清洗沉淀1~2次,将离心管倒置,自然晾干,向离心管中加入150 μL ddH2O(或TE)溶解,置于冰箱 (4℃)中保存备用。
1.2.2PCR扩增与测序 PCR扩增引物设计方法参照文献[17],其序列为
COI-F:5'TGTAAAACGACGGCCAGT 3',
COI-R:5'CAGGAAACAGCTATGACAC 3'。
引物由上海铂尚生物技术有限公司合成。试验所用试剂购自大连宝生物科技有限公司。PCR反应体系 (共20 μL):Premix Taq(TaKaRa TaqTM Version 2.0 plus dye)10 μL,正反向引物(20 mmol/L)各l μL,DNA模板 (20 ng/μL)2 μL,用ddH2O补足至20 μL。用ABIVeriti 96 well梯度PCR仪扩增。反应程序:94℃下预变性3 min;94℃下变性45 s,55℃下退火45 s,72℃下延伸1 min,共进行35个循环;最后于72℃下再延伸8 min。扩增产物用12 g/L的琼脂糖凝胶电泳检测,相对分子质量标准为100 bp DNA Ladder Marker。PCR产物回收纯化送至上海铂尚生物有限公司测序,测序引物与扩增引物相同。共测序96尾大银鱼样品,其中太湖种群49尾,洪泽湖种群47尾。
1.3数据处理
将测定的序列用ClustalX 1.81软件进行对位排列并辅以人工校对,在NCBI中经BLAST比对;用MEGA 3.1软件计算不同序列的碱基组成、变异位点、简约信息位点、转换与颠换比值 (si/ sv)[18]。用DNASP 5.10软件包计算群体的单倍型数 (NH)、单倍型多样性 (Hd)、核苷酸多态性(Pi)、平均核苷酸差异数 (K)[19]。利用Arlequin软件中的分子变异分析估算遗传变异在群体内和群体间的分布,以及地理种群分化水平 (Fst)[20]。
2 结果与分析
2.1大银鱼群体COⅠ基因序列的多样性
大银鱼样本经PCR扩增后得到清晰的COⅠ电泳条带,长度约650 bp(图1)。
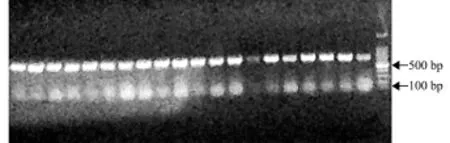
图1 大银鱼mtDNA COⅠ基因PCR扩增电泳图 (最右边通道为100 bp DNA Ladder Marker)Fig.1 PCR amplification electrophoresis of mtDNA COⅠgene of ice fish Protosalanx hyalocranius (The rightmost lane is 100 bp DNA Ladder Marker)
测序得到的序列经人工校对和比对去除两端不确定的序列后,获得638 bp的序列片段,经BLAST同源性分析,与大银鱼线粒体DNA全序列(No.gb|JN242657.1|)中COⅠ序列的一致性高达99%,确认所测序列为大银鱼COⅠ序列的5'端部分。638 bp序列中,碱基 A、G、T、C的平均含量依次为26.2% (26.0% ~26.5%)、34.0% (33.7% ~34.2%)、21.3%(21.2% ~21.6%)和 18.5%(18.3%~18.7%),A+T含量(47.5%)低于G+C含量 (52.5%),符合硬骨鱼类碱基组成特征[21]。
所有样本638 bp序列中,共检测到6个变异位点 (variable sites),分别位于第125、239、248、317、329和557位点上 (表1)。其中第248位为转换位点 (transitional paris),其余5个为颠换位点 (transversional pairs)。太湖种群出现6个变异位点,其中4个为简约信息位点;洪泽湖种群出现3个变异位点,均为简约信息位点。总变异位点占核苷酸总数的0.94%,且全部发生在三联密码子的第3个碱基上,而密码子的前2个碱基上无变异,符合线粒体蛋白质编码基因密码子第3位点进化速度最快、第2位点最保守的一般规律[22]。序列中没有插入或缺失的变异位点,转换位点个数和颠换位点个数的比值 (si/sv)为5,大于Li[23]所提出的期望值0.5,表明此片段没有饱和,适合进行遗传变异分析。
2.2单倍型分析
96尾大银鱼样本共检出7种单倍型 (表1)。从单倍型分布 (表2)情况分析,太湖种群出现6种单倍型,洪泽湖种群出现4种单倍型。其中hap1为明显的优势单倍体型,共54个样本,占样本总数的56.25%。2个群体的共享单倍型有3种,分别为 hap1、hap5和 hap7,占样本总数的77.08%。除3种共享单倍型外,hap2、hap3和hap4为太湖种群特有,占样本总数的 9.38%;hap6为洪泽湖种群特有,占样本总数的13.54%。
2.3种群的遗传多样性及中性检验
遗传多样性是指生物种内和种间的遗传变异度[24]。遗传多样性通常采用单倍型多样性 (Hd)与核苷酸多样性 (Pi)来度量[25],Hd和Pi值越大,表明种群的遗传多样性越丰富。平均核苷酸差异数 (K)代表了每个群体内两个随机选取的mtDNA序列间平均每个位点的核苷酸数目[26]。2个种群大银鱼的遗传多样性及中性检验结果表明:太湖种群Hd略低于洪泽湖种群,2个种群的Pi均很低;太湖种群的K=0.680 27,洪泽湖种群的K= 1.000 93;太湖种群的D值为负值。
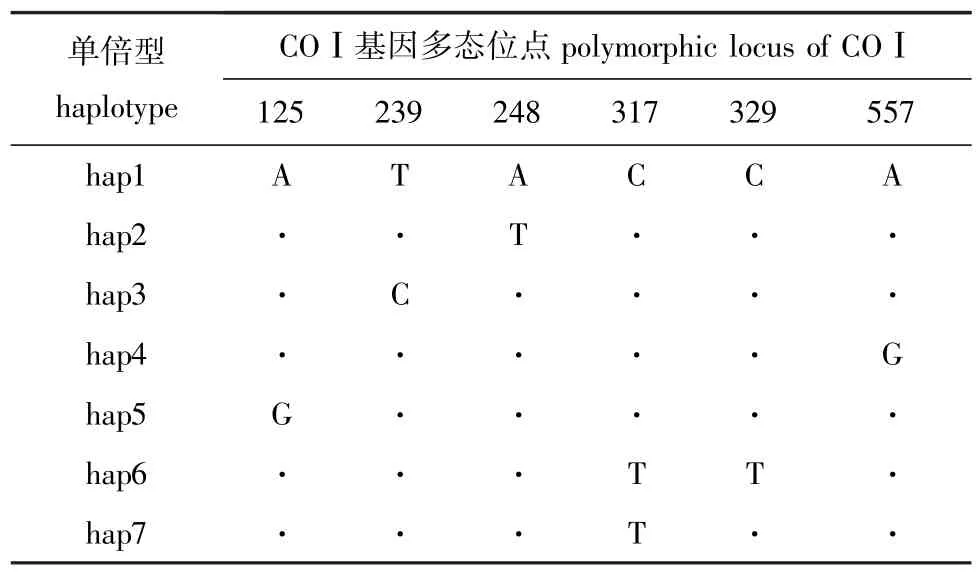
表1 大银鱼两群体mtDNA COⅠ基因多态位点及单倍型Tab.1 Polymorphic loci and haplotypes on mtDNA COⅠgene of two populations of ice fish Protosalanx hyalocranius

表2 大银鱼两群体线粒体COⅠ基因单倍型分布Tab.2 Distribution of seven haplotypes on mtDNA COⅠgene in two populations of ice fish Protosalanx hyalocranius
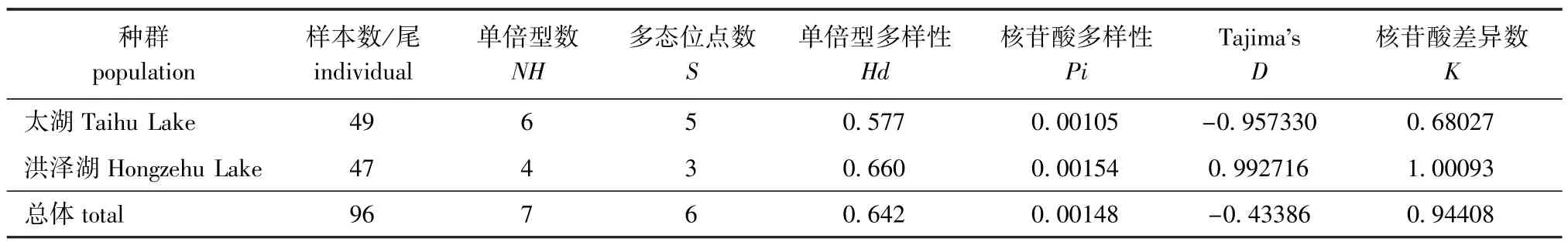
表3 大银鱼两群体内的遗传多样性及Tajima's D检验Tab.3 Genetic diversity index and Tajima's D tests of two populations of ice fish Protosalanx hyalocranius
2.4种群AMOVA分析
将2个大银鱼种群归为一个组进行AMOVA分析 (表4),结果显示,种群内的遗传变异系数为79.82%,种群间的遗传变异系数为20.18%,种群间遗传分化系数为0.201 79,两群体间遗传差异极显著 (P<0.01)。
3 讨论
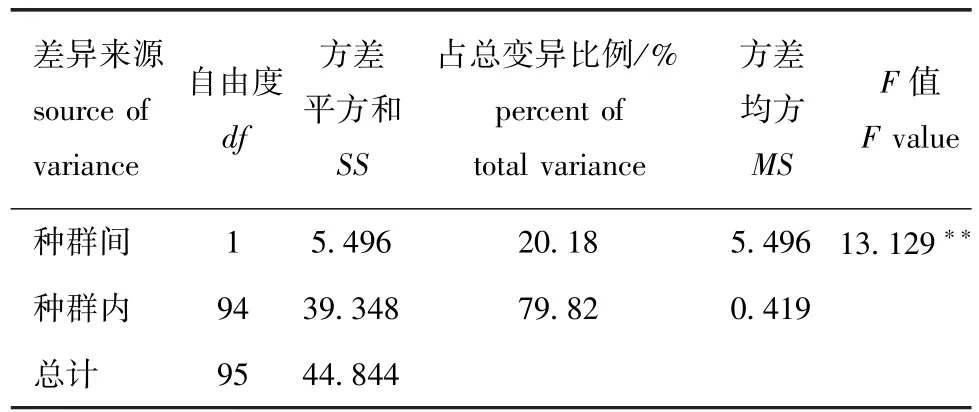
表4 大银鱼两群体mtDNA COⅠ基因序列AMOVA分析Tab.4 Analysis of molecular variance(AMOVA)on mtDNA COⅠgene of two populations of ice fish Protosalanx hyalocranius
3.1COⅠ基因的应用
目前,DNA条形编码 (DNA barcodes)已成为一种有效的生物鉴定手段,它将完成一些传统形态学鉴定手段无法完成的工作[27]。COⅠ基因中部分片段能够用作条形码,这是因为COⅠ在能保证足够变异的同时,又很容易被通用引物扩增,且目前研究表明,其DNA序列本身很少存在插入和缺失 (即使存在也主要分布于该基因的3'端),对结果的分析不会造成很大的影响[28]。同时,COⅠ基因还拥有蛋白编码基因所共有的特征,即密码子第3位碱基不受自然选择压力的影响,可以自由变异。这是因为在蛋白编码基因里,由于密码子的简并性,其第3位碱基通常均不受自然选择作用,而是自由变化的[27]。本研究中的变异位点全部发生在三联密码子的第3个碱基上,而密码子的前2个碱基上没有变异,符合上述规律,也证明了COⅠ基因用作遗传分析的可行性。
3.2大银鱼单倍型多样性和核苷酸多样性
Bowen等[29]提出了一个判断种群是否发生扩张的简单方式,即利用单倍型多样性与核苷酸多样性来估计种群的进化历史,他认为单倍型多样性较高而核苷酸多样性较低 (Hd>0.5,Pi<5%)是因为瓶颈效应后种群数量迅速扩张造成的。单倍型多样性较高而核苷酸多样性较低的情况在洄游鱼类及部分海水生物中很常见,如刀鲚 (Hd=0.999 3,Pi=0.042 0)、西大西洋斑点鱿 (Hd=0.79~0.98,Pi=0.002 9~0.006 8)[28],在青海湖裸鲤、鱇浪白鱼等淡水鱼类中也存在这种情况[30-31]。
本研究中,大银鱼种群的Hd为0.642,而其Pi仅为0.001 48,可能是由于积累核苷酸多样性所需要的时间比积累单倍型多样性漫长许多,这说明本研究中的大银鱼种群是从一个有效种群数量较小的群体,经快速扩张而来。
3.3大银鱼种群的中性检验遗传分化
应用Tajima’s D值中性检验推测种群曾经历的历史时,如果该值为负值,且在统计学上达到显著标准,则说明序列中含有比中性进化模型更多的核苷酸位点变化,可能预示着被研究种群曾经经历过一个扩张的历史[32]。本研究中,太湖种群Tajima’s D值为负值 (表3),表明太湖种群可能曾经经历过种群扩张。若将两种群看作一个整体,则D值仍为负值,说明大银鱼在历史上发生过扩张,而研究样本数量较小,则有可能是造成各群体在单独进行中性检验时不显著 (P>0.05)的原因。
遗传分化系数是反映各亚群间遗传分化的重要指标。由种群AMOVA分析可知,太湖与洪泽湖之间的Fst值为0.201 79,表明两种群间存在极显著分化。另外,2个群体间的7种单倍型中,有3种属于共享单倍型,分别为hap1、hap5和hap7,说明这3种单倍型很可能是一种较为稳定、能够适应环境变化的原始单倍型类型。
本研究结果初步揭示了大银鱼种群经历过快速扩张,太湖种群和洪泽湖种群大银鱼可能因地理隔离产生了明显的遗传分化。
参考文献:
[1]倪勇,朱成德.太湖鱼类志[M].上海:上海科学技术出版社,2005:210-214.
[2]林长虹.大银鱼生物学特性及移植技术[J].水利渔业,1993 (5):15-17.
[3]戈志强,沈其璋,喻叔英.大银鱼移植、增殖放流技术的探讨[J].淡水渔业,1999,29(1):11-13.
[4]薛以平,吴建广.水库大银鱼种群生态演变规律及增殖利用初探[J].淡水渔业,2004,34(3):57-59.
[5]高天翔,陈省平,韩志强,等.大银鱼和小齿日本银鱼线粒体细胞色素b和16S rRNA基因部分序列分析[J].中国海洋大学学报,2004,34(5):791-794.
[6]夏德全,曹萤,吴婷婷,等.用RAPD方法分析太湖大银鱼、太湖新银鱼和寡齿新银鱼的亲缘关系[J].中国水产科学,2000,7(1):12-15.
[7]张颖,董仕,王茜,等.大银鱼和太湖新银鱼同工酶遗传组成的研究[J].大连水产学院学报,2005,20(2):111-115.
[8]夏德全,曹萤,吴婷婷,等.太湖中大银鱼、太湖新银鱼和寡齿新银鱼群体的遗传结构[J].水产学报,1999,23(3):254-260.
[9]Saccone C,De Giorgi C,Gissi C,et al.Evolutionary genomics in metazoa:the mitochondrial DNA as a model system[J].Gene,1999,238(1):195-209.
[10]Hebert P D N,Ratnasingham S,de Waard J R.Barcoding animal life:cytochrome c oxidase subunit 1 divergences among closely related species[J].Proceedings of the Royal Society B:Biological Sciences,2003,270(S):S96-S99.
[11]杨帆,何利军,雷光春,等.中国东南沿海弹涂鱼科常见鱼类的遗传多样性和DNA条形码[J].生态学杂志,2012,31(3):676-683.
[12]Ward R D,Zemlak T S,Innes B H,et al.DNA barcoding Australia’s fish species[J].Philosophical Transactions of the Royal Society B:Biological Sciences,2005,360:1847-1857.
[13]Schlei O L,Crête-Lafrenière A,Whiteley A R,et al.DNA barcoding of eight North American coregonine species[J].Molecular Ecology Resources,2008,8(6):1212-1218.
[14]王中铎,郭昱嵩,陈荣玲,等.南海常见硬骨鱼类COⅠ条码序列[J].海洋与湖沼,2009,40(5):608-614.
[15]郭立,李隽,王忠锁,等.基于四个线粒体基因片段的银鱼科鱼类系统发育[J].水生生物学报,2011,35(3):449-459.
[16]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3版.黄培堂,译.北京:科学出版社,2002:463-470.
[17]Folmer O,Black M,Hoeh W,et al.DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates[J].Mol Mar Biol Biotechnol,1994,3(5):294-299.
[18]Kress W J,Wurdack K J,Zimmer E A,et al.Use of DNA barcodes to identify flowering plants[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102 (23):8369-8374.
[19]Smith M A,Woodley N E,Janzen D H,et al.DNA barcodes reveal cryptic host-specificity within the presumed polyphagous members of a genus of parasitoid files(Diptera:Tachinidae)[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(10):3657-3662.
[20]Librado P,Rozas J.DnaSP v5:a software for comprehensive analysis of DNA polymorphoism data[J].Bioinformatics,2009,25 (11):1451-1452.
[21]桂建芳.脊椎动物线粒体DNA的进化遗传学[J].动物学杂志,1990,25(1):50-55.
[22]Irwin D M,Kocher T D,Wilson A C.Evolution of the cytochrome b gene of mammals[J].Journal of Molecular Evolution,1991,32 (2):128-144.
[23]Li W H.Molecular Evolution[M].Sunderland,M A,USA:Sinauer Associates,1997:103-120.
[24]施立明.遗传多样性及其保存[J].生物科学信息,1990,2(4):158-164.
[25]Tajima F.Evolutionary relationship of DNA-sequences in finite populations[J].Genetics,1983,105(2):437-460.
[26]Nei M,Li W H.Mathematical model for studying genetic variation in terms of restriction endonucleases[J].Proceedings of the National Academy of Sciences of the United States of America,1979,76(10):5269-5273.
[27]肖金花,肖晖,黄大卫.生物分类学的新动向——DNA条形编码[J].动物学报,2004,50(5):852-855.
[28]Miner B E,Stöger R J,Burden A F,et al.Molecular barcodes detect redundancy and contamination in hairpin-bisulfite PCR[J]. Nucleic Acids Research,2004,32(17):e135.
[29]Bowen B W,Grant W S.Phylogeography of the sardines(Sardinops spp.):assessing the biogeographic models and population histories in temperate upwelling zones[J].Evolution,1997,51 (5):1601-1610.
[30]赵凯,李军祥,张亚平,等.青海湖裸鲤mtDNA遗传多样性的初步研究[J].遗传,2001,23(5):445-448.
[31]杨博,陈小勇,杨君兴.鱇浪白鱼线粒体DNA控制区结构和种群遗传多样性分析[J].动物学研究,2008,29(4):379-385.
[32]Fu Y X.Statistical tests of neutrality of mutations against population growth,hitchhiking and background selection[J].Genetics,1997,147(2):915-925.
中图分类号:Q346;S917
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.03.010
文章编号:2095-1388(2016)03-0285-05
收稿日期:2015-09-22
基金项目:国家科技基础条件平台建设运行项目 (2015DKA30470-003);中央级公益性科研院所基本科研业务费专项 (2013JBFM07)
作者简介:赵琳 (1993—),女,硕士研究生。E-mail:752773630@qq.com
通信作者:张敏莹 (1974—),女,副研究员。E-mail:zhangmy@ffrc.cnEppendorf管中,向组织样中加入裂解液 (440 μL STE,15 μL 10 mg/mL PK,50 μL 10%SDS),56℃下消化过夜;再加入与裂解液等体积的用Tris平衡的苯酚 (pH 8.0),轻摇30 min后,以12 000 r/min离心10 min,取上清液移至新的1.5 mL离心管中;重复上述步骤,此次轻摇混匀时间为10 min;加入与上清液等体积的苯酚和氯仿/异戊醇(24∶1),轻摇10 min后,以12 000 r/min离心10 min,取上清液转移至新的1.5 mL离心管中;加入与上清液等体积的氯仿/异戊醇 (24∶1),轻摇混匀30 min后,以12 000 r/min离心10 min,取上清液转移至新的1.5 mL离心管中;加入两倍上清液体积的冰乙醇进行沉淀。
Sequence variations and genetic differentiations in COⅠgene in two geographical populations of ice fish Protosalanx hyalocranius
ZHAO Lin1,2,ZHANG Min-ying1,XU Dong-po1,ZHOU Yan-feng1,FANG Di-an1,DUAN Jin-rong1,LIU Kai1
(1.Scientific Observing and Experimental Station of Fishery Resources and Environment in the Lower Reaches of the Changjiang River,Ministry of Agriculture,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,China;2.College of Fisheries,Nanjing Agricultural University,Wuxi 214081,China)
Abstract:Mitochondrial cytochrome oxidaseⅠ(COⅠ)gene was sequenced in 96 individuals of ice fish Protosalanx hyalocranius collected in Taihu Lake and Hongzehu Lake by purified PCR products in order to study genetic variations among different geographic populations of ice fish.The results showed that 6 variable sites accounting for 0.94%of total nucleotide were found in 638 bp sequences,with average content of 26.2%in A,34.0%in G,21.3%T and 18.5%in C.There was(A+T)content of 47.5%,lower than that of(G+C)(52.5%).Seven haplotypes were found in analysis of haplotypes,with shared haplotypes of Hap1,hap5 and hap7,and specific Hap6 in Hongzehu Lake,and specific hap2,hap3 and hap4 in Taihu Lake.The average haplotype diversity(Hd)was found to be 0.642 and the nucleotide diversity(Pi)0.001 48,showing low genetic diversity.AMOVA analysis revealed that genetic variation was 79.82%within populations and the genetic variation between populations was 20.18%,with genetic differentiation index Fst of 0.201 79 between the two populations,indicating that there was higher genetic differentiation between the two populations.The findings could provide reference for rational development and utilization for wild ice fish stocks.
Key words:Protosalanx hyalocranius;geography population;cytochrome oxidaseⅠ(COⅠ);genetic differentiation
