鱼用三联口服疫苗的制备方法及其对大菱鲆的免疫效果
2016-07-22张振国郝爽李继罗璋冯守明吴会民姜巨峰孙志景
张振国,郝爽,李继,罗璋,冯守明,吴会民,姜巨峰,孙志景
(1.天津市水产研究所,天津300221;2.天津市宝坻区水产技术推广站,天津301800)
鱼用三联口服疫苗的制备方法及其对大菱鲆的免疫效果
张振国1,郝爽1,李继2,罗璋1,冯守明1,吴会民1,姜巨峰1,孙志景1
(1.天津市水产研究所,天津300221;2.天津市宝坻区水产技术推广站,天津301800)
摘要:为探究海水养殖中安全可靠、经济适用的疫苗接种方法,以药用淀粉、麦芽糊精,以及经0.5%甲醛灭活的溶藻弧菌Vibrio alginolyticus、副溶血弧菌V.parahemolyticus和迟缓爱德华氏菌Edwardsiella tarda为主要原料,采用挤出-滚圆法制备鱼用三联口服疫苗,并用其对大菱鲆Scophthalmus maximus免疫,分别在免疫0、7、14、21、28 d时测定溶藻弧菌、副溶血性弧菌和迟缓爱德华氏菌特异性抗体,以1×109cfu/mL活菌 (3种菌液比例为1∶1∶1)进行攻毒试验并计算免疫保护率。结果表明,药用淀粉150 g、麦芽糊精50 g、菌液60 mL、挤出速度200 r/min、滚圆时间60 s时,为比较成熟的三联口服疫苗制备工艺,用该疫苗免疫大菱鲆后,3种细菌的大菱鲆血清和后肠黏膜抗体效价均显著高于对照组,且免疫保护率达50%以上。
关键词:三联口服疫苗;大菱鲆;免疫
目前,人工养殖海水鱼细菌性疾病有逐年增加的趋势,尤其是迟缓爱德华氏菌Edwardsiella tarda、溶藻弧菌 Vibrio alginolyticus和副溶血弧菌V.parahemolyticus的流行,使中国海水养殖业受到了严重影响。随着高产、高效、集约化的新型养殖模式逐渐普及,细菌性疾病呈现出交叉感染、混合感染和多重感染的新特点,因此,一些学者进行了二联疫苗、三联疫苗和多联疫苗的相关研究,如用溶藻弧菌和鳗弧菌二联疫苗免疫大菱鲆Scophthalmus maximus[1],用河弧菌和嗜水气单胞菌二联疫苗免疫鲫[2],用嗜水气单胞菌、副溶血弧菌和溶藻弧菌三联疫苗免疫大黄鱼[3]。齐彩霞等[4]研发了针对斑点叉尾鮰细菌性疾病的三联疫苗。目前,疫苗的接种大多采用浸泡或注射方法,采用浸泡接种方式疫苗用量大、免疫效果不佳,采用注射接种方式则工作量大、过程繁琐、伤口易感染。而口服接种疫苗操作方便、不损伤鱼体、费用较低,适宜在生产中推广应用,已成为鱼用疫苗近年来的研究方向。为此,本研究中建立了溶藻弧菌、副溶血弧菌和迟缓爱德华氏菌三联口服疫苗的制备方法,并对其免疫大菱鲆的效果进行了初步研究,旨在为探求海水养殖中安全可靠、经济适用的疫苗接种方法提供参考。
1 材料与方法
1.1材料
试验用溶藻弧菌、副溶血弧菌和迟缓爱德华氏菌由天津市水产研究所水生生物防治研究室分离鉴定。试验用大菱鲆幼鱼购自天津盛亿养殖有限公司,共20尾,体质量为30~40 g,体长为15 cm。
主要仪器有HJ-400-P型微丸机 (重庆荣凯机械制造有限公司)。主要试剂包括药用淀粉 (辽宁东源药业有限公司)、麦芽糊精 (西王药业有限公司)、二甲基-β-丙酸噻亭 (DMPT,东营百森有限公司)、丙烯酸树脂 (EOBS60,天津爱勒易医药药材有限公司)、营养琼脂培养基 (天津市英博生化试剂有限公司)。
1.2方法
1.2.1全菌灭活疫苗的制备 将3株菌接种于LB
1.2.2三联口服疫苗的制备
(1)微丸。以药用淀粉为载体、麦芽糊精为黏合剂,经0.5%甲醛灭活的3株菌菌液按照一定比例制成微湿软材,采用挤出-滚圆法制备微丸。
(2)肠溶层包衣。将肠溶型包衣材料丙烯酸树脂溶于90%的乙醇中,制备成一定浓度的悬浊液,并使用包衣机均匀喷涂于疫苗微丸表面。
(3)诱食剂的喷涂。将二甲基-β-丙酸噻亭(DMPT)溶于水中,制成一定浓度的溶液,并使用包衣机均匀喷涂于肠溶层表面。
1.2.3三联口服疫苗的安全性评价 取100 μL全菌灭活苗涂布于普通培养基上,35℃下培养48 h后,观察有无菌落长出;取100 μL菌液 (1×109cfu/mL)注射到健康大菱鲆体内,观察记录其1~7 d的死亡率。
1.2.4大菱鲆抗体效价和免疫保护率 水族箱小水体免疫大菱鲆试验,设对照组和口服免疫组。口服免疫组每天投喂疫苗2次,连续投喂2 d,然后投喂正常饲料;对照组投喂正常饲料。试验期间每7 d采血一次,从每组取4尾鱼,采用ELISA法测定血清和后肠黏膜中的抗体平均水平。用含0.05%多聚赖氨酸的包被液在室温下处理酶标板1 h,再用低盐洗液漂洗2次,加入100 μL抗原(1.0×108cfu/mL),4℃下过夜;加入 50 μL 0.05%戊二醛22℃下孵育20 min,用低盐洗液漂洗3次;加入250 μL 1%牛血清白蛋白 (Sigma)22℃下封闭2 h,用低盐洗液漂洗3次;加入100 μL样品 (血清或后肠黏膜)4℃下过夜,用高盐洗液漂洗5次,最后一次持续洗5 min;加入100 μL鼠抗大菱鲆Ig M单抗 (Aquatic Diagnostics Ltd)22℃下孵育1 h,漂洗过程同上一步;加入100 μL辣根过氧化物酶 (HRP)标记的羊抗鼠 IgG (1/8000)22℃下孵育1 h,漂洗过程同上一步;加入100 μL TMB(四甲基联苯胺)避光22℃下显色5 min,加入50 μL终止反应液;使用酶标仪(ELX808)于波长450 nm处读数;在加样品的同时设PBS为阴性对照,当S/P≥2时判为阳性 (S为样品的OD值,P为阴性对照的OD值)。
免疫试验进行28 d后,对试验组和对照组进行3株细菌 (比例为1∶1∶1,菌液浓度为1×109cfu/mL)的人工感染,统计7 d内鱼的死亡率。免疫保护率 (RPS)计算公式为
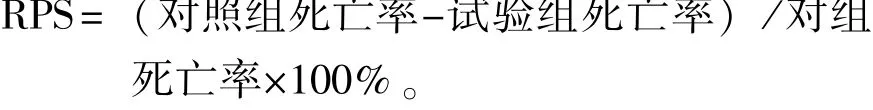
2 结果与分析
2.1灭活疫苗的制备及安全性
迟缓爱德华氏菌、溶藻弧菌、副溶血弧菌经过0.5%福尔马林灭活48 h,用LB培养基培养48 h后无菌落生长,注射健康大菱鲆7 d内无发病,说明已完全灭活。
2.2口服疫苗的制备工艺
根据赵伟等[6]的研究可知,影响微丸制备的因素主要有黏合剂糊精用量、水用量、滚圆机挤出速度、滚圆时间等。本研究中,根据前期试验结果,选择150 g药用淀粉进行试验,选择以上4个因素,每个因素设置3个水平 (表1),按L9(34)正交试验设计表安排试验,结果见表2。
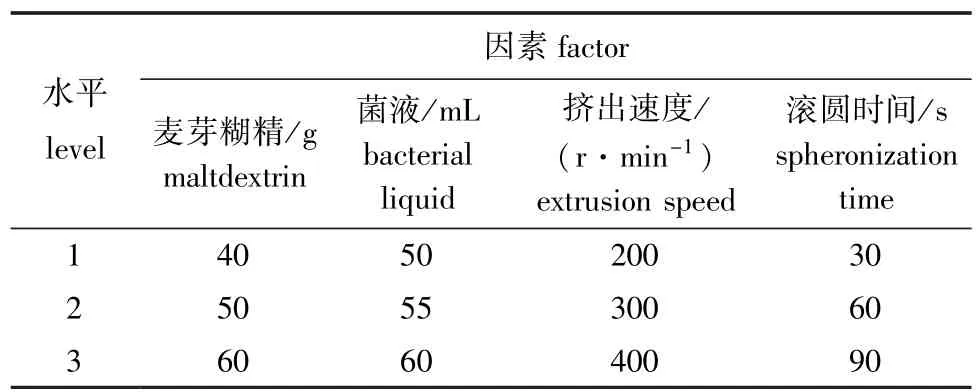
表1 因素和水平Tab.1 Factors and levels in preparation
以收率 (f)评价正交试验的结果,即f= (12-20)目干燥丸芯的质量 (g)/总投料量(g)×100%。由表2可见,4个因素的极差依次为RA>RD>RB>RC,即影响疫苗收率的主要因素是麦芽糊精用量,工艺因素对收率影响较小,试验结果与文献[6-7]报道的一致。由极差分析结果得出最佳制备工艺理论组合为A2B3C3D2,考虑到C1与C3所对应的收率差异不大,且正交试验中A2B3C1D2组合 (6号试验)的收率最高,由此确定,本试验中最优制备工艺条件为药用淀粉150 g、麦芽糊精50 g、菌液60 mL、挤出速度200 r/min、滚圆时间60 s,在此工艺条件下,收率达78%。
2.3免疫效果评价
按照文献[8]中的方法测定大菱鲆血清和后肠黏膜的抗体效价,结果见表3。口服疫苗组大菱鲆血清和后肠黏膜中的迟缓爱德华氏菌、副溶血弧菌和溶藻弧菌的特异性抗体效价均在14 d时达到最大值,抗体效价显著高于对照组 (P<0.05)。
攻毒试验结果显示,口服疫苗组攻毒试验7 d时死亡率远低于对照组,免疫保护率达到50%(表4)。说明本试验中制备的鱼用三联口服疫苗可以有效提高大菱鲆对3种细菌的抵抗力。
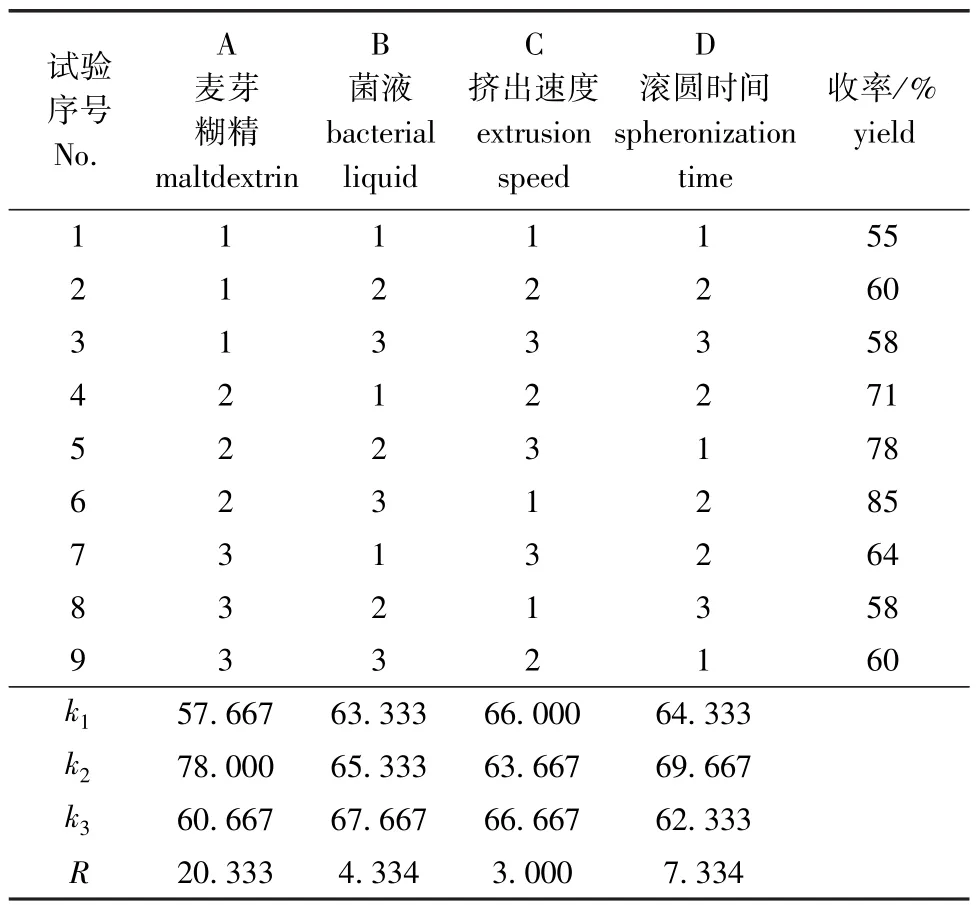
表2 正交试验设计及试验结果Tab.2 Design and results in an orthogonal test
3 讨论
3.1三联口服疫苗的制备工艺
本试验中研制的三联口服疫苗微丸,采用挤出-滚圆造粒法制备,该方法目前在制药行业中应用广泛,但在水产疫苗研究方面尚未见报道。疫苗研制时,使用微丸机上不同的孔板挤压制备成条状,经过转盘转动,依靠转盘切割力、离心力和自身重力制成不同直径的微丸,然后自然风干、过分样筛,得到成品疫苗。酸碱度、温度、胃蛋白酶等是影响鱼用口服疫苗免疫效果的主要因素,如不进行包膜直接口服,胃液会对疫苗抗原进行破坏,从而降低口服疫苗的效果。常见海水鱼类如大菱鲆、牙鲆等,胃液pH一般为2.5~5.5,肠液pH为6.0~7.8。根据海水鱼胃肠液pH值,可选用天津爱勒易药材公司的肠溶型包膜剂,该包膜剂在pH 6.0以上时才能溶解,可有效保护口服疫苗在胃液中不被消化酶破坏,在后肠中释放抗原,并通过与后肠黏膜充分接触,发挥黏膜免疫作用。
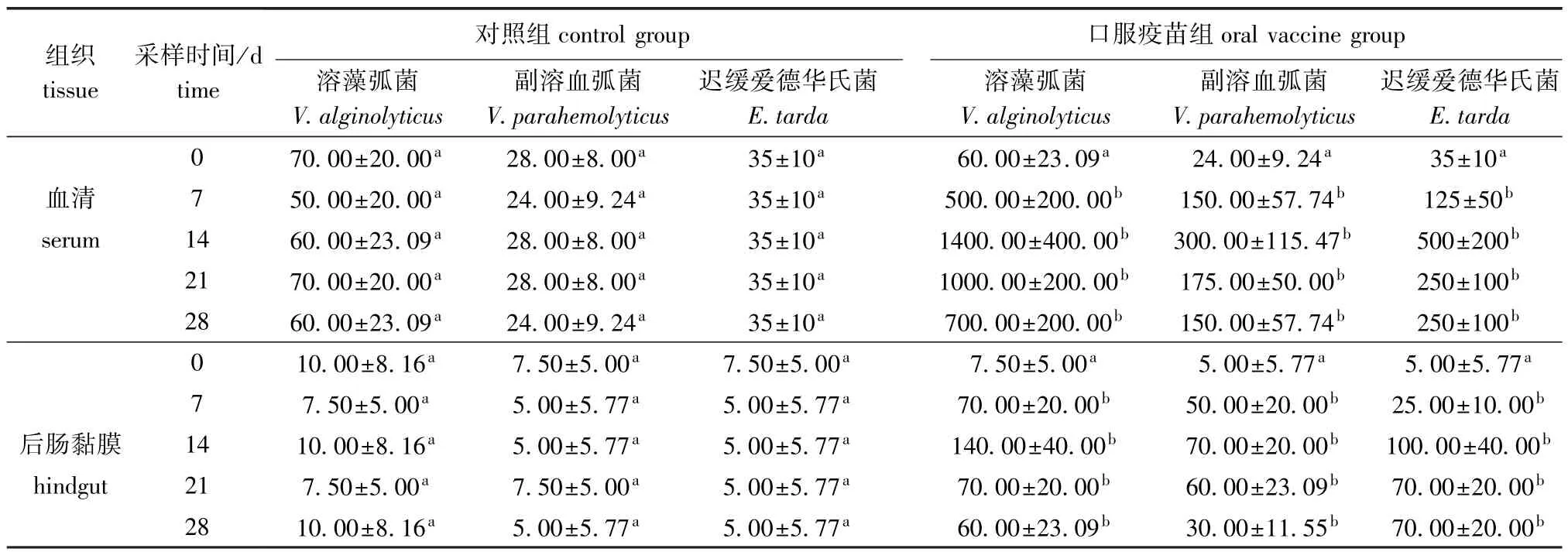
表3 血清和后肠黏膜中3种细菌特异性抗体效价的平均值Tab.3 Average values of antibody for three bacteria in serum and hindgut
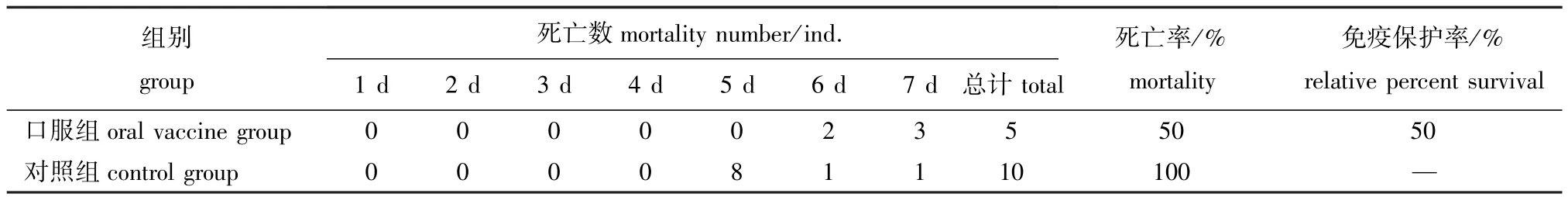
表4 攻毒试验结果Tab.4 Result in an artificial infection test
3.2三联口服疫苗的免疫效果
目前,鱼类口服疫苗的研究主要集中在微胶囊疫苗方向。李新华等[9]采用6%PVP-K30和2%海藻酸钠研发了针对银鲫嗜水气单胞菌病的口服微胶囊疫苗,免疫保护率为61.1%,高于全细胞疫苗组的50%;李梅芳等[10]制备了壳聚糖-海藻酸钠包被的副溶血弧菌外膜蛋白K微球疫苗,对大黄鱼免疫保护率为60%;丁诗华等[11]以聚乙烯醇和聚乳酸-乙醇酸共聚物(PLG)为原料,用复乳挥发法制备嗜水气单胞菌口服疫苗,对鱼的免疫保护率为42.9%,高于全细胞疫苗组的32.1%;张小江等[12]和任燕等[13]采用合成高分子聚DL-乳酸-聚乙二醇共聚物(PELA)包裹哈维氏弧菌Vibrio harveyi重组外膜蛋白微球制备口服疫苗;高铭蔚等[14]采用聚乳酸-羟基乙酸(PLGA)包裹无乳链球菌制备口服疫苗,对罗非鱼免疫保护率为57.63%;孙翰昌等[15]以聚丙烯酸树脂为材料,采用复乳溶剂挥发法制备肠型点状产气单胞菌疫苗微球。本试验中制备的三联口服疫苗采用投喂接种方式,与投喂普通饵料完全相同,省时省力,选用二甲基-β-丙酸噻亭为新一代诱食剂适合大多数海水鱼口味,对大菱鲆免疫保护率达50%以上,可有效预防溶藻弧菌、副溶血弧菌和迟缓爱德华氏菌引发的相关疾病,在海水养殖中具有良好的应用前景。
参考文献:
[1]曹宏梅,李健,战文斌.鳗弧菌和溶藻弧菌二联疫苗对大菱鲆的免疫效果[J].中国水产科学,2006,13(3):397-402.
[2]李爱华,吴玉深,蔡桃珍,等.嗜水气单胞菌和河弧菌二联疫苗对鲫的免疫效果[J].水生生物学报,2002,26(1):52-56.
[3]吴志鹏,王三英.三联疫苗对大黄鱼常见细菌性疾病免疫保护的实验研究[J].厦门大学学报:自然科学版,2004,43(1):115-118.
[4]齐彩霞,张扬,裴家田,等.三联疫苗预防斑点叉尾鮰细菌性疾病研究[J].水利渔业,2005,25(5):98-99.
[5]沈锦玉,许文军,尹文林,等.哈维氏弧菌灭活疫苗在养殖大黄鱼中的应用与评价[J].大连海洋大学学报,2010,25(3):210-213.
[6]赵伟,潘家桢.挤出滚圆造粒法制备淀粉空白微丸芯核的工艺研究[J].化工装备技术,2005,26(2):13-16.
[7]缪丹丹,朱家壁,卜小培.挤出滚圆法制备胃漂浮空白丸芯及其处方和工艺研究[J].药学进展,2007,31(3):120-123.
[8]王秀华,周凌云,王玉娟,等.多效价载体疫苗免疫大菱鲆效果评价[J].中国水产科学,2011,18(4):918-923.
[9]李新华,沈锦玉,尹文林,等.银鲫口服嗜水气单胞菌疫苗的免疫和免疫组化研究[J].水生生物学报,2007,31(1):125-130.
[10]李梅芳,毛芝娟,韩雨杉,等.壳聚糖-海藻酸钠包被的副溶血弧菌外膜蛋白K微球疫苗的制备及其口服免疫效果[J].中国生物制品学杂志,2014,27(5):301-306.
[11]丁诗华,王一丁,彭远义,等.鱼用嗜水气单胞菌口服疫苗的免疫保护效应[J].西南农业大学学报:自然科学版,2005,27 (6):888-891,917.
[12]张小江,任燕,常藕琴,等.斜带石斑鱼口服PELA-OmpK微球疫苗的示踪及免疫效果[J].中国水产科学,2008,15(5):837-844.
[13]任燕,张小江,常藕琴,等.PELA-OmpK微球疫苗的部分特征及其对鲫鱼的口服免疫效果[J].中国生物制品学杂志,2011,24(11):1306-1309.
[14]高铭蔚,田园园,卢迈新,等.罗非鱼无乳链球菌PLGA微球口服疫苗免疫效果的研究[J].免疫学杂志,2015,31(2):105-110.
[15]孙翰昌,杨帆.肠型点状气单胞菌口服疫苗微粒的制备及体外释放研究[J].水产科学,2008,27(12):658-661.
中图分类号:S942.5
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.03.004
文章编号:2095-1388(2016)03-0252-04
收稿日期:2015-08-27
基金项目:天津市科技计划项目 (14ZXNZNC00046,15ZXBFNC00290);天津市农业科技成果转化与推广项目 (201501030);天津市水产局青年科技项目 (J2014-14青)
作者简介:张振国 (1981—),男,工程师。E-mail:zhangzg8249@163.com
通信作者:冯守明 (1965—),男,博士,研究员。E-mail:smfeng65@163.com液体培养基中,副溶血弧菌和迟缓爱德华氏菌在35℃下培养24 h,溶藻弧菌在35℃下培养48 h,以5000 r/min离心并收集菌体,用福尔马林灭活,参考沈锦玉等[5]的方法,以确定合适的福尔马林浓度和灭活时间。
Preparation of triple oral vaccine for fish and primary immune effect on turbot Scophthalmus maximus
ZHANG Zhen-guo1,HAO Shuang1,LI Ji2,LUO Zhang1,FENG Shou-ming1,WU Hui-min1,JIANG Ju-feng1,SUN Zhi-jing1
(1.Tianjin Fisheries Research Institute,Tianjin 300221,China;2.Baodi District Fisheries Technology Extension Station in Tianjin,Tianjin 301800,China)
Abstract:A triple oral vaccine for fish was prepared with medicinal starch,maltodextrin,and killed Vibrio parahemolyticus,Vibrio alginolyticus and Edwardsiella tarda by 0.5%formaldehyde,by extrusion and spheronization method,and turbot Scophthalmus maximus was immuned with the triple oral vaccine prepared.The indirect ELISA was used to measure the antibody titre of V.parahemolyticus,V.alginolyticus and E.tarda in serum and hindgut mucosa 0,7,14,21 and 28 days after vaccination.The relative percent survival(RPS)of the triple oral vaccine was calculated in the turbot challenged with live V.parahemolyticus,V.alginolyticus and E.tarda(1×109cfu/mL,with ratio of V.parahemolyticusto,and V.alginolyticus to E.tarda=1∶1∶1).There was significantly higher antibody titer of the three bacteria in serum and hindgut mucosa,with RPS of more than 50%for the three bacteria above,in the triple oral vaccine prepared by 150 g of medicinal starch,50 g maltdextrin,60 mL of bacterial liquid,extrusion at 200 r/min,and spheronization in 60 s than that in the control group.
Key words:triple oral vaccine;Scophthalmus maximus;immune
