辽宁一例凡纳滨对虾大规模死亡的病原研究
2016-07-22姚洪张吉鹏杨川张利娟朴元植刘月芬叶仕根李华
姚洪,张吉鹏,杨川,张利娟,朴元植,刘月芬,叶仕根,李华
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.盘锦市水产技术推广站,辽宁盘锦124010)
辽宁一例凡纳滨对虾大规模死亡的病原研究
姚洪1,张吉鹏1,杨川1,张利娟1,朴元植2,刘月芬2,叶仕根1,李华1
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.盘锦市水产技术推广站,辽宁盘锦124010)
摘要:为对辽宁省盘锦地区2014年出现的大规模死亡凡纳滨对虾Litopenaeus vannamei展开病原研究,对死虾进行了白斑综合征病毒 (WSSV)、桃拉病毒 (TSV)、传染性皮下及造血组织坏死病病毒 (IHHNV)和嗜水气单胞菌Aeromonas hydrophila的分析鉴定,提取病虾鳃组织DNA/RNA后,以特异性引物进行WSSV、TSV和IHHNV病毒检测,通过16S rDNA测序及嗜水气单胞菌特异性引物和气溶素基因的双重PCR对分离菌株QD1进行分类鉴定,并对病虾的鳃、胃、肝胰腺和附肢进行了组织病理切片观察。结果表明:患病对虾WSSV和TSV检测呈阳性;菌株QD1为嗜水气单胞菌,其人工回归感染试验结果显示,分离菌株能使健康凡纳滨对虾致病死亡;组织病理学观察显示,病虾鳃及胃组织出现大量WSSV特征性的病变核,肝胰腺上皮细胞出现严重萎缩,肝胰腺管腔变大,部分肝细胞坏死,肝胰腺管之间结缔组织中血细胞明显增多。研究表明,此次凡纳滨对虾大量死亡为WSSV和TSV两种病毒与嗜水气单胞菌混合感染所致。
关键词:凡纳滨对虾;白斑综合征病毒;桃拉病毒;嗜水气单胞菌;组织病理
凡纳滨对虾Litopenaeus vannamei于1988年被引进中国以来,在养殖过程中已取代了中国对虾并获得了巨大的经济效益。然而,随着养殖规模的扩大和养殖生态环境的不断恶化,凡纳滨对虾的病害状况日趋突出,以桃拉病毒(TSV)病、白斑综合征病毒 (WSSV)病[1],以及引起早期死亡综合征的弧菌[2-3]和引起红腿、肠炎的嗜水气单胞菌等细菌病最为严重[4]。近年来,中国南、北方养殖虾苗排塘率很高,损失较大;而全球每年有大约40%的热带养殖虾会因不当的病毒病的预防措施损失近30亿美元[5]。早期养殖凡纳滨对虾大量死亡的原因说法不一,被称为偷死病、肝胰腺坏死病、早期死亡综合征等,其病原认为是副溶血弧菌的特异变种。也有人认为,其病原是黄头杆状病毒(YHV)新型病毒,弧菌是继发性感染,或直接原因是弧菌感染,而根本原因是虾苗抗逆性下降。还有观点认为,对虾大量死亡是藻毒素所引起的中毒现象[6]。目前,多数学者倾向于病原是副溶血弧菌。探明对虾大量死亡的原因有利于掌握对虾疾病防控主动权,对成功养殖对虾具有重要意义。
2014年以来,辽宁对虾养殖规模又一次迅速扩大,同时虾病也随之出现。2014年7月下旬,辽宁省盘锦地区养殖的凡纳滨对虾出现大规模死亡,发病面积达40%,有些虾塘死亡率达到80%~90%。本研究中对患病对虾的病原进行了分离、鉴定和分析,旨在为中国北方地区凡纳滨对虾的病害防控提供借鉴。
1 材料与方法
1.1材料
试验用患病凡纳滨对虾采自辽宁省盘锦地区7个海水养殖虾场,体长为4.0~5.0 cm;病虾活体充氧运到大连海洋大学病害实验室后,在无菌条件下按各种样品检测要求分别进行处理。
试验用健康凡纳滨对虾采自普兰店未发病养殖虾场,体长为5.0~6.0 cm,对虾活体充氧运回实验室后,经PCR检测TSV和WSSV为阴性,暂养一周无异常症状后,分池进行试验。
1.2方法
1.2.1细菌学检查 无菌条件下,使用胰蛋白胨
1.2.2菌株鉴定
(1)细菌16S rDNA序列的测定。采用水煮法提取DNA[7]。引物采用细菌16S rDNA通用引物,上游引物为27F:5'AGAGTTTGATCCTGG 3',下游引物为1492R:5'GGTTACCTTGTTACGACTT 3'。PCR产物送往北京华大基因研究中心进行测序,测序结果通过BLAST软件进行比对。
(2)嗜水气单胞菌16S rDNA和气溶素基因的双重PCR检测。细菌模板DNA的制备同上。
PCR扩增嗜水气单胞菌的16S rDNA和气溶素基因 (aerA),参照王友娟等[8]的方法。16S rDNA基因的上游引物为5'GAAAGGTTGATGCCTAATACGTA 3',下游引物为5'CGTGCTGGCAACAAAGGACAG 3',扩增产物长度为685 bp。气溶素基因的上游引物为5'GCAGAACCCATCTATCCAG 3',下游引物为5'TTTCTCCGGTAACAGGAT TG 3',扩增产物片段为252 bp。上述引物均委托上海生物工程有限公司合成。
采用 25 μL反应体系:10×PCR buffer(含Mg2+)2.5μL,dNTPMix 2μL,引物(10 pmol/μL)各0.5 μL,模板 (40~80 ng)1 μL,Taq DNA Polymerase(BBI)0.125 μL,用ddH2O补充至总体积25 μL。PCR反应条件:94℃下预变性5 min;94℃下变性30 s,50℃下退火30 s,72℃下延伸1 min,共进行30个循环;最后在72℃下再延伸10 min。取出后置于冰箱 (4℃)中保存。
取3 μL产物与1 μL 6×loading buffer混合后,点样于10 g/L琼脂糖凝胶电泳孔中,在0.5×TBE缓冲液中,在120 V电压下电泳15 min,于凝胶成像系统下拍照和判定。
判定方法:在阴、阳性对照成立的情况下,无任何条带出现,说明菌株非嗜水气单胞菌;仅在16S rDNA片段处出现条带,说明菌株为嗜水气单胞菌;在两个目的片段处均出现条带,说明菌株为致病性嗜水气单胞菌。
1.2.3病毒检测 取病虾鳃组织打碎研磨成细胞悬液,使用DNA提取试剂盒 (TIANamp Genomic DNA Kit)提取DNA。通过试剂盒 (购自厦门鹭隆生物科技发展有限公司)检测对虾白斑综合征病毒 (WSSV)、桃拉病毒 (TSV)、传染性皮下及造血组织坏死病毒 (IHHNV)。
判定方法:在阴、阳性对照成立的情况下,若在目的片段处出现相应的条带,说明病虾组织样品中存在该病毒;反之,则不含有该病毒。
1.2.4组织病理 取患病凡纳滨对虾的胃、鳃、肝胰腺、肠、附肢等组织,用波恩试剂固定24 h后,用酒精梯度脱水、石蜡包埋,经H.E染色后在显微镜下观察。
1.2.5分离菌致病性的确定 人工感染试验在80 cm×50 cm×50 cm的水槽中进行,水体为120 L,水温为21~22℃,盐度为30。每个试验组随机分配10只对虾,将培养24 h的细菌用无菌生理盐水洗脱,制成活菌终浓度为1.0×107cells/mL的菌悬液,注射到每只对虾腹部第一、二节肌肉中,每尾注射0.1 mL,对照组注射等量生理盐水,持续观察14 d。试验过程中及时捞出濒死对虾,进行细菌再分离,并进行鉴定 (方法同上)。
1.2.6药物敏感试验 采用纸片扩散法[9]进行试验。药敏纸片购自杭州微生物试剂有限公司。
2 结果与分析
2.1患病虾的临床症状及剖检
自2014年7月初开始,辽宁省盘锦地区部分养殖虾塘的对虾身体发红,尤其附肢、游泳足、尾扇变红,吃食减少,病重时不摄食,死亡迅速,且死亡率高 (图1-A),发病面积达养虾面积的40%。剖检发现,其头胸甲甲壳内侧有白斑 (图1-B),头胸甲易剥离,且甲壳与真皮不黏连,肝胰脏颜色较浅,空肠空胃或肠内食物不连续。
2.2细菌的分离与鉴定
2.2.116S rDNA鉴定 从病虾样品中分离出1株优势菌株,优势度为50%,命名为QD1。采用通用引物扩增菌株QD1的16S rDNA,获得大小为1465 bp的目的片段,PCR产物经与GenBank中数据作BLAST比对,菌株QD1与气单胞菌属Aeromonas的一致性达100%。
2.2.2双重PCR检测 将菌株QD1进一步进行嗜水气单胞菌特异性基因和气溶素基因的双重PCR检测,发现该菌在252 bp和685 bp处均出现清晰条带。说明分离菌株为致病性嗜水气单胞菌Aeromonas hydrophila。

图1 患病对虾的临床症状Fig.1 Clinical symptoms of the diseased shrimp
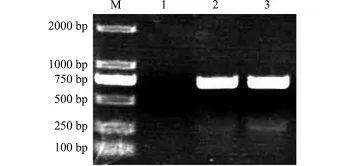
图2 双重PCR扩增分离菌株的特异性基因和气溶素基因的琼脂糖电泳结果Fig.2 Agarose elelectrophoresis of specific genes and aerolysin gene from an isolate by dual PCR and 16S rDNA
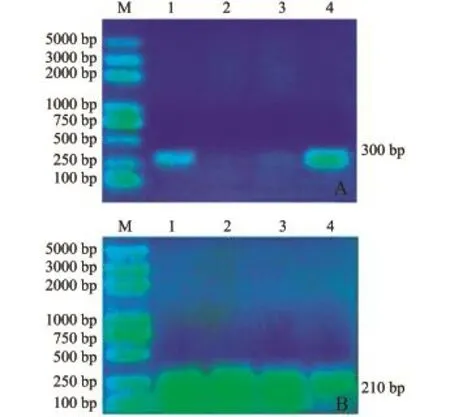
图3 WSSV和TSV检测结果Fig.3 Testing results of WSSV and TSV
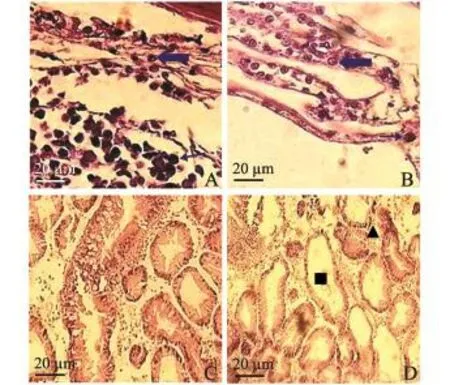
图4 患病对虾细胞病变组织的显微结构Fig.4 Microstructure of cell lesions in diseased shrimp
2.3病毒检测
WSSV和TSV特异性扩增产物分别为300 bp 和210 bp的全长基因片段,样品组和阳性对照组在其目的条带处均出现亮带 (图3)。但TSV样品组条带弥散,为进一步确定是否为TSV,经对RTPCR产物进行胶回收,连接T载体转化到DH5α后进行测序,测序结果通过BLAST软件与已知TSV进行比对,结果发现,其与AY826058.1一致性达到99%,可判定为阳性;IHHNV 3对特异性引物的扩增产物在目的条带处均没有出现亮带。
2.4组织病理观察
患病凡纳滨对虾的胃上皮细胞和结缔组织、鳃组织中存在大量膨大及浓染的特异性病变核(图4-A、B),但组织结构比较完整;病轻的个体肝胰腺组织结构尚清晰,肝胰腺上皮细胞及肝胰腺管之间的结缔组织结构基本完好,只有个别的肝小管破碎,而病情较重的病虾多数肝胰腺上皮细胞出现严重萎缩,管腔变大,分泌细胞严重减少或不见,部分肝细胞坏死,甚至自溶,肝胰腺管之间结缔组织中血细胞明显增多 (图4-C、D);中肠上皮细胞结构基本完好,附肢组织切片未见明显病理变化。
2.5人工感染试验
人工感染试验结果表明,试验组第一天就开始出现死亡,2天内致死率为100%,说明菌株毒力较强,而对照组未出现任何症状。
2.6药敏试验
从患病凡纳滨对虾分离出的优势菌株对16种抗菌药物的敏感性结果统计见表1。结果表明,该菌对氟哌酸等喹诺酮类、庆大霉素等4种药物较为敏感,对氟苯尼考、吡哌酸等4种药物中度敏感,对先锋V、四环素、利福平等8种药物不敏感。
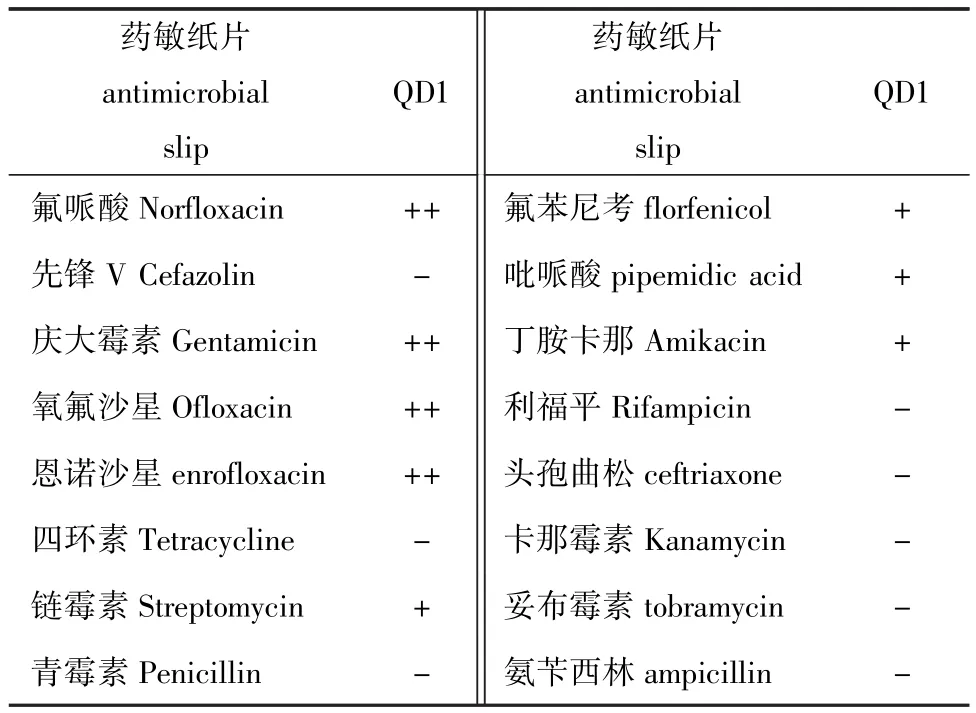
表1 分离菌对药物的敏感性Tab.1 Sensitivity of the pathogenic bacteria to drugs
3 讨论
本研究中的凡纳滨对虾病虾头胸甲甲壳内白斑明显,头胸甲甲壳极易剥离且不与下面的真皮黏连、空胃且消化道内无食物,在病虾鳃组织样品中检测出WSSV和TSV病毒,说明病虾已感染对虾白斑征病毒和桃拉病毒。但无论是PCR结果还是病理切片结果均显示,WSSV病毒感染更严重。病虾的临床症状未显示出体表具无规则的斑点、坏死灶或甲壳变黑等桃拉病的特殊病理特征[10];病虾身体发红,尤其附肢、游泳足、尾扇变红,但这一症状并非对虾桃拉病所特有,凡纳滨对虾在感染WSSV病毒和细菌时均呈现红体症状[11];病理组织切片则显示,尽管鳃、胃已有大量的组织和细胞感染WSSV病毒,其特征性的病变核在上皮和结缔组织中随处可见,但在鳃、胃、附肢和后肠未见上表皮坏死,也未见 “胡椒粉状”或 “散弹状”病灶[12]。PCR检测结果与临床症状和组织病理观察结果吻合,因此,可认为病虾感染WSSV病毒更严重;在病虾体内分离到优势度很高的嗜水气单胞菌,毒力基因检测显示,该菌具有气溶素基因,是致病菌,人工感染试验验证其致病性很强。综上,推测此次对虾大量发病死亡的原因是WSSV和TSV两种病毒与嗜水气单胞菌混合感染所致。
近年养殖的凡纳滨对虾中,WSSV病毒的感染较普遍,但如果养殖环境控制较好,养殖管理规范,即使感染病毒的对虾也可以不发病或发病较轻,其死亡率往往与养殖环境和养殖管理水平呈反比[13]。王利强[14]也认为,凡纳滨对虾对WSSV病毒有一定抵抗力,仅感染WSSV病毒的凡纳滨对虾,在对虾幼体、环境等条件正常的情况下不会造成高死亡率。中国北方7月雨水较少,养殖水体盐度偏高,水温急剧升高,养殖环境变化较大,被病毒感染的凡纳滨对虾抵抗力下降,嗜水气单胞菌的感染加速了对虾的大量死亡。嗜水气单胞菌的致病范围很广,虾类也是其主要的感染对象之一[15]。20世纪90年代就有学者报道,嗜水气单胞菌可导致中国对虾和红螯螯虾患败血症[16-17]。学界一般认为,嗜水气单胞菌主要感染淡水鱼类,但作者从海水养殖的凡纳滨病虾样本中分离出优势度很高的嗜水气单胞菌,且致病性很强,应在养殖凡纳滨对虾过程中重点防控。
病理切片结果显示,病虾肝胰腺病变较严重。病情较重的病虾肝胰腺上皮细胞出现严重萎缩,上皮细胞变矮,管腔变大,分泌细胞严重减少或不见,部分肝细胞坏死,说明病虾肝功能严重降低,肝胰腺管之间结缔组织中血细胞明显增多,应该是机体对细菌入侵的防御性反应结果。上述病理变化与早期死亡综合征病虾的肝胰腺病理变化相似[18]。作者认为,WSSV和TSV病毒均不会引起肝胰腺大量病变和坏死,本次病虾肝胰腺病变主要由嗜水气单胞菌感染所致,是气单胞菌分泌的外毒素[19]引起组织严重变性和坏死的结果。显然,致病性较强的细菌感染,均能引起肝胰腺病变,进而导致虾体抵抗力急速降低,代谢水平严重下降,直至新陈代谢停止,引起死亡。因此,在凡纳滨对虾养殖过程中,对不同区域和不同养殖阶段的各种病例应进行及时、综合、准确诊断,尤其对养殖苗种及养殖过程中对虾携带的病原应及时跟踪监测,为养殖生产制定出有效的防控措施。
参考文献:
[1]向赟,吴宇学,王刚,等.不同温度下哈维氏弧菌和白斑综合征病毒对凡纳滨对虾的致病性[J].大连海洋大学学报,2015,30 (1):56-61.
[2]Tang K F J,Lightner D V.Homologues of insecticidal toxin complex genes within a genomic island in the marine bacterium Vibrio parahaemolyticus[J].FEMS Microbiology Letters,2014,361(1):34-42.
[3]Han J E,Tang K F J,Tran L H,et al.Photorhabdus insect-related (Pir)toxin-like genes in a plasmid of Vibrio parahaemolyticus,the causative agent of acute hepatopancreatic necrosis disease(AHPND)of shrimp[J].Diseases of Aquatic Organisms,2015,113 (1):33-40.
[4]赵永锋,宋迁红.南美白对虾养殖概况及病害防控措施[J].科学养鱼,2014(7):13-17.
[5]Stentiford G D,Neil D M,Peeler E J,et al.Disease will limit future food supply from the global crustacean fishery and aquaculture sectors[J].Journal of Invertebrate Pathology,2012,110(2):141-157.
[6]王奕玲,李卓佳,张家松,等.高位池养殖过程凡纳滨对虾携带WSSV情况的动态变化[J].中国水产科学,2012,19(2):301-309.
[7]乔毅,沈辉,万夕和,等.1株黑鲷致病性假交替单胞菌的鉴定及毒力基因分析[J].江苏农业科学,2015,43(4):229-233.
[8]王友娟,李荣峰,李华,等.辽宁地区养殖淡水鱼感染嗜水气单胞菌的流行病学调查[J].中国农业科技导报,2012,14(4):128-134.
[9]刁菁,杨秀生,李天保,等.病原微生物药敏检测方法的研究进展[J].中国农学通报,2013,29(8):1-5.
[10]陈颜锋.如何减轻南美白对虾桃拉综合征的危害[J].科学种养,2012(7):50.
[11]陈健舜,朱凝瑜,孔蕾,等.凡纳滨对虾细菌性红体病病原的分子特征与耐药性[J].水产学报,2012,36(12):1891-1900.
[12]刘飞.中国大陆几株WSSV毒株毒力测定及分析[D].青岛:中国海洋大学,2013:1-57.
[13]Tsai Y L,Wang H C,Lo C F,et al.Validation of a commercial insulated isothermal PCR-based POCKIT test for rapid and easy detection of white spot syndrome virus infection in Litopenaeus vannamei[J].PLoS One,2014,9(3):e90545.
[14]王立强.白斑病毒(WSSV)和桃拉病毒(TSV)对凡纳滨对虾(Litopenaeus vannamei)的混合感染[D].青岛:中国海洋大学,2005.
[15]冯守明.嗜水气单胞菌对水生动物的致病作用及防治[J].天津水产,2002(1):19-23.
[16]樊海平,孟庆显,俞开康.中国对虾败血病病原菌(气单胞菌)的致病性与生物学性状[J].水产学报,1994,18(1):32-38.
[17]霍国才.红螯螯虾消化系统细菌病病原的研究[J].内陆水产,1997(12):21-24.
[18]倪军.对虾“早期死亡综合征”研究现状[J].海洋与渔业,2014(12):74-75.
[19]胡萌.江苏地区气单胞菌分离鉴定及强毒株生物学特性分析[D].南京:南京农业大学,2012:1-93.
中图分类号:Q954.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.03.005
文章编号:2095-1388(2016)03-0256-05
收稿日期:2015-09-16
基金项目:辽宁省海洋渔业厅重点攻关项目 (201402)
作者简介:姚洪 (1991—),男,硕士研究生。E-mail:1575559024@qq.com
通信作者:李华 (1958—),女,博士,教授。E-mail:lihua@dlou.edu.cn大豆琼脂 (TSA),以平板划线法从患病对虾心脏、肝胰腺等部位分离细菌,在28℃下培养48 h,观察细菌生长情况。取优势菌纯化3次,置于装有20%甘油的营养肉汤培养基中,于超低温冰箱(-80℃)中保存备用。
A pathogen in mass death of Pacific white leg shrimp Litopenaeus vannamei in Liaoning Province
YAO Hong1,ZHANG Ji-peng1,YANG Chuan1,ZHANG Li-juan1,PIAO Yuan-zhi2,LIU Yue-fen2,YE Shi-gen1,LI Hua1
(1.Key Laboratory of Mariculture&Stock Enhancement in North China’s Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China;2.Panjin Fisheries Technique Extending Station,Panjin 124010,China)
Abstract:In this paper,white spot syndrome virus(WSSV),Taurus virus(TSV),Infectious hypodermal,hematopoietic necrosis virus(IHHNV)and pathogenic bacterium Aeromonas hydrophila were identified in diseased and mass death of Pacific white leg shrimp Litopenaeus vannamei collected from Panjin region in Liaoning Province with specific primer after extracting DNA/RNA from gill tissue,16S rDNA sequencing and double PCR identification in specific primer and aerolysin gene of the pathogenic bacterium was identified to classify strain QD1.The tissue pathological observation was carried out on gills,stomach,hepatopancreas and appendages of the diseased shrimps. The results showed that WSSV and TSV were positive to the disease,and that the isolated strain was proved to be classified as Aeromonas hydrophila which led to the shrimp death by artificial challenged.Histopathological observation revealed that there was a large number of nuclei of WSSV in gill and stomach of the diseased shrimp.The severe atrophical epithelial cells,larger lumen,part of the hepatic cell necrosis and blood cells were observed in the hepatopancreas of the diseased shrimp.Comprehensive analysis confirmed that it is the mixed infection of 2 species of virus and Aeromonas hydrophila in a large number of Pacific white leg shrimp death.
Key words:Litopenaeus vannamei;WSSV;TSV;Aeromonas hydrophila;histopathology
