响应面法优化黄山贡菊浸提工艺
2016-07-21王琦郭艳明韩建群李明霞张公杭董明
王琦,郭艳明,韩建群,李明霞,张公杭,董明,2*
1(安徽农业大学 茶与食品科技学院,安徽 合肥,230036) 2(合肥市农产品加工研究院,安徽 合肥,230036)3(安徽黄山树德堂食品饮料有限公司,歙县,245200)
响应面法优化黄山贡菊浸提工艺
王琦1,郭艳明1,韩建群1,李明霞1,张公杭3,董明1,2*
1(安徽农业大学 茶与食品科技学院,安徽 合肥,230036)2(合肥市农产品加工研究院,安徽 合肥,230036)3(安徽黄山树德堂食品饮料有限公司,歙县,245200)
摘要以黄山贡菊为材料,以浸提温度、料液比、浸提时间为主要影响因素,对贡菊浸提工艺进行探索。在单因素试验基础上,通过Box-Benhnken中心组合设计试验,以浸提液中总黄酮含量(R1)、绿原酸含量(R2)、香气成分百分含量(R3)为响应值对浸提工艺优化。响应面法分析结果表明最佳浸提温度为92 ℃、料液比为1∶75(g∶mL),浸提时间为24 min,在此条件下进行验证试验,浸提液中的总黄酮、绿原酸、香气成分百分含量分别达到4.917 g/100 g、0.417 g/100 g和85.024%。
关键词黄山贡菊;水浸提;响应面法分析;总黄酮;绿原酸;香气成分
菊花为菊科菊属宿根性草本植物[1],全国各地均有分布。除观赏外,亦具有药用、食用价值。其中,黄山贡菊因具有疏风散热、抗菌消炎、养肝明目的功能,可治伤风感冒、疗疮肿毒、血压偏高等症[2-5],其药食同源的特性,深受人们喜爱。
经多年来研究发现,贡菊含有较丰富的功能性成分,其中具有代表性的黄酮类化合物多达6.35 g/100 g、绿原酸为0.38 g/100 g[6],其氨基酸[7-8]种类丰富且含量较高。此外,贡菊香气成分丰富,主要含烯萜类化合物如石竹烯、金合欢烯、β-榄香烯等,其次还有芳烃类衍生物、醛酮类、杂环类化合物等[9-10]。
浸提技术是植物饮料加工过程中的关键技术之一[11],此步骤中有效成分的提取率直接影响成品饮料中营养成分和产品质量。已有报道的菊花原料浸提研究,多为杭白菊和滁菊,一般采用水浸提或醇浸提;浸提温度过高、浸提时间过长会导致原料的营养成分破坏,反之会出现营养成分溶出不完全的情况[12],尤其是浸提温度、时间、料液比对菊花的香气成分有很大影响,导致原料中营养成分和香气成分的提取率无法达到最大化。目前,对黄山贡菊为原料的浸提技术研究报道甚少。因此,本文通过对浸提温度、料液比、浸提时间3种工艺参数的优化,探寻最佳浸提工艺参数,使得贡菊提取液中总黄酮、绿原酸和香气成分的含量最大,为后续制作功能性成分高、贡菊香气浓郁的成品饮料提供技术基础。
1材料与方法
1.1实验材料
菊花:黄山贡菊,由安徽黄山树德堂食品饮料有限公司提供,密封包装冷库贮存。
芦丁标准品,绿原酸标准品,NaNO2、Al(NO2)3、NaOH、无水乙醇(均为分析纯),乙腈、乙酸(均为色谱纯)。
分析天平(MS205DU METTLER TOLEDO);HH-6数显恒温水浴锅,金坛市杰瑞尔电器有限公司;DC-NSG-05多功能提取浓缩机组,上海达程实验设备有限公司;离心机(Anke DL-5-B);UV-5800PC可见分光光度计;高效液相色谱仪(Waters 1525),附紫外检测器(Waters 2489);7890 GC-System气相色谱仪,美国安捷伦公司;5975C质谱仪,美国安捷伦公司。
1.2单因素试验设计
本次浸提试验在实验室中进行,利用水浴锅加热达到试验所需温度,通过不同的浸提温度、保持不同的浸提时间、向烧杯中添加不同料液比来进行水浸提。
单因素试验研究过程中,每次改变1个单因素,其他因素条件不变。以浸提液的总黄酮含量和绿原酸含量为评价指标,每因素每水平重复检测3次。
(1)浸提温度的影响:以料液比为1∶75(g∶mL),浸提时间为20 min,来探索贡菊在75、80、85、90、95 ℃下的最佳浸提温度。
(2)浸提时间的影响:以料液比为1∶75,浸提温度为90 ℃,来探索贡菊在20、22、24、26、28 min下的最佳浸提时间。
(3)料液比的影响:以浸提温度为90 ℃,浸提时间为24 min,来探索贡菊在1∶65、1∶70、1∶75、1∶80、1∶85下的最佳浸提料液比。
1.3响应面试验设计
根据单因素试验结果,采用Design-Expert8.0软件中Box-Benhnken中心组合试验设计,对浸提温度、料液比、浸提时间(分别以A、B、C表示)进行3因素进行3水平试验,具体试验水平及编码见表1。以浸提液中总黄酮含量(R1)、绿原酸含量(R2)、香气成分百分含量(R3)为响应值来评价浸提效果的好坏。
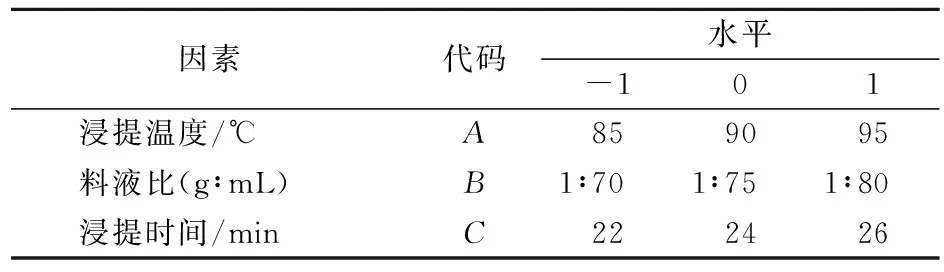
表1 实验因素与水平表
以响应面法分析得出的最佳浸提条件,在多功能提取机上浸提,进行验证试验,并检测浸提液中的R1、R2、R3含量。
1.4检测方法
1.4.1总黄酮测定[13]
精密称取芦丁对照品0.01 g,用60%乙醇溶解并定容于10 mL容量瓶中,混匀。依次配成浓度为0、50、100、150、200、250、 300、 350、 400、 450、 500、 550、 600、650 μg/mL的对照品溶液。取待测溶液(或对照品溶液) 1 mL,参照DB13/T385—1998方法进行检测,用1 mL 60%乙醇代替待测溶液配制成空白溶液。510 nm下测吸光度,平行3次取平均值。以测得Y吸光度对芦丁浓度X(μg/ml)进行线性回归,回归方程为Y=0.000 5X-0.0021,R2=0.999 4。方法的线性范围为0~80 μg/mL。

(1)
1.4.2绿原酸检测方法[14]
参照GB/T 22250—2008制备绿原酸标准溶液及对液体试样的处理方式进行HPLC检测。以测得Y峰面积对绿原酸标准溶液浓度X(μg/mL)进行线性回归,回归方程为Y=20 731X-13 433,R2=0.999 5。方法的线性范围为0~80 μg/mL。色谱条件为:Gemini C18色谱柱(250 mm×4.6 mm,5 μm);紫外检测器,检测波长327 nm;流速1.0 mL/min;柱温:30 ℃;进样量:10 μL;流动相A:0.5%CH3COOH/H2O,流动相B:CH3CN,流动相梯度条件见表2。绿原酸对照品及贡菊浸提液中绿原酸的出峰时间见图1和图2。
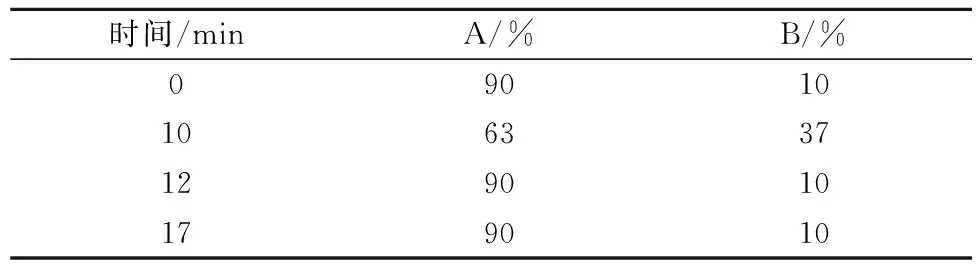
表2 流动相梯度条件

(2)
图1 绿原酸对照品Fig.1 Chlorogenic acid reference substance

图2 贡菊浸提液Fig.2 Chrysanthemums extracting liquor
1.4.3香气成分检测[9]
称取0.5 g样品于采样瓶中,按照响应面中浸提时间、浸提温度、料液比来提取浸提液。采用顶空固相微萃取法,用空固相微萃取头吸附40 min,在GC-MS进样口处解吸附5 min后参考沈维治[9]等检测菊花香气成分的GC-MS条件进行GC-MS检测分析。
结合NIST11.L谱库和CAS编码对质谱图进行检索和人工分析,确定各峰名称。以各香气成分的总峰面积与所测得的总峰面积之比表示香气成分的百分含量。
2结果与分析
2.1单因素试验结果
2.1.1浸提温度的影响
图3反映的是总黄酮含量和绿原酸含量随浸提温度变化的影响趋势。由图3可知,随着浸提温度的升高,浸提液中总黄酮含量随温度的升高先升高后下降,在90 ℃时含量最高;随着温度的升高,浸提液中绿原酸含量先呈上升趋势,在85 ℃时上升速率明显加快,在90 ℃时含量达到最高,然后小幅下降。综合比较,浸提温度为90 ℃为最佳,此时,黄酮含量与绿原酸含量均为最高。
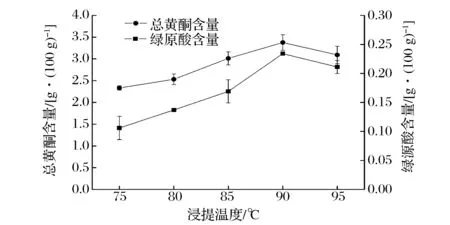
图3 浸提温度对总黄酮含量和绿原酸含量的影响Fig.3 Extraction temperature influence on total flavones and chlorogenic acid content
2.1.2浸提时间的影响
图4为浸提时间对总黄酮含量和绿原酸含量的影响。
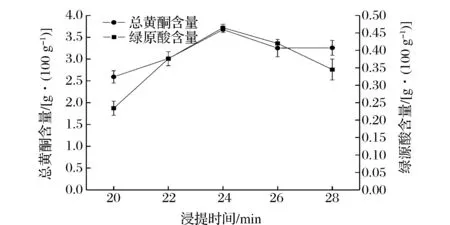
图4 浸提时间对总黄酮含量和绿原酸含量的影响Fig.4 Extraction time influence on total flavones and chlorogenic acid content
如图4所示,总黄酮含量随着时间的增加先上升后下降然后趋近于平稳,在24 min时浸提液中总黄酮含量达到最大;绿原酸含量随着时间的增加呈现先上升后下降的趋势,且趋势幅度较大,于24 min时到达最大值。综合结果,确定浸提时间24 min为最佳。
2.1.3浸提料液比的影响
图5反映料液比对浸提液中总黄酮含量和绿原酸含量的影响。如图5所示,总黄酮含量随料液比的加大而先升高后基本趋于平稳并伴随缓慢下降,在1∶75和1∶80处含量基本一致并达到最大;而绿原酸含量随料液比的加大呈明显的先上升后下降趋势,在1∶75时达到最大值。综合考虑,选取1∶75为浸提的最佳料液比。
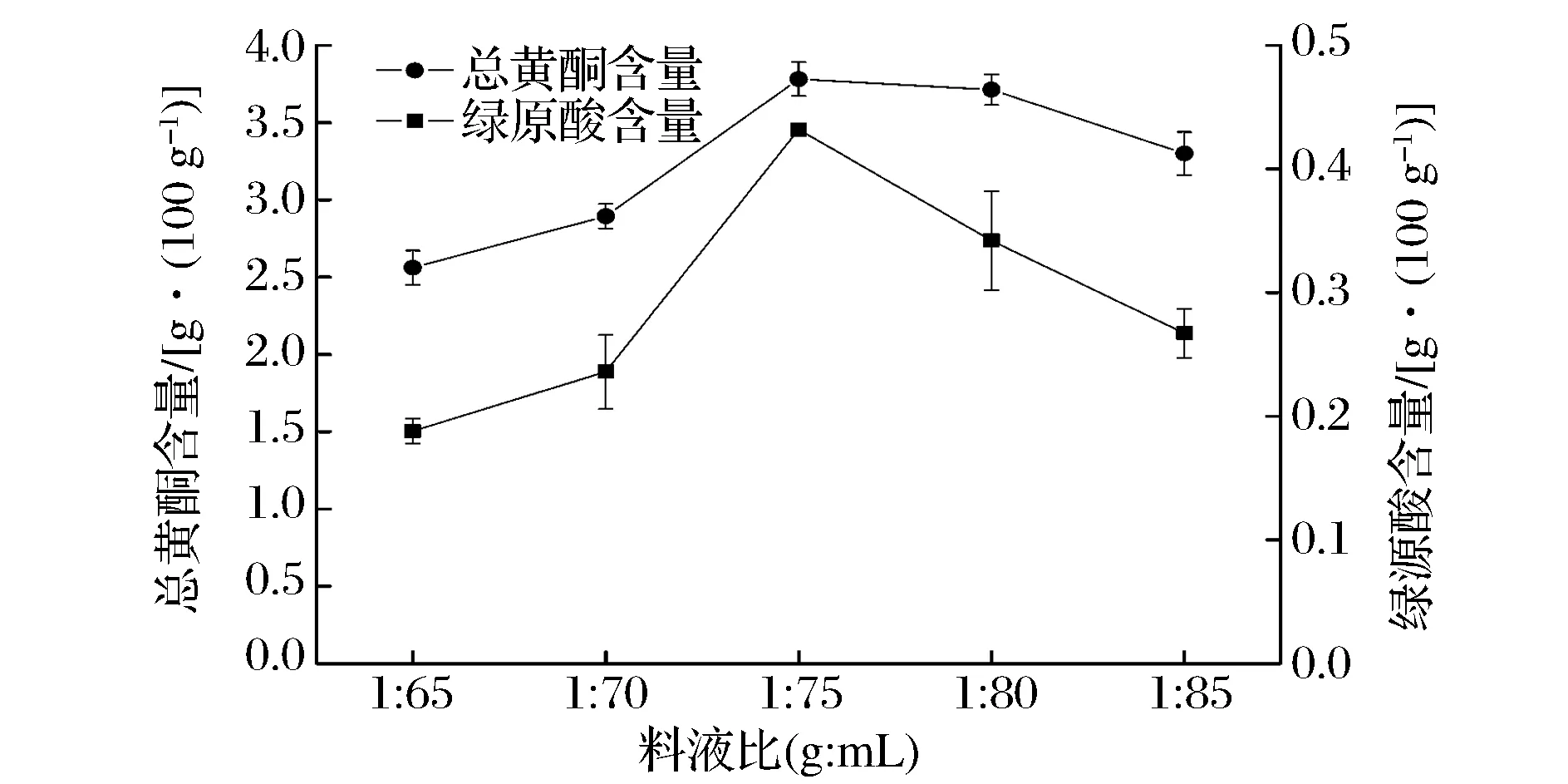
图5 料液比对总黄酮含量和绿原酸含量的影响Fig.5 Ratio of material and water influence on total flavones and chlorogenic acid content
2.2响应面试验结果
根据单因素试验结果,浸提温度选择85、90、95 ℃共3个水平,料液比选择1∶70、1∶75、1∶80共3个水平,浸提时间选择22、24、26 min共3个水平。以总黄酮含量、绿原酸含量、香气成分(百分比)为评价指标进行响应面试验。表3为试验设计的方案及实验结果。3个响应值的方差分析见表4~表6。3个响应值的3因素交互作用的响应面图见图6~图8。
表4~表6的方差分析显示,模型的P值分别为0.003 5、0.003 3、0.008 8,均为极显著(P<0.01),失拟相均为不显著(P>0.05),可知此3个响应值对模型的影响极显著,有统计学意义。由表4和图6可知,影响浸提液中总黄酮含量的3个因素由大到小为C(浸提时间)、A(浸提温度)、B(料液比),其中A、C因素影响显著,交互项BC、B2极显著,C2影响显著;由表5和图7分析可知,影响浸提液中绿原酸含量的因素从大至小为A、B、C,其中A、B为极显著,C为影响显著,交互项AB、B2、C2对响应值影响显著,而A2对其影响为极显著。由表6及图8分析可知,影响浸提液的香气成分百分含量的因素从大到小为A、B、C,其中A为极显著,B、C为显著影响,交互项AC对香气成分百分比的影响为极显著,AB、A2达到显著影响。
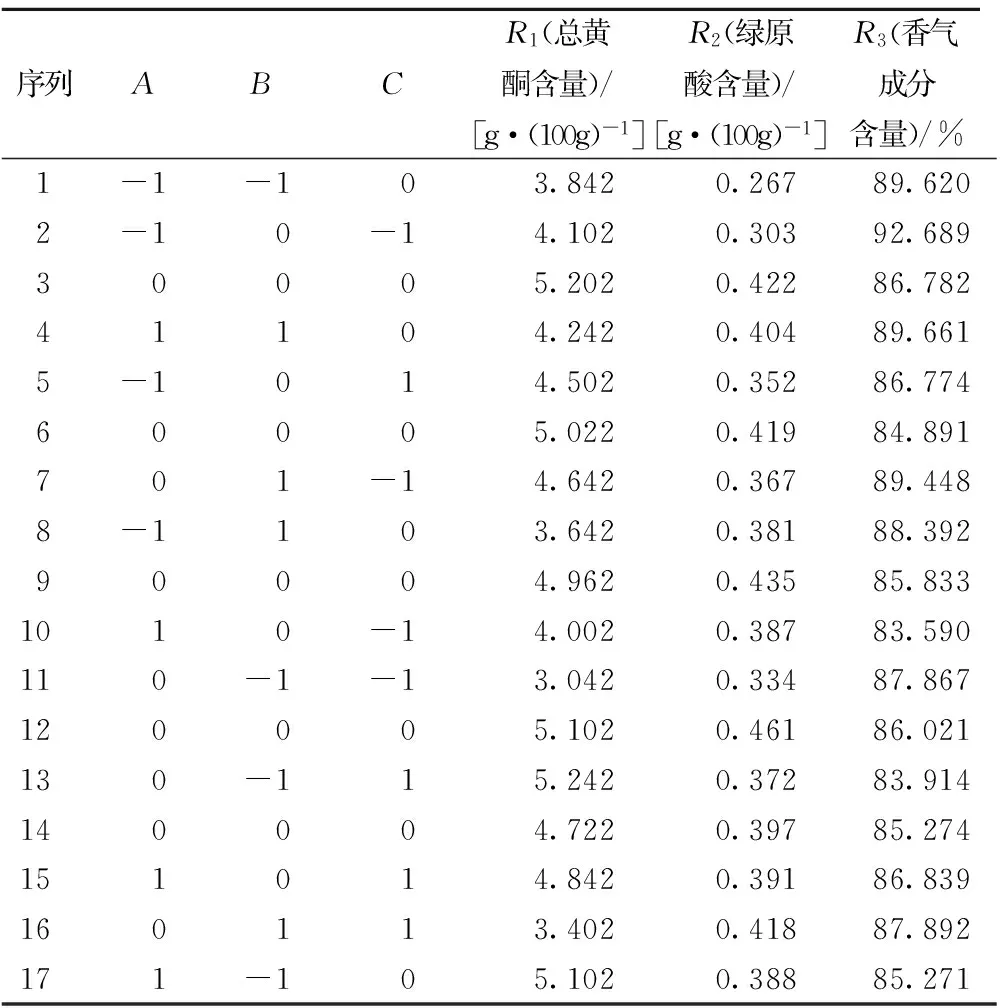
表3 贡菊浸提液总黄酮含量、绿原酸含量和香气
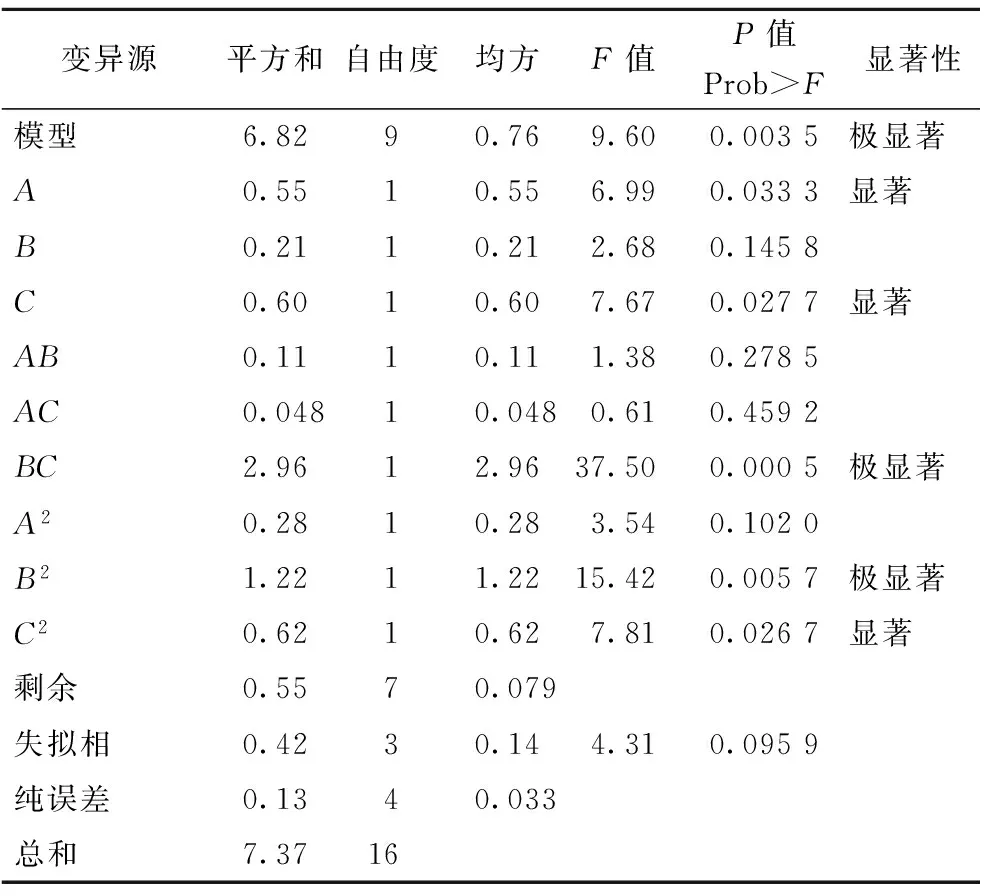
表4 R1总黄酮含量实验结果方差分析表
经Design-Expert.V.8软件分析,3因素拟合后总黄酮含量(R1)、绿原酸含量(R2)和香气成分百分含量(R3)的回归方程如下:
总黄酮含量(R1)=+5.00+0.26×A+0.16×B+0.27×C+0.16×A×B+0.11×A×C+0.86×B×C-0.26A2-0.54×B2-0.38×C2
绿原酸含量(R2)=+0.43+0.033×A-0.026×B+0.018×C+0.025×A×B-0.011×A×C-3.250E-003×B×C-0.041×A2-0.026×B2-0.028×C2
香气成分百分含量(R3)==+85.76-1.48×A-1.06×B-1.02×C-1.34×A×B+2.29×A×C-0.60×B×C+1.37×A2+1.18×B2+0.35×C2
3个方程的R2分别为0.925 0、0.926 0和0.900 3,均接近1,说明模型与试验拟合度好,可以用此方程对试验的响应值进行预测。
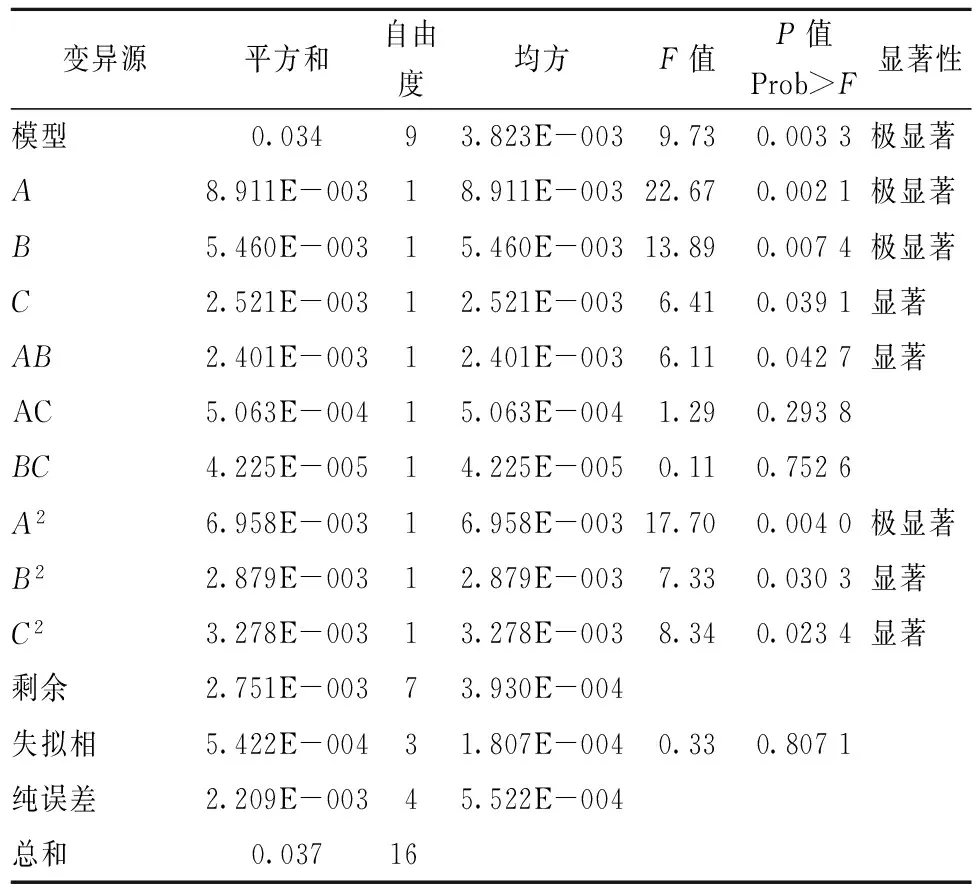
表5 R2绿原酸含量实验结果方差分析表
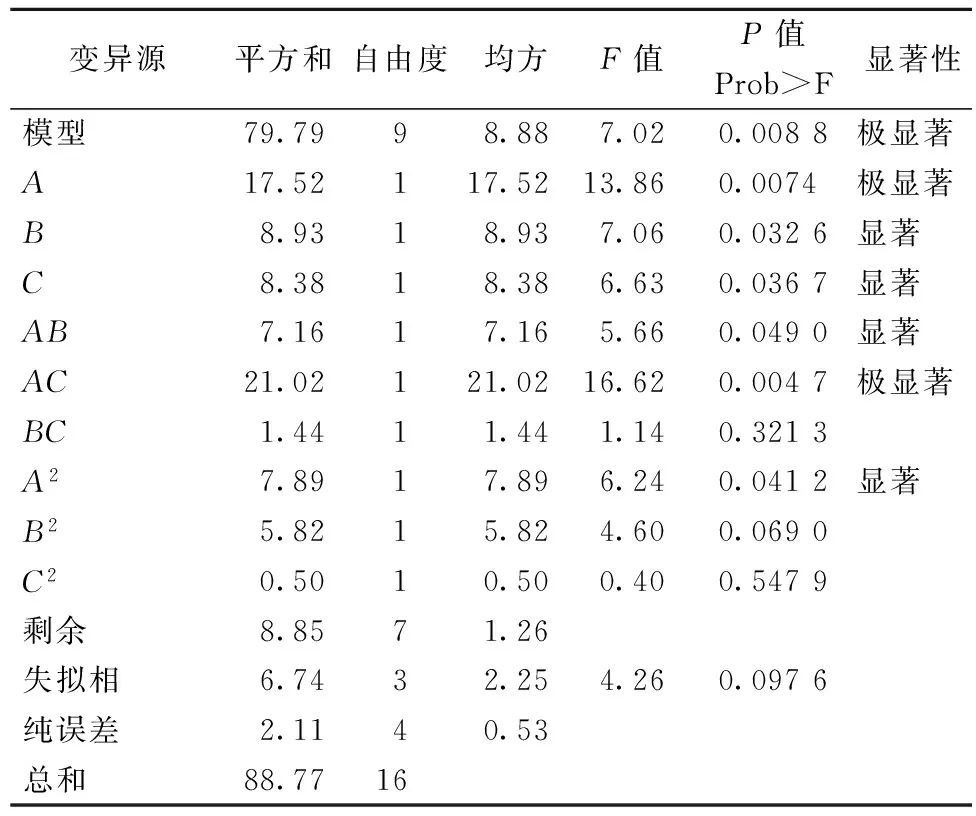
表6 R3香气成分百分含量实验结果方差分析表
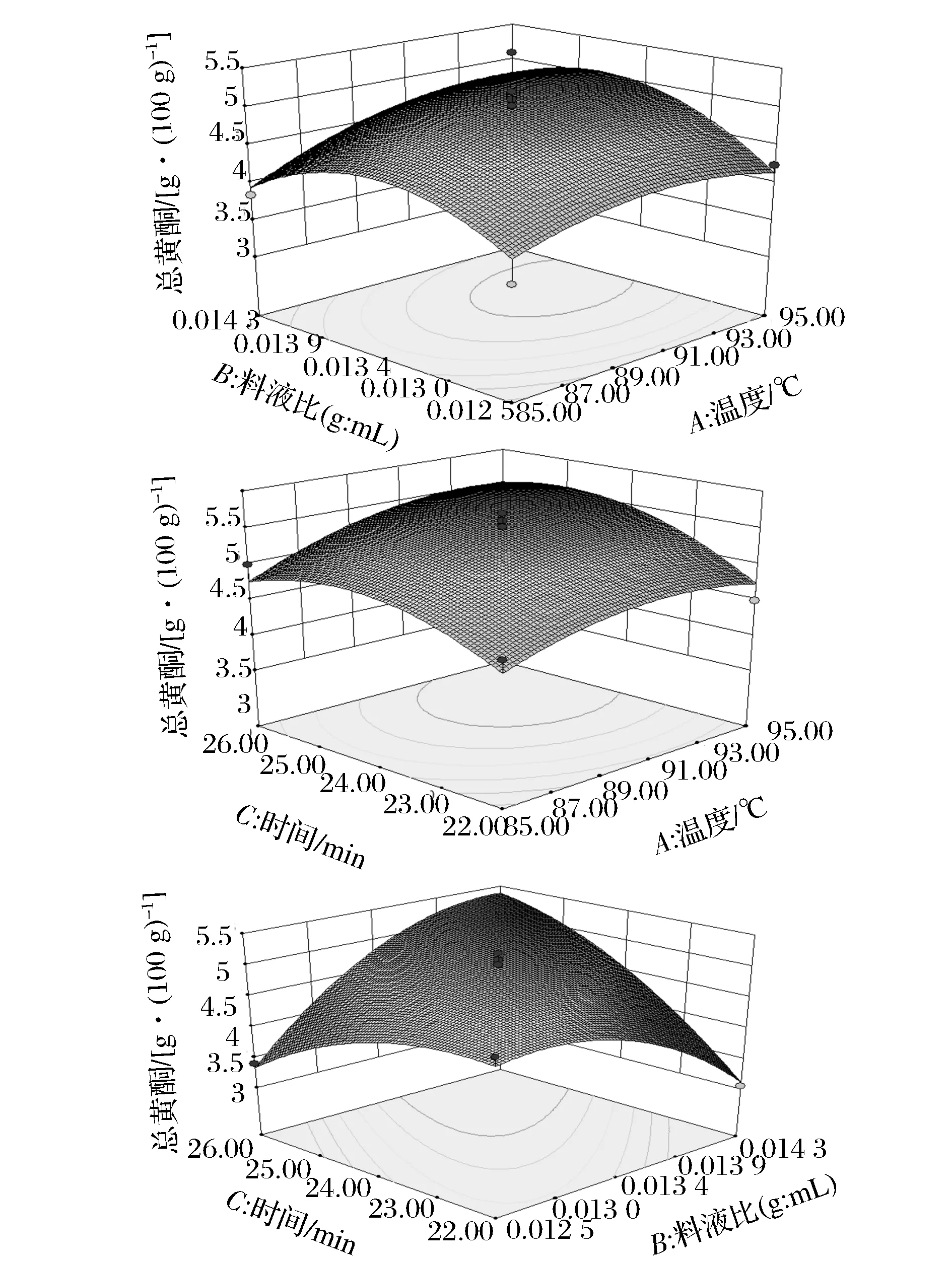
图6 R1=f(A,B)、f(A,C)、f(B,C)的响应面图Fig.6 R1=f(A,B)、f(A,C)、f(B,C) response surface
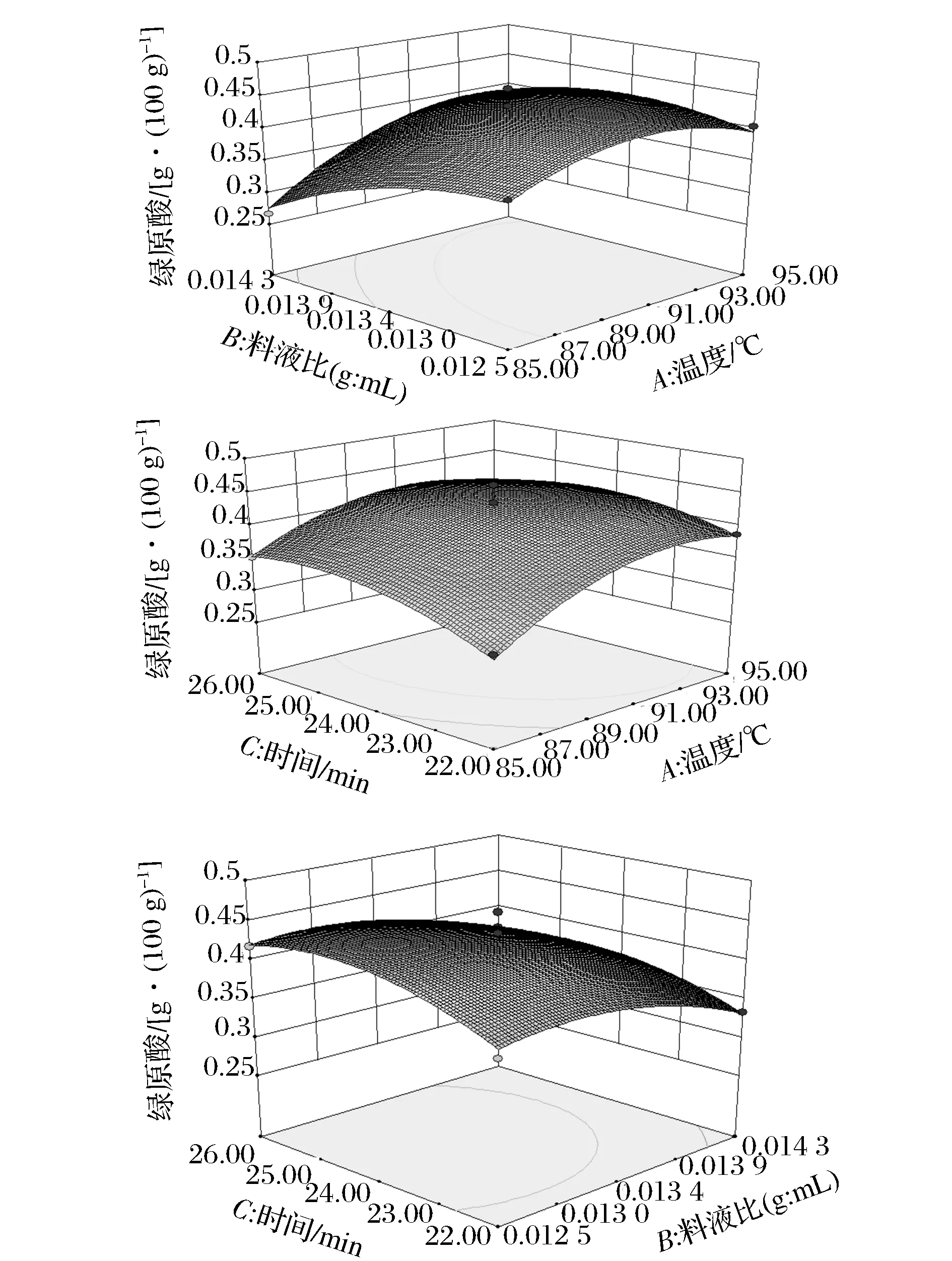
图7 R2=f(A,B)、f(A,C)、f(B,C)的响应面图Fig.7 R2=f(A,B)、f(A,C)、f(B,C) response surface
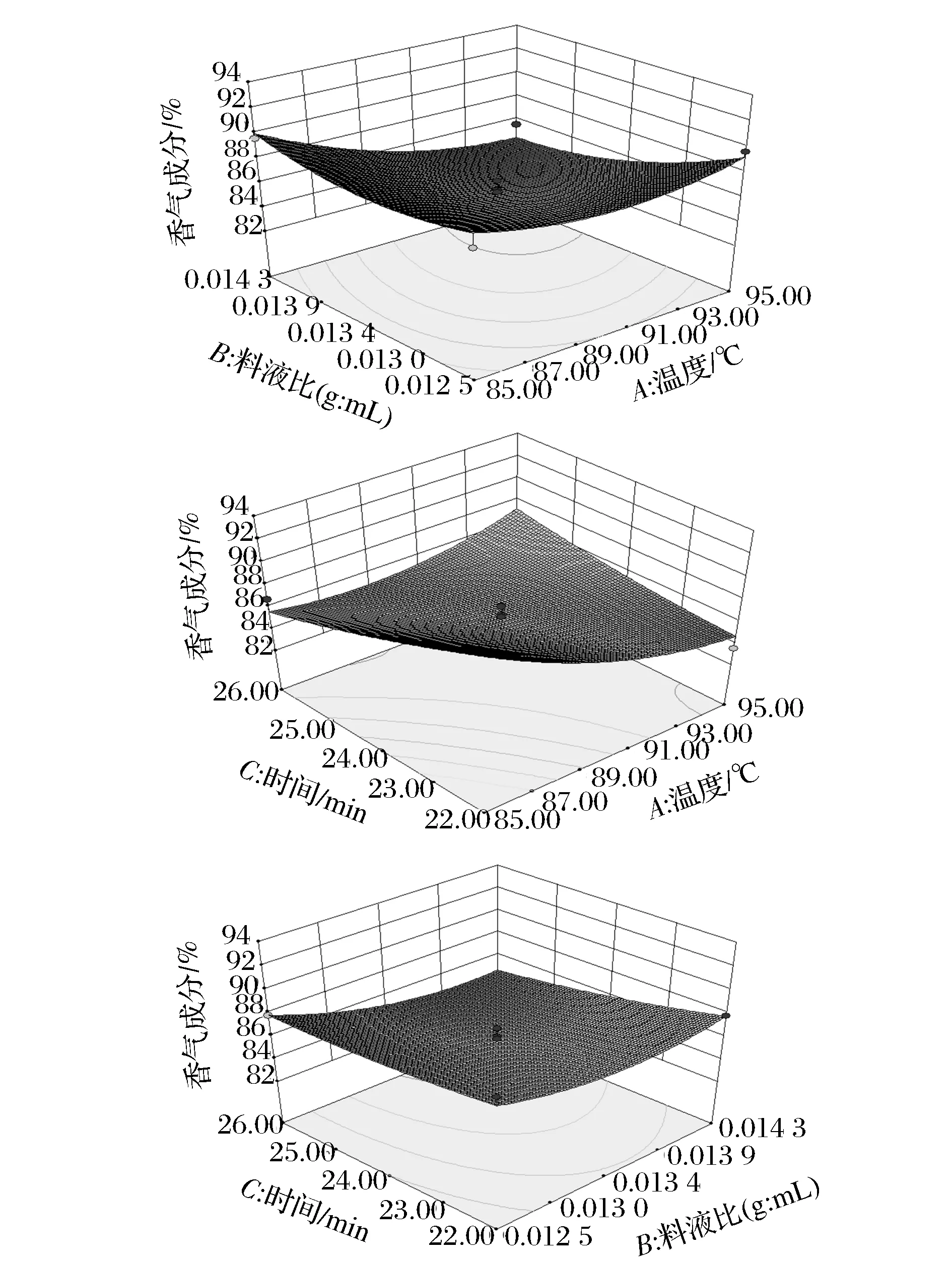
图8 R3=f(A,B)、f(A,C)、f(B,C)的响应面图Fig.8 R3=f(A,B)、f(A,C)、f(B,C) response surface
3结论
经响应面软件分析,贡菊饮料最佳浸提工艺为浸提温度91.91 ℃、料液比1∶75.19、浸提时间为24.06 min。从方便控制条件与实际操作角度考虑,最佳的浸提工艺为浸提温度92 ℃、料液比1∶75、浸提时间24 min。此条件下进行验证试验,测得R1值为4.917 g/100 g、R2值为0.417 g/100 g、R3值为85.024%,与模拟值5.036 g/100 g、0.436 g/100 g和85.595%接近,可证明此模型可靠。
参考文献
[1]张育松.清热明目——菊花茶[J].茶叶科学技术,2007(1):35.
[2]国家药典委员会中华人民共和国药典年版一部[M].北京:化学工业出版社,2005.
[3]张清华,张玲.菊花化学成分及药理作用的研究进展[J].食品与药品,2009,9(2A):60-63.
[4]张健,钱大玮,李友宾,等.菊花的化学成分研究[J].天然产物研究与开发,2006,18(1):71-73.
[5]胡晓倩,陈乐.黄山贡菊叶中总黄酮提取物的抗氧化性研究[J].农业现代化研究,2010,31(5):638-640.
[6]贺曼曼.不同品种菊花成分分析及挥发油研究[D].合肥:安徽农业大学,2011:25-26.
[7]曾羽.不同海拔菊花氨基酸组分分析及营养价值评价[J].食品与发酵工业,2014,40(4):190-194.
[8]王庆兰,林慧彬,张素芹.不同菊花氨基酸含量的比较研究[J].中国中医药科技,2005,12(4).
[9]沈维治,邹宇晓,刘凡,等.顶空固相微萃取气质联用分析比较雪菊与市售菊花的挥发性成分[J].热带作物学报,2013,34(4):771-776.
[10]WANG Tao, GUO Qiao-sheng,MAO Peng-fei.Flavonoid accumulation during florescence in threeChrysanthemummorifoliumRamat cv. ‘Hangju’ genotypes[J].Biochemical Systematics and Ecology,2014,55:79-83.
[11]韦良东.黑蚂蚁成分分析与酶解法制备复合饮料工艺研究[D].合肥:安徽农业大学,2015:7-8.
[12]陈守江,刘仲君.菊花饮料的研制[J].食品工业科技,2006(3):112-113.
[13]DB13/T385—1998.食品中总黄酮(芦丁)的测定[S].
[14]GB/T 22250—2008.保健食品中绿原酸的测定[S].
The optimization of HuangshanChrysanthemumsextraction by response surface method
WANG Qi1, GUO Yan-ming1, HAN Jian-qun1, LI Ming-xia1,ZHANG Gong-hang3, DONG Ming1,2*
1(Tea and Food Technology Academy, Anhui Agricultural University, Hefei 230036, China)2(Hefei Agricultural products processing research, Hefei 230036, China)3(AnhuiHuangshan Shuter Tong Food and Beverage Limited Company,Shexian 245200,China)
ABSTRACTWith Huangshan Chrysanthemums as the raw material, and extraction temperature, ratio of material to water, and extraction time were selected as the main influence factors. Based on the single factor experiment and Box-Benhnken core combination, the total flavones content (R1), the chlorogenic acid content (R2) and the aroma component content (R3) were used as the response values to optimum extracting technology. The optimal extraction conditions were: temperature 92 ℃, the ratio of material and water 1∶75 , the extraction time 24 min. Under these conditions, conducting the verification test, the content of the total flavones, the chlorogenic acid and the aroma component content in the extracting liquor reached to 4.917, 0.417 g/100g and 85.024% , respectively.
Key wordsHuangshan Chrysanthemum; water extracting technology; response surface methodology; total flavones; chlorogenic acid; aroma component
DOI:10.13995/j.cnki.11-1802/ts.201606036
基金项目:安徽省大别山区农林特色产业协同创新中心项目资助
收稿日期:2015-10-21,改回日期:2015-12-22
第一作者:硕士研究生(董明副教授为通讯作者,E-mail:dongm58@163.com)。
