交联柚苷酶聚集体水解柚皮苷制备柚皮素
2016-07-20朱必玉王先锋高乾坤魏胜华
朱必玉,钱 伟,王先锋,杜 平,高乾坤,魏胜华,2∗
(1.安徽工程大学生物与化学工程学院,安徽芜湖 241000; 2.安徽工程大学微生物发酵安徽省工程研究中心,安徽芜湖241000)
交联柚苷酶聚集体水解柚皮苷制备柚皮素
朱必玉1,钱 伟1,王先锋1,杜 平1,高乾坤1,魏胜华1,2∗
(1.安徽工程大学生物与化学工程学院,安徽芜湖 241000; 2.安徽工程大学微生物发酵安徽省工程研究中心,安徽芜湖241000)
摘要:为了提高柚皮素的产率,简化分离提纯的工艺,得到较高纯度的柚皮素,采用交联柚苷酶聚集体水解柚皮苷制备柚皮素,以生成的柚皮素质量浓度和得率为优化指标.研究了底物质量浓度、温度、p H、加酶量、反应时间对制备柚皮素的影响,利用正交设计对水解过程进行优化,确定最佳工艺条件为底物质量浓度4.0 g/L、温度55℃、p H 3.0、加酶量18.0 mg/m L、反应时间24 h.优化后制备得到的柚皮素质量浓度为1.833 g/L,柚皮素得率为97.72%,为制备柚皮素提供了一种新的方法.
关 键 词:交联柚苷酶聚集体;柚皮素;水解反应;正交试验
柚皮素(naringenin)又名4',5,7-三羟基二氢黄酮,是柚皮苷水解掉一分子葡萄糖和鼠李糖得到的苷元,主要存在于芸香科植物葡萄柚、西红柿、葡萄以及柑橘类水果中.柚皮素在医药、食品行业具有重要的用途.国内外的药理研究表明,柚皮素具有抗炎、抗菌、抗氧化、抗纤维化、抗病毒、抗癌、抗心律失常、镇咳、预防动脉粥样硬化、保护肝功能等多种药理活性,同时可以作为食品中的香料添加剂,用于食用油及有苦味和辣味的食品[1-4].
目前,柚皮素的制备主要采用从天然植物中萃取、酸水解柚皮苷和酶法水解柚皮苷等方法[5-7].然而,从天然植物中萃取和酸水解法制备柚皮素存在产物纯度较低、生产成本较高等问题.利用游离柚苷酶水解柚皮苷制备柚皮素虽然生产成本较低,但产物的分离纯化工艺较为复杂.柚苷酶(EC 3.2.1.40)是由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成的复合酶[8],在酶解柚皮苷的过程中,α-L-鼠李糖苷酶首先将柚皮苷水解为普鲁宁和L-鼠李糖,然后在β-D-葡萄糖苷酶的作用下将普鲁宁水解为柚皮素和葡萄糖[9].交联酶聚集体(cross-linked enzyme aggregates,CLEAs)是一种无载体固定化方法,无需不溶性材料作为载体,直接使用双功能试剂将不同酶的聚集体进行交联而得到固定化酶的方法[10].交联柚苷酶聚集体具有良好的温度稳定性和酸碱稳定性[11],同时由于交联酶可以循环利用及利于从反应体系中分离等优点,对于提高柚皮素的产率和简化分离工艺有着重要的作用.通过正交设计优化,对交联柚苷酶聚集体酶法制备柚皮素的工艺进行了研究,为开发简便、低成本的柚皮素制备工艺提供实验参考.
1 材料与方法
1.1 材料与试剂
柚皮苷、柚皮素(纯度≥98%,西安小草植物科技有限责任公司);戊二醛、柠檬酸、Na2HPO4、Na2CO3、Na HCO3、叔丁醇(分析纯,国药集团化学试剂有限公司);乙腈(色谱纯,国药集团化学试剂有限公司);柚苷酶(实验室自制,Aspergillus awamori发酵).
1.2 仪器与设备
TD5Z型台式离心机(湖南凯达科学仪器有限公司);H H-6型数显恒温水浴锅(金坛市杰瑞尔电器有限公司);雷磁PHS-3C型精密p H计(上海精密科学仪器有限公司);FA-100精密电子天平(天津天马衡基仪器有限公司);低速台式离心机(湖南湘仪实验室仪器开发有限公司);AS1201高效液相色谱(大连依利特分析仪器有限公司).
1.3 交联柚苷酶聚集体的制备方法
取10 m L的柚苷酶发酵液于试管中,加入2倍体积的叔丁醇溶液,将酶液放置于4℃冰箱中沉淀30 min,向试管中加入2%(V/V)的戊二醛溶液交联1.5 h.交联完成后将沉淀在4 000 r/min条件下离心10 min,移去上清液,用10 m M p H 4.0的柠檬酸-磷酸氢二钠缓冲液溶液清洗3遍,将最终得到的沉淀物保存于4℃冰箱中,即获得交联柚苷酶聚集体.
1.4 优化方法
(1)单因素实验.交联柚苷酶聚集体水解柚皮苷的过程一般受底物质量浓度、温度、p H值、加酶量、反应时间等因素的影响.其单因素水平为:①底物质量浓度0.5 g/L、1.0 g/L、2.0 g/L、4.0 g/L、6.0 g/L、8.0 g/L、10.0 g/L,温度45℃,p H值4.0,加酶量6.0 mg/m L,反应时间12 h;②反应温度40℃、45℃、50℃、55℃、60℃、65℃、70℃、80℃、90℃,底物质量浓度4.0 g/L,p H值4.0,加酶量6.0 mg/m L,反应时间12 h;③p H值3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,底物质量浓度4.0 g/L,反应温度55℃,加酶量6.0 mg/m L,反应时间12 h;④加酶量3.0 mg/m L、6.0 mg/m L、9.0 mg/m L、12.0 mg/m L、15.0 mg/m L、18.0 mg/m L,底物质量浓度4.0 g/L,反应温度55℃,p H值5.0,反应时间12 h;⑤反应时间1 h、2 h、4 h、6 h、8 h、10 h、12 h、16 h、20 h、24 h,底物质量浓度4.0 g/L,反应温度55℃,p H值5.0,加酶量12.0 mg/m L.
(2)正交试验设计.基于单因素实验结果以及交联酶的性质,根据正交试验设计方法,选取底物质量浓度(A)、反应温度(B)、p H值(C)、加酶量(D)、反应时间(E)为优化因素,以柚皮素质量浓度(R)和柚皮素得率(Y)作为优化指标,设计L16(45)正交试验,确定最佳的优化条件,试验因素编码水平表如表1所示.
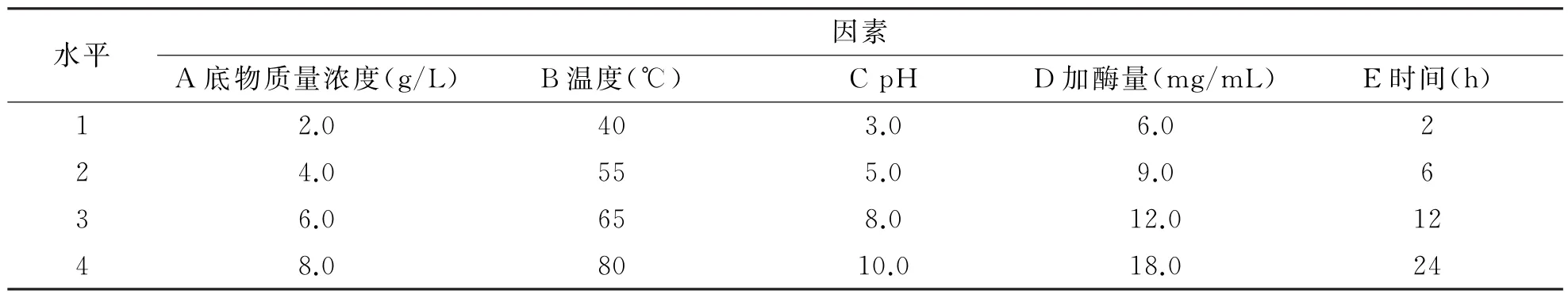
表1 正交实验因素水平表
1.5 分析方法
(1)柚皮苷、柚皮素的检测方法.采用大连依利特AS1201高效液相色谱仪进行检测,色谱柱型号为SinoChrom ODS-BP(4.6 mm×200 mm,5μm),流速1.0 m L/min,检测波长280 nm,进样量10μL,柱温30℃,流动相为乙腈∶水(V/V)=30∶70.
(2)柚皮素得率计算.
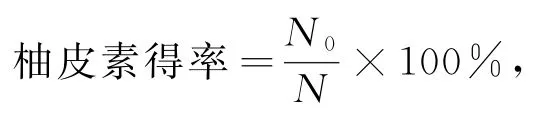
式中,N为柚皮苷总物质的量;N0为生成的柚皮素的物质的量.
2 结果与讨论
2.1 柚皮苷、柚皮素标准曲线
柚皮苷和柚皮素标准曲线如图1所示.柚皮苷和柚皮素高效液相色谱图如图2所示.由图1、图2可知,柚皮苷的线性回归方程为y=11 387x+96,R2=0.999 8;柚皮素的线性回归方程为y=26 014x+267, R2=0.999 3.由此可以看出,柚皮苷和柚皮素在质量浓度0~2.0 g/L范围内具有良好的线性.由图3还可以看出,柚皮苷的保留时间为4.39 min,柚皮素的保留时间为27.16 min.
2.2 底物质量浓度对制备柚皮素的影响
底物质量浓度对柚皮素的制备过程起着重要的作用.底物质量浓度过低,酶的催化效率达不到最优值;底物质量浓度过高,柚皮苷不能充分转化为柚皮素,中间副产物较多,不利于柚皮素的分离提纯.底物质量浓度对交联柚苷酶聚集体制备柚皮素的影响如图3所示.由图3可知,随着底物质量浓度的增加,柚皮素质量浓度逐渐增加,当底物质量浓度达到4.0 g/L时,生成的柚皮素质量浓度达到1.527 g/L,得率达到81.41%.之后随着底物质量浓度的增加,柚皮素质量浓度增加缓慢,柚皮素得率急剧下降,说明此时底物中的柚皮苷不能被充分地水解为柚皮素.因此,选取底物质量浓度4.0 g/L为最优的酶解条件.

图1 柚皮苷和柚皮素标准曲线

图2 柚皮苷和柚皮素高效液相色谱图
2.3 温度对制备柚皮素的影响
温度对酶的水解过程起着重要的作用,实验中温度不仅影响着酶的活性,同时影响着底物柚皮苷的溶解度.由于β-D-葡萄糖苷酶和α-L-鼠李糖苷酶的最适温度和温度稳定性的差异,为了最大化地得到柚皮素,需要在一定的温度范围内平衡β-D-葡萄糖苷酶和α-L-鼠李糖苷酶的酶活,同时最大化地提高柚皮苷的溶解度.温度对交联柚苷酶聚集体制备柚皮素的影响如图4所示.由图4可知,随着温度的增加,生成的柚皮素质量浓度逐渐增加,当温度达到55℃时,柚皮素质量浓度达到1.642 g/L.当继续升高温度时,柚皮素质量浓度大幅度降低,可能是因为随着温度的升高,β-D-葡萄糖苷酶酶活降低,普鲁宁无法转化为柚皮素.因此,选取55℃为最优的酶解条件.

图3 底物质量浓度对交联柚苷酶聚集体制备柚皮素的影响
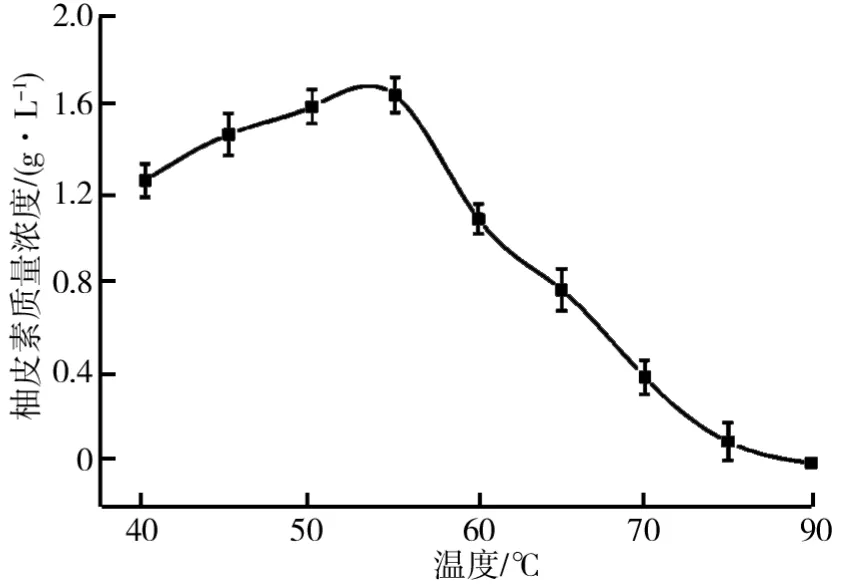
图4 温度对交联柚苷酶聚集体制备柚皮素的影响
2.4 p H值对制备柚皮素的影响
p H对交联柚苷酶聚集体制备柚皮素的影响如图5所示.由图5可知,酸性条件下,随着p H值的增加,柚皮素的含量逐渐增加,此时既能够使α-L-鼠李糖苷酶保持较高的活力,也让β-D-葡萄糖苷酶能够及时地将普鲁宁转化为柚皮素.当p H值达到5.0时,柚皮素质量浓度达到最大值1.742 g/L.当p H值继续升高时,柚皮素的含量逐渐减少,可能是因为中性和碱性条件下β-D-葡萄糖苷酶的酶活较低,影响了柚皮素的生成.因此,选取p H值5.0为最优的酶解条件.
2.5 加酶量对制备柚皮素的影响
加酶量对交联柚苷酶聚集体制备柚皮素的影响如图6所示.由图6可知,随着加酶量的增加,柚皮素的生成量也逐渐增加.当加酶量较低时,反应时间内交联柚苷酶聚集体无法有效地将柚皮苷转化为柚皮素,因此产量较低.当加酶量达到12.0 mg/m L时,此时生成的柚皮素质量浓度为1.799 g/L.此后随着加酶量继续增加,柚皮素的质量浓度不再增加.因此,选取加酶量12.0 mg/m L为最优的酶解条件.
2.6 反应时间对制备柚皮素的影响
反应时间对交联柚苷酶聚集体制备柚皮素的影响如图7所示.由图7可知,随着反应时间的增加,柚皮素的生成量逐渐增加,1~8 h内,柚皮素的生成速率较快,而后随着时间的增加,柚皮素的生成速率较慢,可能是因为β-D-葡萄糖苷酶和α-L-鼠李糖苷酶在高温和酸性条件下酶活力逐渐减低,导致转化速率较慢.当反应时间达到12 h时,柚皮素质量浓度达到最大值1.803 g/L,此时底物中的柚皮苷被大量转化为柚皮素.因此,选取12 h为最优的酶解条件.

图5 p H对交联柚苷酶聚集体制备柚皮素的影响
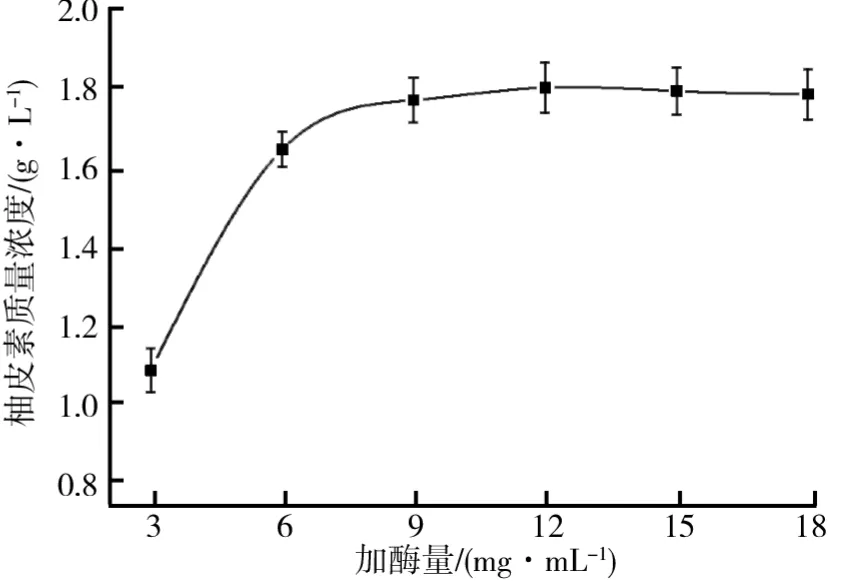
图6 加酶量对交联柚苷酶聚集体制备柚皮素的影响

图7 反应时间对交联柚苷酶聚集体制备柚皮素的影响
2.7 正交试验优化
正交试验设计及结果如表2所示.柚皮素质量浓度分析如表3所示.由表3可知,当以柚皮素质量浓度为优化指标时,其极差满足RC>RB>RA>RD>RE,即5个单因素对制备柚皮素的影响大小为p H>温度>底物质量浓度>加酶量>反应时间.其中,通过均值可知:①随着p H值的增加,其均值逐渐降低,因此在实验范围内应当减小p H值;②随着加酶量和反应时间的增加,其均值逐渐增加,因此,在实验范围内应当加大加酶量、延长反应时间;③反应温度和底物质量浓度对生成的柚皮素质量浓度的影响表现为先增加后减少,当底物质量浓度和反应温度过高时,都不利于柚皮素的生成.
柚皮素得率分析如表4所示.由表4可知,当以柚皮素得率为优化指标时,其极差满足RC>RB>RA>RD>RE,即5个单因素对制备柚皮素的影响大小为p H>温度>底物质量浓度>加酶量>反应时间.其中,通过均值可知:①随着p H值的增加,其均值逐渐降低,表明在酸性条件下利于柚皮素的转化,因此在实验范围内,应当减小p H值;②底物质量浓度过高时柚皮素得率较低,选择适宜的底物质量浓度有利于减少中间产物的生成,同时提高柚皮素的产量;③反应温度对生成的柚皮素得率的影响表现为先增加后减少,反应温度过高时,不利于柚皮素的生成.对于多指标正交试验,实验采用综合平衡法对上述两个指标的结果进行分析,5个单因素中对制备柚皮素影响较大的因素为p H、温度、底物质量浓度.为了节约原料,减少中间产物的生成,提高柚皮素的产量,在实验范围内,得到的最佳组合为A2B2C1D4E4,即底物质量浓度4.0 g/L、温度55℃、p H值3.0、加酶量18.0 mg/m L及反应时间24 h.按正交设计的结果进行实验,3次平行实验测得柚皮素质量浓度的平均值为1.833 g/L,柚皮素得率为97.72%.

表2 正交试验设计及结果

表3 柚皮素质量浓度分析表
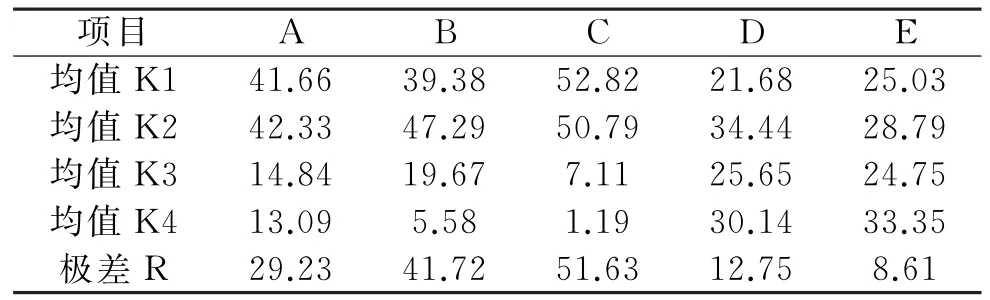
表4 柚皮素得率分析表
3 结论
采用交联柚苷酶聚集体制备柚皮素,以柚皮素质量浓度和得率作为优化指标,对制备过程中的5个单因素进行了研究,并通过正交试验确定了交联柚苷酶聚集体制备柚皮素的最佳工艺条件为底物质量浓度4.0 g/L、反应温度55℃、p H 3.0、加酶量18.0 mg/m L、反应时间24 h,在此条件下制备得到的柚皮素质量浓度可达到1.833 g/L,柚皮素得率为97.72%.
参考文献:
[1] I A Mir,A B Tiku.Chemopreventive and therapeutic potential of"naringenin,"a flavanone present in citrus fruits[J].Nutrition and Cancer,2015,67(1):27-42.
[2] K Patel,G K Singh,D K Patel.A review on pharmacological and analytical aspects of naringenin[J].Chinese Journal of Integrative Medicine,2012,5(1):1-13.
[3] E Orhan I,F Nabavi S,M Daglia,et al.Naringenin and atherosclerosis:a review of literature[J].Current Pharmaceutical Biotechnology,2015,16(3):245-251.
[4] 马燕,林宝琴,李卫中,等.柚皮素大鼠在体肠吸收动力学的研究[J].中成药,2012,34(8):1 487-1 491.
[5] 陈雪峰,刘迪,李欣.超临界CO2萃取桃叶中柚皮素的工艺研究[J].食品科学,2007,28(1):106-109.
[6] 刘亚萍.柚皮素的制备方法研究[J].光谱实验室,2008,25(6):1 292-1 294.
[7] 郑美瑜,陆胜民,陈剑兵,等.糖苷酶对橙皮苷和柚皮苷的酶解作用研究[J].中国食品学报,2010,10(4):141-146.
[8] M Puri.Updates on naringinase:structural and biotechnological aspects[J].Applied Microbiology and Biotechnology, 2012,93(1):49-60.
[9] M Puri,A Kaur.Molecular identification of Staphylococcus xylosus MAK2,a newα-L-rhamnosidase producer[J].World Journal of Microbiology and Biotechnology,2010,26(6):963-968.
[10]R A Sheldon.Cross-linked enzyme aggregates(CLEAs):stable and recyclable biocatalysts[J].Biochemical Society Transactions,2007,35(6):1 583-1 587.
[11]R Schoevaart,M W Wolbers,M Golubovic,et al.Preparation,optimization and structures of cross-linked enzyme aggregates(CLEAs)[J].Biotechnology and Bioengineering,2004,87(6):754-762.
Hydrolysis of naringin to naringeninby cross-linked naringinase aggregates
ZHU Bi-yu1,QIAN Wei1,WANG Xian-feng1,DU Ping1,GAO Qian-kun1,WEI Sheng-hua1,2∗
(1.College of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China; 2.Anhui Engineering Technology Research Center of Microbial Fermentation,Anhui Polytechnic University,Wuhu 241000,China)
Abstract:In order to improve the naringenin yield,simplify the process of separation and purification and obtain the high purity production,the conversion of naringin to naringenin by cross-linked naringin aseaggregate was investigated.The effects of substrate concentration,temperature,p H,enzyme amount and the reaction time on the preparation of naringenin were optimized,and the naringenin concentration and yield were used as the optimization indexes.Using the orthogonal design to optimize the hydrolysis process,the results showed that the feasible hydrolysis conditions were the substrate concentration 4.0 g/L,hydrolysis temperature at 55℃,p H 3.0,the amount of enzyme 18.0 mg/mL,the reaction time for 24 h,under which the production of naringenin's concentration was 1.833 g/L and the yield was 97.72%.It provided a new method for preparing the naringenin.
Key words:cross-linked naringinase aggregate;naringenin;hydrolysis reaction;orthogonal design
中图分类号:TQ920.6
文献标识码:A
收稿日期:2015-10-15
基金项目:国家级大学生创新创业训练计划基金资助项目(201310363075)
作者简介:朱必玉(1991-),男,安徽六安人,硕士研究生.
通讯作者:魏胜华(1972-),男,安徽无为人,副教授,硕导.
