毕赤酵母产β-葡萄糖苷酶发酵条件优化
2016-07-20李碧玲赵世光
华 骏,杨 帆,李碧玲,赵世光
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
毕赤酵母产β-葡萄糖苷酶发酵条件优化
华 骏,杨 帆,李碧玲,赵世光∗
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
摘要:采用数理统计法对毕赤酵母产β-葡萄糖苷酶发酵条件进行优化研究.以单因素实验确定甘油、甲醇、初始p H为影响酶活的主要因素,通过响应面实验设计对产酶条件进行优化,得到毕赤酵母产β-葡萄糖苷酶最佳发酵条件:甘油浓度19.4 m L/L、硫酸铵质量浓度15 g/L、初始p H 6.12、甲醇浓度2%、装液量20 m L,β-葡萄糖苷酶酶活达到31.87 U/m L,比优化前提高了162.74%.
关 键 词:毕赤酵母;β-葡萄糖苷酶;发酵条件;响应面法
β-葡萄糖苷酶(EC3.2.1.21)又称β-D-葡萄糖苷水解酶,能催化水解芳基或烃基与糖基原子团之间的糖苷键生成葡萄糖[1].β-葡萄糖苷酶能将果、蔬、茶中的风味前体物质水解为具有浓郁天然风味的香气物质,可增加酒类和果汁产品中的风味物质含量,广泛应用于食品、饮料的增香[2].
β-葡萄糖苷酶产生菌类群广泛分布于原核、真核、古细菌界等几十个属,有上百种之多[3].目前对β-葡萄糖苷酶产生菌研究较多的是丝状真菌中的曲霉属和木霉属、细菌中的芽抱杆菌属.毕赤酵母表达系统作为一种真核表达系统,克服了传统表达系统如E.coli等表达外源蛋白过程中易形成不溶性包涵体、表达量低的缺陷.前期研究中已构建了一株产β-葡萄糖苷酶产酶的重组毕赤酵母,实现了β-葡萄糖苷酶的异源表达,但其产酶能力较低,亟需对其营养条件及发酵过程进行优化控制,以实现β-葡萄糖苷酶的高效生产.
采用数理统计法对毕赤酵母产β-葡萄糖苷酶发酵条件进行优化研究,以单因素实验法分析碳源、氮源、诱导剂、p H、装液量、诱导时间等因素对毕赤酵母产β-葡萄糖苷酶的影响.在此基础上,用响应面实验设计对其发酵条件进行优化研究.
1 材料与方法
1.1 菌种及培养基
重组毕赤酵母(Pichia pastoris),安徽工程大学生物技术实验室选育.
斜面培养基:葡萄糖20 g/L、胰蛋白胨20 g/L、酵母膏10 g/L、琼脂20 g/L,p H自然;种子培养基:葡萄糖20 g/L、胰蛋白胨20 g/L、酵母膏10 g/L,p H自然;基础产酶培养基:甘油20 m L/L、(NH4)2SO410、H3PO420 m L/L、MgSO4·7H2O 2.046、K2SO41、CaCl2·2 H2O 0.216、PTM110 m L/L,p H 6.0;PTM1: CuSO4·5H2O 6、KI 0.088 6、MnSO4·H2O 3、Na MoO4·2H2O 0.2、H2BO30.02、CoCl2·6H2O 0.916、ZnCl220、FeSO4·7 H2O 65、生物素0.3、浓硫酸5 m L/L.
1.2 实验方法
(1)培养方法.种子培养:从斜面培养基上挑取一环菌种接于装液量为20 m L的250 m L三角摇瓶中, 在28℃、200 r/min摇床转速的条件下培养24 h.产酶培养:以1%的接种量将菌种接于装液量为20 m L的250 m L三角摇瓶中,在28℃、200 r/min摇床转速的条件下培养30 h后,添加1%的甲醇进行诱导产酶培养,3 d后测定酶活与菌体浓度.
(2)菌体浓度测定.将发酵液作适当稀释,用可见分光光度计于600 nm下测定吸收值(OD600).用相同稀释倍数的空白培养基作对照.测定出的数值与稀释倍数的积即为细胞的OD600:OD600=OD600测定值×稀释倍数[4].
(3)β-葡萄糖苷酶酶活测定.β-葡萄糖苷酶酶活测定采用4-硝基苯基-β-D-吡喃葡萄糖苷(p NPG)法.取1 m L发酵液,10 000 r/min下离心10 min后,取上清液作为粗酶液.取20μL适当稀释的酶液与180μL 5 mmol/L p NPG溶液混合,于50℃水浴恒温反应10 min后,加入2 m L 1 mol/L的Na2CO3溶液终止反应,在408 nm处测定反应液吸光度[5].以液体培养基的反应混合液为对照.以1 min内底物p NPG被水解释放出1μmol的对硝基苯酚所需要的酶量为1个酶活单位(U).
(4)产酶条件优化.以单因素实验分别考察碳源(葡萄糖、甘油、蔗糖、玉米浆、可溶性淀粉)、碳源浓度(1%、2%、3%、4%、5%)、氮源(酵母膏、胰蛋白胨、牛肉膏、硝酸钾、硫酸铵)、氮源质量浓度(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)、甲醇浓度(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、p H(4、5、6、7、8、9)、装液量(15 m L、20 m L、25 m L、30 m L、35 m L、40 m L)对毕赤酵母产β-葡萄糖苷酶的影响,以1%的接种量将菌种250 m L三角摇瓶中,在28℃、200 r/min摇床转速的条件下培养30 h后,添加甲醇进行诱导产酶培养,3 d后测定酶活与菌体浓度.对单因素实验结果进行分析后,确定影响β-葡萄糖苷酶产量的主要因素及其各自较优水平,继而采用3因素3水平的响应面实验设计对其进行进一步寻优.响应面实验设计因素与水平如表1所示.

表1 响应面实验因素与水平
2 结果与分析
2.1 碳源对毕赤酵母生长及产β-葡萄糖苷酶的影响
硫酸铵质量浓度10 g/L、初始p H 6、装液量20 m L、培养温度28℃、摇床转速200 r/min,培养30 h 后,添加1%的甲醇诱导产酶培养3 d,相同浓度(2%)的葡萄糖、甘油、蔗糖、玉米浆、可溶性淀粉对毕赤酵母生长及产β-葡萄糖苷酶的影响如图1所示.由图1可知,葡萄糖最有利于毕赤酵母的菌体生长,菌体浓度最高,达到了59.95,酶活达到了10.45 U/m L;而甘油最利于毕赤酵母产酶,酶活达到12.13 U/m L,菌体浓度仅次于葡萄糖.其他碳源获得的菌体浓度和酶活相对都较低.
选定甘油作为最优碳源后,进一步考察了甘油的较优添加浓度如图2所示.由图2可知,菌体浓度随甘油添加量的增加而持续增加,甘油浓度2%时最有利于毕赤酵母产β-葡萄糖苷酶,继续提升甘油浓度则不利于产酶,甘油浓度超过3%后,几乎检测不到β-葡萄糖苷酶酶活.这可能因为培养基中残留有甘油时,毕赤酵母在发酵经甲醇的诱导作用的产酶代谢过程受到抑制,甚至无法产酶[6].
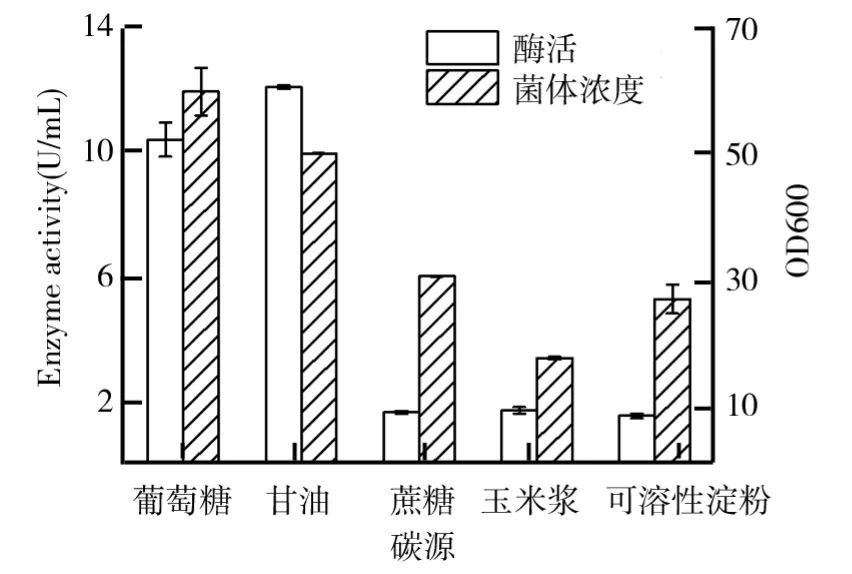
图1 碳源对毕赤酵母生长及产β-葡萄糖苷酶的影响
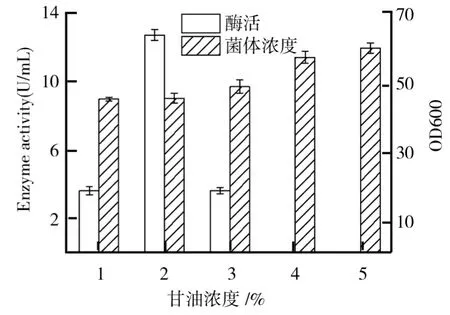
图2 甘油浓度对毕赤酵母生长及产β-葡萄糖苷酶的影响
2.2 氮源对毕赤酵母生长及产β-葡萄糖苷酶的影响
甘油浓度2%、初始p H 6、装液量20 m L、培养温度28℃、摇床转速200 r/min,培养30 h后,添加1%的甲醇诱导产酶培养3 d,相同质量浓度(10 g/L)的酵母膏、胰蛋白胨、牛肉膏、硝酸钾、硫酸铵几种氮源对毕赤酵母生长及产β-葡萄糖苷酶的影响如图3所示.由图3可知,以硫酸铵作为唯一氮源的发酵培养基最有利于毕赤酵母的产酶发酵,酶活最高,达到了12.03 U/m L,而酵母膏、胰蛋白胨、牛肉膏的酶活均很低,分别仅有0.86 U/m L、0.91 U/m L、0.18 U/m L,毕赤酵母虽然在硝酸钾作为唯一氮源的发酵培养基有所生长,但是无法产酶.
选定硫酸铵作为最优氮源后,进一步探究硫酸铵质量浓度对毕赤酵母产β-葡萄糖苷酶的影响如图4所示.由图4可知,随着硫酸铵浓质量度的增加,毕赤酵母的菌体浓度有一个明显的下降趋势,这可能是由于过高的氮源浓度使得培养基中的碳氮比过低,导致了菌体过早的衰老自溶,菌体浓度降低.在硫酸铵质量浓度为15 g/L时,酶活达到最高,为13.55 U/m L,说明该浓度下,发酵培养基的碳氮比达到产酶的最优值,最有利于毕赤酵母产β-葡萄糖苷酶.
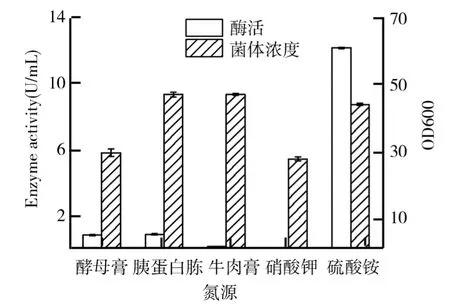
图3 氮源对毕赤酵母生长及产β-葡萄糖苷酶的影响
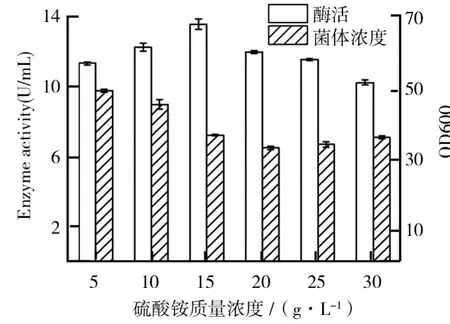
图4 硫酸铵质量浓度对毕赤酵母生长及产β-葡萄糖苷酶的影响
2.3 甲醇浓度对毕赤酵母产β-葡萄糖苷酶的影响
甲醇作为毕赤酵母产酶的诱导剂和一部分的碳源物质,在合适的浓度范围内,对菌体产酶有促进作用.然而甲醇本身对菌体有一定的毒性,浓度过高反而会抑制菌体的生长和产酶[7].所以探究甲醇添加量对酶活的影响、找到最适的甲醇添加浓度,对提高毕赤酵母产β-葡萄糖苷酶活力有着重要的意义.甘油浓度2%、硫酸铵质量浓度15 g/L、初始p H 6、装液量20 m L的情况下,考察甲醇浓度对毕赤酵母产β-葡萄糖苷酶的影响如图5所示.由图5可知,在一定范围内,随着甲醇浓度的增加,酶活也随之明显提高,菌体浓度略有增加,当甲醇浓度达到2%时,酶活达到最高为30.97 U/m L,甲醇浓度继续增加,酶活略有降低,菌体浓度也有所降低,说明高浓度的甲醇对菌体生长产酶有所抑制.
2.4 培养基初始p H对毕赤酵母产β-葡萄糖苷酶的影响
不同种类的微生物的生长代谢对p H的要求各有不同,对p H的耐受范围也有所不同,控制一定的p H范围不但可以促进微生物的生长代谢,而且可以抑制其他杂菌的繁殖[8].甘油浓度2%、硫酸铵质量浓度15 g/L、装液量20 m L、甲醇浓度2%的情况下,考察初始p H对毕赤酵母产β-葡萄糖苷酶的影响如图6所示.由图6可知,p H为6时,酶活达到最高为29.32 U/m L,随着初始p H的继续增加,酶活有明显下降趋势;初始p H较低时,其酶活显著低于高初始p H的酶活,初始p H分别为4、5时,所对应的酶活仅有5.58 U/m L和7.74 U/m L,仅为最高酶活的19.03%和26.40%;菌体浓度呈先上升后下降再上升的趋势.可选p H 6为较佳初始p H.
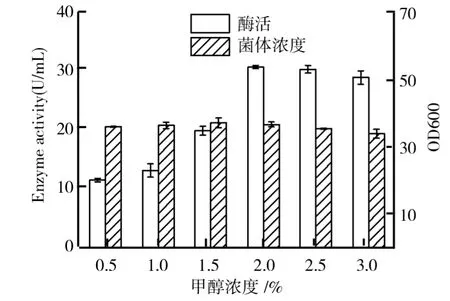
图5 甲醇浓度对毕赤酵母生长及产β-葡萄糖苷酶的影响
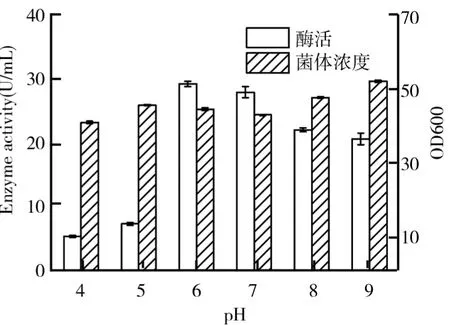
图6 初始p H对毕赤酵母生长及产β-葡萄糖苷酶的影响
2.5 装液量对毕赤酵母产β-葡萄糖苷酶的影响
当摇床转速恒定的情况下,在有限的摇瓶空间当中,其装液量决定了培养基中的溶氧(DO)情况,而发酵培养基中的DO值往往直接影响微生物的产酶活力、代谢途径及产物产量[9].甘油浓度2%、硫酸铵质量浓度15 g/L、甲醇浓度2%、初始p H 6的情况下,考察甲醇浓度对毕赤酵母产β-葡萄糖苷酶的影响如图7所示.由图7可知,随着装液量的增加,酶活有明显的下降趋势,菌体浓度也略有降低,当装液量为20 m L时,酶活达到最大值29.61 U/m L,说明溶氧越高越有利于菌体生长繁殖及其次级代谢,越有利于毕赤酵母发酵产酶.
2.6 β-葡萄糖苷酶发酵条件优化
(1)响应面实验设计及结果.在单因素实验基础上,维持氮源浓度、装液量在各自最优水平下,选取甘油浓度、初始p H、甲醇浓度3个因素,设计3因素3水平Box-Behnken实验,进行多因素实验优化.Box-Behnken实验设计及结果如表2所示.经二次多项回归拟合后,得到二次多项回归方程为:
Y=-1 402.283 00+28.683 16A+338.173 19B+119.948 63C-0.419 84AB-0.323 85AC-5.063 30BC-0.656 33A2-26.135 54B2-20.710 00C2
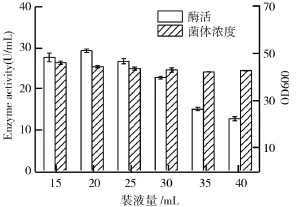
图7 装液量对毕赤酵母生长及产β-葡萄糖苷酶的影响
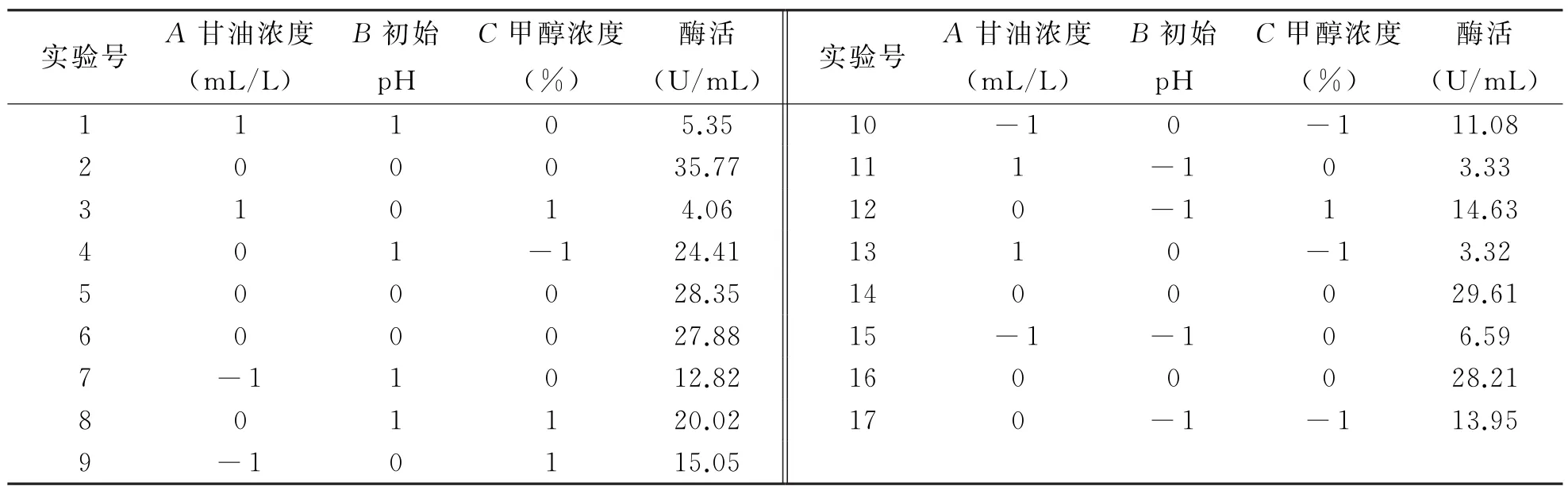
表2 Box-Behnken实验设计及结果
(2)回归模型的方差分析.回归模型方差分析如表3所示.从表3可以看出,模型P=0.000 3,失拟项P =0.584 7,表明模型回归极显著,失拟度不显著;相关系数R2=0.962 3,表明相关性良好;校正相关系数=0.913 9,说明该响应面91.39%的变化可以由此模型解释,模型的拟合程度良好,实验误差较小,可以用此模型对毕赤酵母产β-葡萄糖苷酶酶活进行分析和预测.模型中一次项A、B,二次项C2影响显著(P值<0.05);二次项A2、B2极显著(P值<0.01);一次项C及所有交互项均不显著(P值>0.05).表明甘油浓度、初始p H对毕赤酵母产β-葡萄糖苷酶有显著影响;而甘油浓度、初始p H及甲醇浓度之间的交互作用对其产酶无显著影响.
(3)各因素对酶活影响的响应面.甘油浓度与初始p H对酶活影响的响应面如图8所示.由图8可知,在保持甲醇浓度不变的情况下,随着甘油浓度和p H的逐渐升高,酶活也渐渐上升,到达最高点后又开始明显下降,这可能是因为随着甘油浓度的升高,进入诱导产酶阶段时的残留甘油增加,产酶代谢过程受到抑制,从而导致酶活的下降.
甘油浓度与甲醇浓度对酶活影响的响应面如图9所示.由图9可知,当p H保持不变时,一定范围内逐渐提高甘油浓度和甲醇浓度,酶活也随之渐渐升高,达到最高点后又逐渐呈现下降趋势.这可能是因为随着甘油浓度的升高,进入诱导产酶阶段时的残留甘油增加,产酶代谢过程受抑制,从而导致酶活下降.
初始p H与甲醇浓度对酶活影响的响应面和等高线如图10所示.由图10可知,保持甘油浓度不变,在一定范围内,随p H和甲醇浓度升高,酶活也渐渐提高,达到最高点后逐渐下降.这可能是因为随着p H的不断上升,毕赤酵母逐渐处于碱性环境下,对其生长及产酶代谢有较大影响,产酶量下降导致酶活降低.
(4)响应面法优化结果验证.根据响应面分析得到的最佳发酵条件:甘油浓度19.4 m L/L、初始p H 6.12、甲醇浓度2%.在此条件下,毕赤酵母产β-葡萄糖苷酶酶活的理论预测值为31 U/m L.在此发酵条件下进行3次重复验证实验,β-葡萄糖苷酶的酶活平均值达31.87 U/m L,与理论值相对误差约为2.81%.由此可见,采用该响应面模型得到响应面分析的优化结果准确可靠,具有一定实用价值.
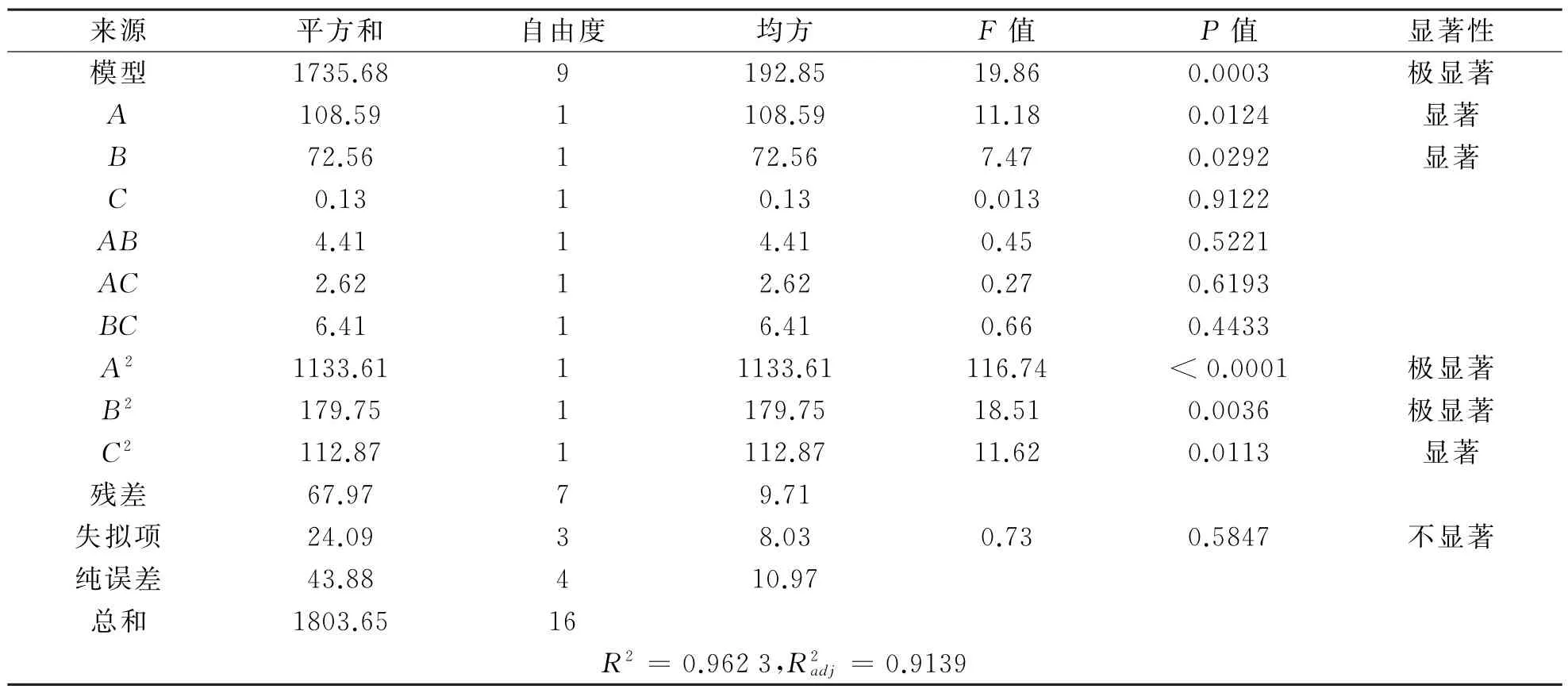
表3 方差分析
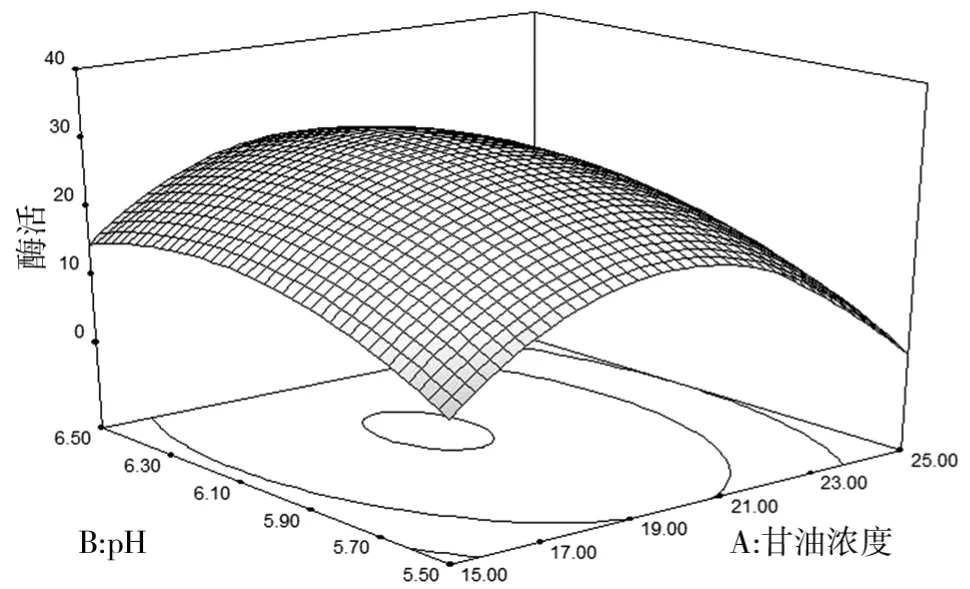
图8 甘油浓度与初始p H对酶活影响的响应面
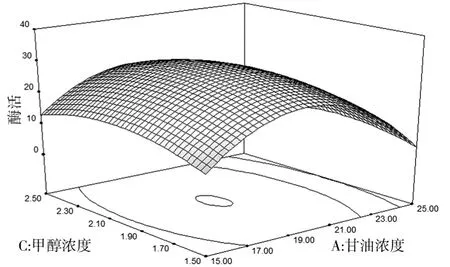
图9 甘油浓度与甲醇浓度对酶活影响的响应面
3 结论
通过在单因素实验的基础上结合响应面分析法,对毕赤酵母产β-葡萄糖苷酶的发酵条件进行优化,得到毕赤酵母产β-葡萄糖苷酶最佳发酵条件为:甘油浓度19.4 m L/L、硫酸铵质量浓度15 g/L、初始p H 6.12、甲醇浓度2%、装液量20 m L.在优化后的发酵条件下β-葡萄糖苷酶酶活平均值达到了31.87 U/m L,比优化前的酶活12.13 U/m L提高了162.74%.

图10 初始p H与甲醇浓度对酶活影响的响应面和等高线
参考文献:
[1] M L Sinnott.Catalytic mechanism of enzymic glycosyl transfer[J].Chemical Reviews,1990,90(7):1 171-1 202.
[2] 潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2007,27(12):803-807.
[3] Y Amano,T Kanda.New insights into cellulose degradation by cellulases and related enzymes[J].Trends in Glycoscience and Glycotechnology,2002,14(75):27-34.
[4] 洒荣波.基于重组巴斯德毕赤酵母高密度培养研究[D].无锡:江南大学,2005.
[5] 李华,高丽.β-葡萄糖苷酶活性测定方法的研究进展[J].食品与生物技术学报,2007,2:107-114.
[6] C Jungo,I Marison,U von Stockar.Regulation of alcohol oxidase of a recombinant Pichia pastoris Mut+strain in transient continuous cultures[J].Journal of Biotechnology,2007,130(3):236-246.
[7] S Macauley-Patrick,M L Fazenda,B Mc Neil,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22(4):249-270.
[8] 单谷,罗廉.p H值对纤维素酶制备的影响[J].南京林业大学学报:自然科学版,1999,23(3):60-62.
[9] 张智,滕婷婷,王淼,等.工业发酵中溶氧因素的探讨[J].中国酿造,2008,27(23):4-6.
Optimization ofβ-glucosidase fermentation conditions of Pichia pastoris
HUA Jun,YANG Fan,LI Bi-ling,ZHAO Shi-guang∗
(College of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China)
Abstract:Statistical method was used to optimize the fermentation ofβ-glucosidase produced by Pichia pastoris.Glycerol methanol and initial p H were confirmed as the critical factors impacting the enzyme activity according to the results of single factor experiment.Subsequently,by using response surface methodology,the optimum condition forβ-glucosidase yielding was obtained as following:19.4 m L/L of glycerol,15 g/L of ammonium sulfate,2%of methanol with initial p H value of 6.12 and 20 m L of liquid volume.Theβ-glucosidase activity was up to 31.87 U/m L,which increased by 162.74%than that of the original.
Key words:Pichia pastoris;β-glucosidase;fermention condition;response surface methodology
中图分类号:TQ925
文献标识码:A
收稿日期:2015-11-24
作者简介:华 骏(1990-),男,江苏张家港人,硕士研究生.
通讯作者:赵世光(1977-),男,安徽宿州人,副教授,博士.
