姜黄素PLGA纳米粒的制备及制剂学性质分析
2016-07-19李晴宇叶晓莉王彬辉王国伟
李晴宇,叶晓莉,陈 玲,王彬辉,楼 江,王国伟,严 伟*
姜黄素PLGA纳米粒的制备及制剂学性质分析
李晴宇1,叶晓莉1,陈玲1,王彬辉2,楼江1,王国伟3,严伟1*
1.杭州市第一人民医院,杭州 310006;2.台州市立医院,台州 318000;3.浙江中医药大学,杭州 310053
[摘要]目的制备姜黄素(Curcumin,Cur)聚乳酸羟基乙酸共聚物(PLGA)纳米粒(Cur-PLGA-NPs)并对其理化性质进行考察。方法采用改良的自乳化溶剂挥发法制备纳米粒,通过正交设计,以粒径、包封率和载药量为评价指标优化处方工艺。结果制备Cur-PLGA-NPs的优化条件为PLGA 100 mg,泊洛沙姆188浓度1.0%,丙酮与乙醇体积比3∶1,有机相体积15 mL。按优化条件所制备的Cur-PLGA-NPs粒径为(120.33±2.44)nm,多分散系数为0.10±0.02,包封率为84.50%±1.13%,载药量为4.75%±0.22%。结论采用改良的自乳化溶剂挥发法成功制备了Cur-PLGA-NPs,为后续“纳米粒-脂质体系统”的研究奠定了基础,有望实现药物在肝脏的浓集。
[关键词]姜黄素;纳米粒;聚乳酸羟基乙酸共聚物;正交设计
0引言
姜黄素(Curcumin,下称Cur)是从姜黄的根茎中提取出来的一种多酚类化合物[1],素有“破血行气,通经止痛”之功效。现代研究发现,姜黄素还可通过诱导肿瘤细胞凋亡、改变细胞受体连接和调控细胞凋亡信号来抑制肝肿瘤细胞的产生、增殖和转移[2-3],常用于肝癌等的治疗。姜黄素以其价格低廉、对人体毒副作用小[4]被美国国立肿瘤研究所列为第3代抗癌化学预防药[5]。但由于姜黄素水溶解度低,不易进入肝细胞,并且药物在体内代谢迅速,使肿瘤病灶区药物浓度很快失去抗肿瘤活性,限制了其临床发展[6]。研究表明,制备高效低毒制剂是提高姜黄素应用价值的一种重要且方便的手段。
目前,具有“魔法子弹”之说的纳米粒(Nanoparticles,NPs)已广泛用于装载抗肿瘤药物,通过胞饮或吞噬作用进入细胞,绕过细胞膜上P-糖蛋白等外排泵对药物的外排作用[7]。但由于纳米粒易降解,研究表明,脂质体包裹纳米粒可以保护纳米粒,提高其稳定性,改善药动学[8-9]。因此,本实验以聚乳酸羟基乙酸共聚物[poly(lactic-co-glycolic acid) copolymer,PLGA]为载体材料,制备Cur-PLGA-NPs,并通过单因素和正交试验来优化工艺,为构建脂质体包裹姜黄素纳米粒的载药系统提供实验基础。
1仪器与试药
LC-2010CHT高效液相色谱仪(日本岛津公司);Nano-ZS型粒径分析仪(英国Malvern公司);超速离心机(美国Beckman公司);RE52CS-1型旋转蒸发器(上海亚荣生化仪器厂)。Cur原料药(成都普思生物技术有限公司,纯度>98%,批号:12041502);Cur对照品(中国食品药品检定研究院,含量98.8%,批号:110823-201004,含量测定用HPLC);PLGA(山东省医疗器械研究所,Mw为20 000);泊洛沙姆188(德国BASF公司,批号:WPWA544C);乙腈为色谱醇;其他试剂均为分析纯。
2方法与结果
2.1姜黄素含量测定
2.1.1色谱条件色谱柱:Hypersil C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.02 mol/L磷酸二氢钠水溶液(60∶40,磷酸调pH值至3.0);体积流量:1 mL/min;检测波长:425 nm;柱温:25 ℃;进样量:20 μL[10]。
2.1.2专属性考察制备空白PLGA-NPs和Cur-PLGA-NPs混悬液。取Cur标准品溶液、空白PLGA-NPs和Cur-PLGA-NPs混悬液进行HPLC分析。结果见图1。Cur色谱峰专一性良好,辅料和溶剂对其测定无干扰。

图1 高效液相色谱图
2.1.3标准曲线的建立精密称取Cur对照品适量,用甲醇定容,得到121.6 μg/mL的Cur对照品储备液。分别用甲醇配制系列质量浓度为5.06、10.14、20.26、30.41、40.56、50.71、60.80 μg/mL的溶液,按“2.1.1”项色谱条件测定,以峰面积(Y)对药物浓度(X)进行线性回归,得标准曲线方程:Y=192 788 X-3 172.6,r=0.999 9(n=7)。表明Cur在5.06~60.80 μg/mL与峰面积呈良好的线性关系。
2.1.4精密度与回收率试验取Cur浓度分别为4.90、29.39、58.77 μg/mL的对照品溶液,于1 d内测定6次,进行日内精密度试验,RSD值为0.17%。
精密称取处方量80%、100%、120%减压干燥至恒重的Cur标准品,分别加处方比例辅料,用甲醇定容为17.91、22.39、26.87 μg/mL的低、中、高浓度溶液,按“2.1.1”项色谱条件分析,计算回收率。结果见表1。
2.1.5重复性试验取同批次制备的Cur-PLGA-NPs混悬液6份,制备供试品溶液,进样测定峰面积,计算其RSD为0.21%。

表1 方法回收率(n=6)
2.2Cur-PLGA-NPs的制备取适量Cur和PLGA溶于一定比例的丙酮与乙醇混合溶剂中,构成有机相;另取处方量的泊洛沙姆188水溶液,构成水相。搅拌下将有机相恒速滴加到水相中。继续搅拌10 min后,旋转蒸发除去有机溶剂,得Cur-PLGA-NPs胶体溶液。
2.3指标考察
2.3.1纳米粒形态学考察取适量Cur-PLGA- NPs胶体溶液滴于铜网上,滴加2.0%磷钨酸溶液于铜网上负染,透射电子显微镜观察。
2.3.2纳米粒粒径测定用适量水稀释Cur-PLGA-NPs混悬液,Nano-ZS型粒径分析仪测定。
2.3.3纳米粒包封率与载药量测定取Cur-PLGA-NPs混悬液超速离心(40 000 r/min,4 ℃)30 min,取上清液1 mL置10 mL量瓶中,用甲醇稀释至刻度,经0.22 μm微孔滤膜滤过,续滤液测定Cur含量,记作W1;取离心后沉淀物,蒸馏水洗涤3次,真空冷冻干燥后精密称定总质量,记作W。另取1 mL Cur-PLGA-NPs至10 mL量瓶中,加甲醇超声定容,按同法测定NPs中Cur的总含量,记作W0,分别计算包封率和载药量。包封率=(W0-W1)/W0,载药量=(W0-W1)/W。
2.4单因素考察
2.4.1载体材料分子量选择PLGA载体材料分子量为5 000、20 000、30 000 Da,按“2.2”项方法制备Cur-PLGA-NPs。结果表明,当PLGA的分子量不断增大时,NPs粒径和多分散系数(Polydispersity index,PDI)都呈增加趋势,可能是由于PLGA链段的长度随着PLGA分子量增大而增长,导致分子链间的作用增强,有机相黏度变大,粒子较难扩散,故所得的粒径较大。同时大分子量PLGA降解时间延长,小分子量PLGA会导致成球性越差。综合考虑,本实验选择20 000 Da的PLGA作为NPs的载体材料。
2.4.2搅拌条件固定其他实验条件不变,选择搅拌速度分别为200、500、800 r/min,搅拌时间分别为5、10、15 min,进行考察。结果表明,搅拌过慢则体系分散性较差;过快易产生较多泡沫。而搅拌时间对NPs粒径和PDI的影响均不显著,故本试验选择搅拌速度为500 r/min,搅拌时间为10 min。
2.4.3Cur用量选择投药量分别为2、5、10 mg,结果表明,随着药量增大,粒径和PDI呈增大趋势。但当投药量增至10 mg时,溶液已达到饱和状态,出现絮状沉淀,静置后分层,故本实验选择Cur的用量为5 mg。
2.5Cur-PLGA-NPs最佳处方工艺本实验根据单因素考察结果,选择PLGA用量(A)、泊洛沙姆188质量分数(B)、丙酮与乙醇的体积比(C)、有机相体积(D)为考察因素,每个因素选取3水平,按L9(34)进行正交试验。以纳米粒粒径、包封率和载药量综合加权评分值为指标,筛选最佳处方。
3结果
3.1正交试验以综合加权评分法对正交结果进行综合分析,粒径(y1)、包封率(y2)和载药量(y3)分别按35%、30%、35%的系数计分,综合评分值(y)=35×(1-y1/209.5)+30×y2/86.41+35×y3/6.05。结果见表2~表4。极差分析结果可知,各因素对纳米粒粒径、包封率和载药量综合评分值的影响程度依次为:A>B>D>C。由表5可知,影响因素A、B、D对粒径、包封率和载药量影响显著(P<0.05),而C对三者影响不显著。综合极差分析和方差分析确定Cur-PLGA-NPs的最佳制备工艺为A1B1C1D2,即PLGA用量为100 mg,泊洛沙姆188质量分数为1.0%,丙酮与乙醇体积比为3∶1,有机相体积为15 mL。

表2 正交试验因素水平表
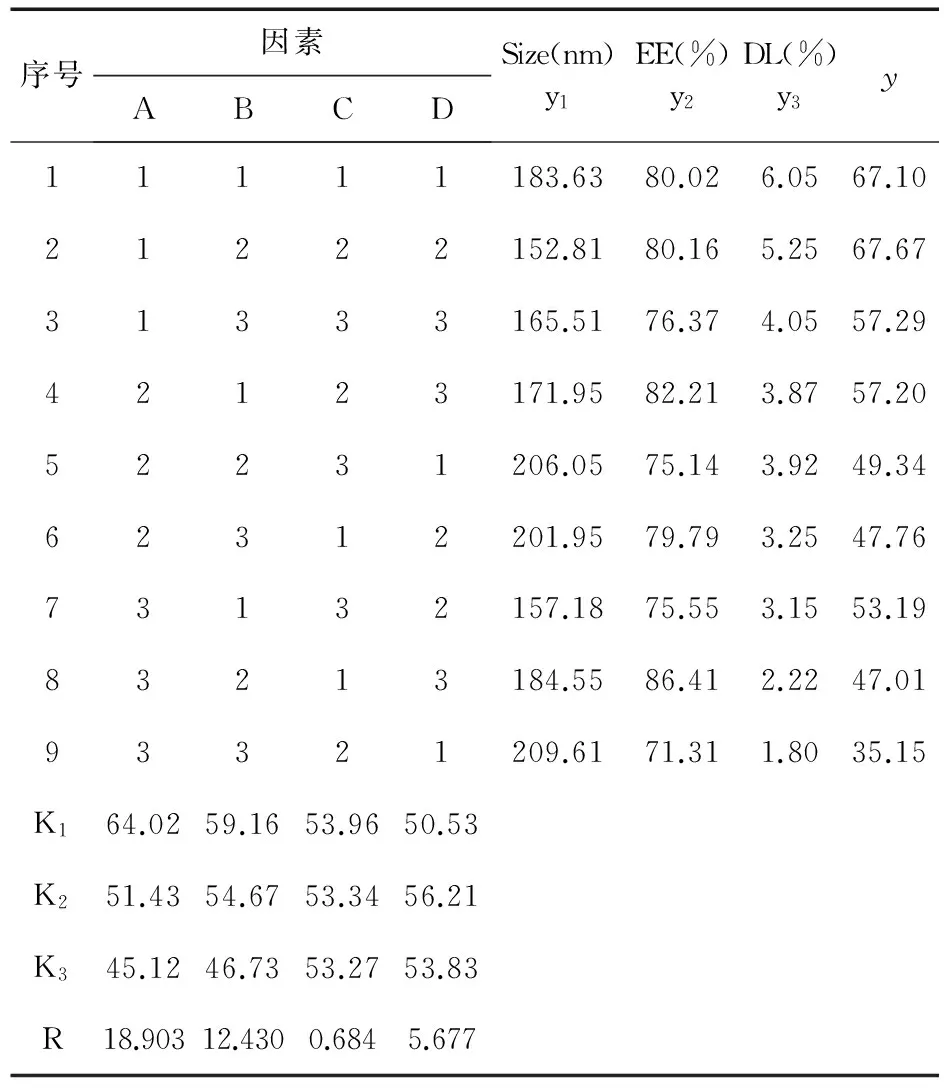
表3 正交试验设计和结果

表4 方差分析
3.2最佳工艺验证按“3.1”项下Cur-PLGA-NPs优化的处方工艺制备3批纳米粒混悬液,分别测定粒径、多分散系数、包封率和载药量,结果见表5。粒径、多分散系数、包封率和载药量分别为(120.33±2.44)nm、0.10±0.02、84.50%±1.13%、4.75%±0.22%(n=3)。纳米粒呈类圆形,大小及分布均匀,粒子间未见黏连和聚集现象,结果见图2。取适量NPs混悬液,蒸馏水稀释后粒径分析仪测定平均粒径,结果见图3。
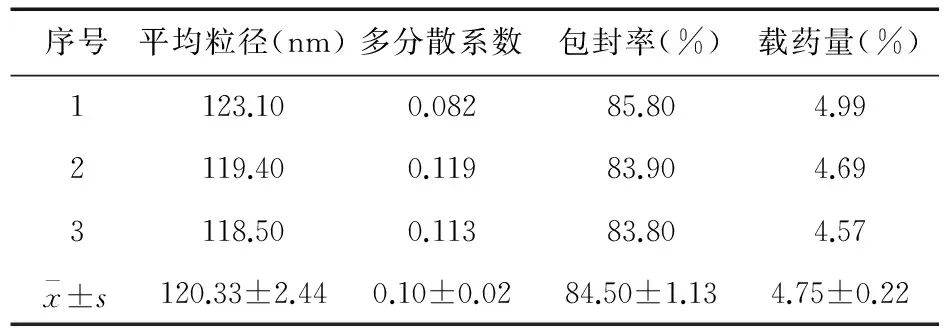
表5 验证试验结果

图2 Cur-PLGA-NPs透射电镜照片(×50 000)

图3 Cur-PLGA-NPs粒径分布
4讨论
本实验通过改良的自乳化溶剂挥发法制备纳米粒,采用丙酮和乙醇对药物、聚合物和分散剂三者不同的溶解度,以溶剂自发扩散的形式来制备Cur-PLGA-NPs。制备实验过程中,分别采用注射器、滴液漏斗和直接加入3种方式滴加有机相,结果表明,使用针头和滴液漏斗能得到较小粒径且分布均匀的纳米粒。可能是由于直接加入有机相的方式往往较难控制滴速,使有机相在水相中分布不均匀而分层,不利于纳米粒的包裹。而滴液漏斗和针头则以恒定的速度匀速滴加至水相,充分在水相中完全分布,有利于纳米粒的成型和粒径分布,通过实验发现滴液漏斗滴加制备得到的纳米粒粒径比注射器滴加更小,更均匀。故本实验选择滴液漏斗滴加的方式加入有机相。
正交试验结果表明,有机相体积和泊洛沙姆188浓度对NPs的粒径、包封率和载药量均具有显著影响。固定水相的体积,随着有机相体积增加(5~15 mL),NPs的粒径和PDI逐渐减小。因为在PLGA用量固定的情况下,PLGA的浓度随着有机相体积的增大而逐渐降低,黏度降低,纳米粒更易分散。但是随着有机相体积增加(15~35 mL),NPs的粒径和PDI则逐渐增大,可能是由于有机相的体积不能超过水相,否则会造成纳米粒不易分散,甚至乳滴间团聚[11]。制备稳定的纳米粒,表面活性剂的选用也很重要。本实验使用的表面活性剂泊洛沙姆188不仅具有空间位阻效应,抑制纳米粒聚集,增加溶液的稳定性;还可避免被网状内皮系统吞噬和抑制多药耐药相关蛋白的外排[12]。在实验过程中发现泊洛沙姆188在一定用量范围内,表面张力随着浓度增加而降低,使有机相在水相中分散,且在NPs表面形成一层亲水性膜,故NPs团聚的机会减少,粒径减小。但随着表面活性剂浓度进一步增大(>1.0%,w/v),其不能起到乳化作用,还会造成外水相过于黏稠,使NPs聚集,粒径增大,甚至出现严重的“突释”现象[13]。
纳米靶向治疗是以纳米粒为运输载体,将药物定向作用于靶器官,从而达到增效减毒的作用。研究表明,血管内给药,粒径100~200 nm的微粒系统能快速被网状内皮系统中的巨噬细胞从血液中清除,最终达到肝枯否细胞溶酶体中。本实验制备的纳米粒粒径为120 nm,满足肝靶向的粒径要求,同时也为进一步研究“纳米粒-脂质体系统”肝癌靶向治疗的体内行为、细胞行为和肝靶向机制奠定了良好的基础。
参考文献:
[1]Esatbeyoglu T,Huebbe P,Ernst IM,et al.Curcumin from molecule to biological function[J].Angew Chem Int Ed Engl,2012,51(22):5308-5332.
[2]霍红梅,张利元,江家贵.姜黄素抑制乳腺癌MCF-7细胞增殖及其相关的氧化应激机制[J].中国肿瘤生物治疗杂志,2009,(5):490-493.
[3]Anuchapreeda S,Thanarattanakorn P,Sittipreechacharn S,et al.Inhibitory effect of curcumin on MDR1 gene expression in patient leukemic cells[J].Arch Pharm Res,2006,29(10):866-873.
[4]Sa G,Das T.Anti-cancer effects of curcumin:cycle of life and death[J].Cell Div,2008,10(3):14.
[5]Dasi F,Martinez RP,March JA,et al.Real-time quantification of human telomerase reverse transcriptase mRNA in the plasma of patients with prostate cancer[J].Ann N Y Acad Sci,2006,1075(1):204-210.
[6]Anand P,Kunnumakkara AB,Newman RA,et al.Bioavailability of curcumin:problems and promises[J].Mol Pharm,2007,4(6):807-818.
[7]Zhang P,Ling G,Pan X,et al.Novel nanostructured lipid-dextran sulfate hybrid carriers overcome tumor multidrug resistance of mitoxantrone hydrochloride[J].Nanomedicine,2012,8:185-193.
[8]Messerschmidt SK,Musyanovych A,Altvater M,et al.Targeted lipid-coated nanoparticles:delivery of tumor necrosis factor-functionalized particles to tumor cells[J].J Controlled Release,2009,137(1):69-77.
[9]Van Schooneveld MM,Vucic E,Koole R,et al.Improved biocompatibility and pharmacokinetics of silica nanoparticles by means of a lipid coating:a multimodality investigation[J].Nano Letter,2008,8(8):2517-2525.
[10]戴东波,尤佳,何雯洁.姜黄素聚乙二醇-聚乳酸嵌段共聚物纳米粒的制备及其质量评价[J].中草药,2014,45(2):194-199.
[11]魏颖慧,赵燕敏,李静,等.壳聚糖修饰雷公藤多苷纳米粒的制备及其体外释药研究[J].中草药,2013,44(5):541-546.
[12]王石健,王彬辉,章文红,等.抗癫痫肽纳米粒的制备及体外释药性能的研究[J].实用药物与临床,2014,17(11):1445-1448.
[13]Liu MX,Dong J,Yang YJ,et al.Characterization and release of triptolide-loaded poly(D,L-lactic acid) nanoparticles[J].Eur Pol,2005,41(2):375-382.
Preparation of curcumin-loaded poly (lactic-co-glycolic acid) nanoparticles and analysis of its nature
LI Qing-yu1,YE Xiao-li1,CHEN Ling1,WANG Bin-hui2,LOU Jiang1,WANG Guo-wei3,YAN Wei1*
(1.Hangzhou First People′s Hospital,Hangzhou 310006,China;2.Taizhou Municipal Hospital,Taizhou 318000,China;3.Zhejiang Chinese Medical University,Hangzhou 310053,China)
[Abstract]ObjectiveTo prepare the curcumin poly (lactic-co-glycolic acid) copolymer (PLGA) nanoparticles (Cur-PLGA-NPs)and to investigate its nature.MethodsThe Cur-PLGA-NPs were prepared with modified solvent evaporation method and were optimized through orthogonal test according to particle size,entrapment efficiency and drug loading of Cur-PLGA-NPs.ResultsThe optimal conditions for preparation of Cur-PLGA-NPs included 100 mg PLGA,1.0% poloxamer 188 (m/V),acetone/ethanol 3∶1 (V/V) and 15 mL organic phase.The mean particle size of the resulted Cur-PLGA-NPs was (120.33±2.44) nm and the polydispersity index (PDI) was 0.10±0.02,and the average entrapment efficiency and drug-loading was 84.50%±1.13% and 4.75%±0.22%,respectively.ConclusionAn optimized nanoparticles drug delivery system is obtained by modified solvent evaporation method,which provides foundation for the further research of lipid-coated nanoparticles.
Key words:Curcumin;Nanoparticles;Poly (lactic-co-glycolic acid) copolymer;Orthogonal design
收稿日期:2015-10-10
*通信作者
DOI:10.14053/j.cnki.ppcr.201606027
