鞘内注射右美托咪定增加神经元自噬改善大鼠脊髓缺血再灌注损伤后神经运动功能
2016-07-19李晓倩
李晓倩,方 波,马 虹
鞘内注射右美托咪定增加神经元自噬改善大鼠脊髓缺血再灌注损伤后神经运动功能
李晓倩,方波,马虹*
中国医科大学附属第一医院麻醉科,沈阳 110001
[摘要]目的观察注射右美托咪定(Dexmedetomidine,DEX)预处理对在体大鼠脊髓缺血再灌注损伤(Spinal cord ischemia reperfusion injury,SCIRI)后神经元自噬和下肢运动功能的影响。方法SD大鼠随机分为4组(每组30只):假手术组(Sham组)、缺血再灌注损伤组(IR组,鞘内注射30 μL生理盐水)、Dex组(缺血前3 d鞘内注射右美托咪定10 μg/30 μL)、Dex+ATIP组(缺血前3 d鞘内注射10 μg右美托咪定+10 μg阿替美唑共30 μL)。Sham组仅暴露主动脉弓而不结扎,其他各组开胸后无创动脉夹夹闭主动脉弓14 min后再开放,建立SCIRI模型。各组手术前均于L5-6鞘内置管并连续注射3 d。损伤后48 h内每12 小时取5只大鼠,采用Tarlov法评价大鼠下肢运动功能;HE染色观察和计数损伤后48 h脊髓前角神经元形态和数量;Western blot和RT-PCR法测定损伤后48 h大鼠脊髓组织中自噬相关蛋白Beclin1、LC3蛋白及mRNA含量。结果与Sham组比较,术后各观察点IR组下肢运动功能明显受损,Tarlov评分下降,脊髓组织中Beclin1、LC3蛋白及mRNA的表达均明显降低(P<0.05);损伤前3 d鞘内注射10 μg DEX(Dex组)可改善缺血再灌注损伤后下肢运动功能,提高Tarlov评分,改善脊髓Beclin1、LC3 mRNA蛋白的表达(P<0.05),而Dex+ATIP组与IR组比较差异无统计学意义(P>0.05)。损伤后48 h,HE染色显示,Sham组脊髓前角神经元轮廓清晰,结构完整,无出血、水肿等异常表现;IR组、Dex+ATIP组细胞质中的尼氏体消失,神经元胞核出现固缩或溶解,广泛空泡形成;而Dex组神经元形态明显规整,且正常神经元数量增多。结论鞘内注射右美托咪定预处理通过上调Beclin1、LC3蛋白和基因表达,增加神经元自噬,改善大鼠缺血再灌注后下肢运动功能。
[关键词]鞘内注射;右美托咪定;自噬;Beclin1;LC3
0引言
脊髓缺血再灌注损伤(Spinal ischemia reperfusion injury,SCIRI)在临床常见于脊柱手术、动脉瘤手术、血管畸形手术以及心脏手术体外循环期间等,损伤平面以下感觉和运动缺失,引起四肢瘫痪、截瘫,甚至死亡,严重影响患者预后,造成巨大的经济和社会负担[1-3]。目前SCIRI病理学机制研究已成为现代医学和神经科学领域的难题和热点。如何有效地防治和最大限度地降低围术期SCIRI的发生率,保护神经功能,降低术后并发症,对改善患者的生存质量和降低医疗成本,均具有重要意义。自噬(Autophagy)是亚细胞膜结构发生动态变化并经溶酶体介导对细胞内蛋白质和细胞器降解的过程。近年研究表明,自噬现象广泛存在于脑缺血、脑卒中等神经系统疾病中,参与并影响了神经系统疾病的病理生理过程[4-5]。正常情况下,自噬处于一个低水平表达的状态;但当某些病理情况下,如缺血缺氧时,自噬可被迅速激活,通过平衡细胞合成和分解代谢,维持缺血再灌注后细胞的存活[6-7]。目前自噬在SCIRI领域的相关研究甚少。
右美托咪定(Dexmedetomidine,Dex)是一种新型高选择性肾上腺素能受体(α2AR)激动剂,具有镇静、镇痛和抗焦虑等作用[8]。越来越多的研究证实,全身和鞘内注射右美托咪定可抑制脊髓感受伤害性反应,激活神经系统相关保护信号通路,具有神经修复作用[9-10]。本研究旨在观察鞘内注射右美托咪定对SCIRI后大鼠下肢运动功能、脊髓组织中自噬相关蛋白Beclin1和微管相关蛋白1的轻链(LC3)表达的影响[11]。
1仪器与试药
雄性Sprague-Dawley大鼠120只,体重250~280 g,由中国医科大学实验动物中心提供。HE染液套盒(珠海贝索生物技术有限公司);兔抗Beclinl多克隆抗体,兔抗LC3单克隆抗体(购自武汉博士德);One step RT-PCR试剂盒(大连宝生物公司);图像分析系统(武汉华海公司,HIPAS-1000型);酶标仪(美国BIO-TEK公司,EIx800型)。
2实验方法
2.1实验分组大鼠随机分为4组,每组30只。非假手术组参照文献[2-3]制备脊髓缺血再灌注模型,并行L5-6鞘内置管。假手术组(Sham组):脊髓缺血前3 d鞘内注射生理盐水30 μL;缺血再灌注损伤组(IR组):同Sham组;鞘内右美托咪定预处理组(Dex组):缺血前3 d鞘内注射10 μg DEX (30 μL);Dex+ATIP组:缺血前3 d鞘内注射右美托咪定10 μg+阿替美唑10 μg(共30 μL)。1次/d,连续3 d。
2.2大鼠SCIRI模型的建立[2-3]水合氯醛腹腔注射麻醉大鼠后,常规消毒,右侧卧位,四肢固定于手术台上,胸背部去毛,消毒铺巾。沿肋缘切口逐层分离并暴露左肺上叶,面纱条肺部保护后由心包处开始分离主动脉,至主动脉弓左锁骨上动脉发出处上无创动脉夹夹闭14 min,之后撤除动脉夹,逐层缝合伤口。腹腔注射0.3 mL氨苄青霉素(100 mg/mL)。术后单笼饲养。
2.3神经运动功能评价以改良的Tarlov评分标准对下肢运动功能进行评价。0分:没有可觉察的下肢活动;1分:有可觉察的关节自主活动;2分:后肢可自由活动,但无法站立;3分:可站立,但无法行走;4分:后肢功能完全恢复,能正常行走。
2.4脊髓组织病理学检查(HE染色)完成神经行为学评分后处死大鼠,切除L3-4椎板,暴露L5-6节段硬膜囊,切断周围神经根;分离脊髓组织,10%甲醛固定48 h,分节段石蜡包埋、切片,苏木精-伊红(HE)染色后采用光学显微镜观察,计数脊髓前角正常神经元数目,观察神经元损伤情况。
2.5Western blot测定大鼠脊髓组织中Beclin1和LC3的蛋白表达提取组织蛋白质样品,电泳转移至PVDF膜上,分别加入兔抗LC3单克隆抗体(1∶500)、兔抗Beclinl多克隆抗体(1∶1 000)4 ℃过夜,洗膜后再用HRP标记的山羊抗兔IgG杂交,37 ℃ 2 h,ECL试剂X线胶片显像,扫描,以与β-actin的比值作为表达强度。
2.6RT-PCR测定大鼠脊髓组织中Beclin1和LC3的mRNA表达按试剂盒说明书操作。通过1%琼脂糖凝胶电泳和紫外分光光度仪检测提取总RNA的质量和浓度。引物序列如下:Beclin1:5′-GACCGAGTGACCATTCAGGAAC-3′(正向),5′-GGTTCTCCATGGTGCCACCATCAG-3′(反向);LC3:5′-GCACCATGCCGTCGGAGAAGACC-3′(正向),5′-CACTCCTAGGTGGGAACACTACTG-3′(反向);GAPDH:5′-TCGGCATTGTGGAGGGGCTC-3′(正向),5′-TCCCGTTCAGCTCGGGGATG-3′(反向)。在FTC2000型荧光定量PCR仪上行PCR。扩增条件如下:①94 ℃1 min,②94 ℃10 s,③55 ℃30 s,④72 ℃1 min,45个循环。退火期为55 ℃ 30 s。结束后,系统根据各反应管的荧光强度增长指数(DRn)绘制扩增动力学曲线,确定至特定阐值时的扩增循环数(Ct值),采用2-△△CT法处理数据。
3结果
3.1神经运动功能评价与Sham组比较,其余三组大鼠术后各观察点(尤以48 h为著)Tarlov评分均明显降低(P<0.05);与IR组比较,Dex组各时间点Tarlov评分明显升高(P<0.05);Dex+ATIP组与IR组各时间点评分比较差异无统计学意义(P>0.05),见图1。
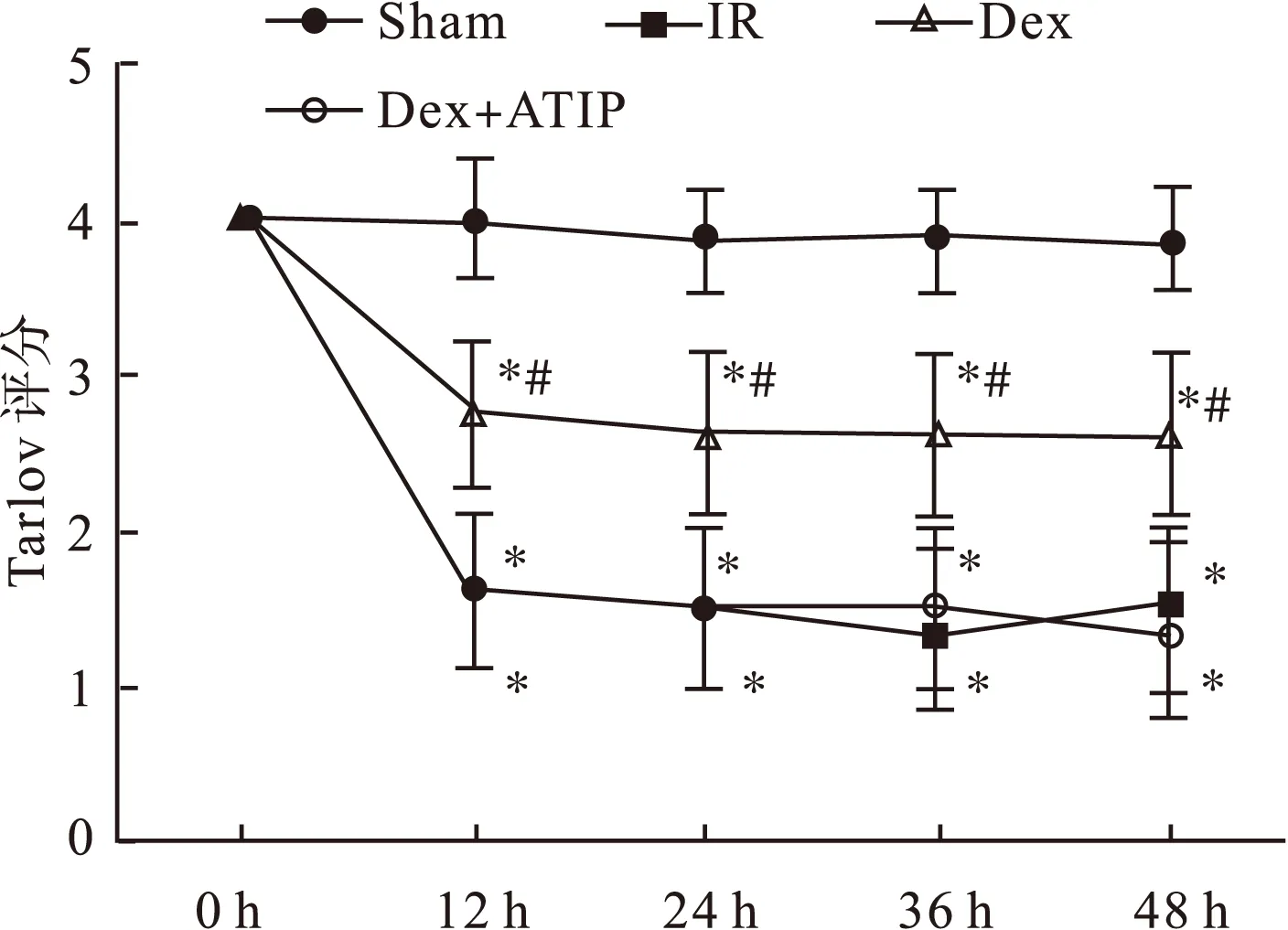
图1 缺血再灌注后大鼠下肢运动功能(Tarlov评分)变化(n=6)
3.2对脊髓组织结构的影响光镜下观察损伤后48 h脊髓组织病理变化,可见Sham组脊髓前角神经元轮廓清晰,细胞呈多角形,细胞核结构清晰,细胞质中可见尼氏体,无出血、水肿等异常;IR组、Dex+ATIP组中神经元胞体皱缩或溶解,胞质中的尼氏体消失,广泛空泡形成,炎性细胞浸润,正常运动神经元数目明显减少;Dex组神经元外观介于Sham组和IR组之间,可见神经元极性变钝,但结构相对清晰,可见到尼氏体。各组脊髓缺血再灌注损伤程度和脊髓前角正常神经元数目计数见图2。
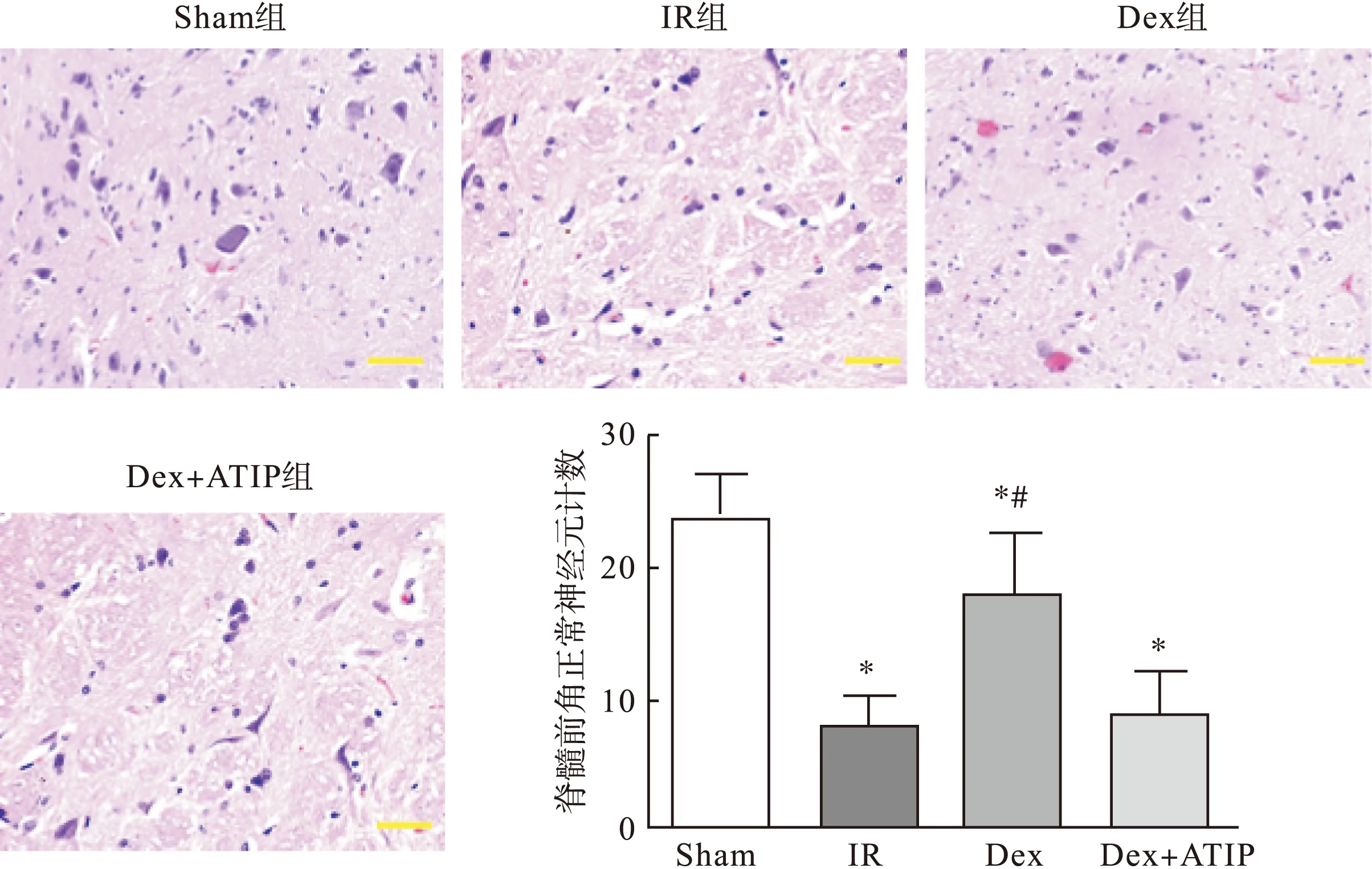
图2 鞘内注射DEX对SCIRI导致脊髓组织病理变化和前角正常神经元计数(400×)
3.3Western blot测定脊髓组织中自噬相关蛋白Beclin1和LC3的含量与Sham组比较,术后48 h,IR组大鼠脊髓组织中Beclin1和LC3蛋白表达明显降低(P<0.05),Dex组中表达明显增加(P<0.05);而IR组和Dex+ATIP组比较差异均无统计学意义(P>0.05),见图3。
3.4RT-PCR法测定脊髓组织中Beclin1和LC3 mRNA的含量与Sham组比较,术后48 h,IR 组大鼠脊髓组织中Beclin1和LC3 mRNA表达明显降低(P<0.05),Dex组中表达明显增加(P<0.05);而IR组和Dex+ATIP组比较差异均无统计学意义(P>0.05),见图4。
4讨论
SCIRI是指短暂缺血脊髓在恢复血液再灌注后,组织细胞功能代谢障碍及结构功能破坏反而加重的现象。炎症反应、神经元凋亡是SCIRI的主要特征[2-4,12]。DEX是新一代α2肾上腺素受体激动剂,通过激动脑干蓝斑,产生镇静、催眠、镇痛以及抑制交感兴奋、稳定血流动力学效应,在临床中广泛应用。最近研究发现,DEX在脑和心肌缺血再灌注损伤中可以通过降低血浆中儿茶酚胺的浓度、抑制凋亡相关蛋白,发挥神经保护作用[13-14]。但对其在SCIRI的神经保护作用的研究较少。越来越多的研究表明,全身和鞘内注射右美托咪定可抑制脊髓感受伤害性反应和激活神经系统相关保护信号通路,具有神经修复作用[9-10]。因此,本研究通过鞘内注射DEX,观察其对SCIRI后下肢运动功能的影响,探讨其发挥神经保护的可能机制。
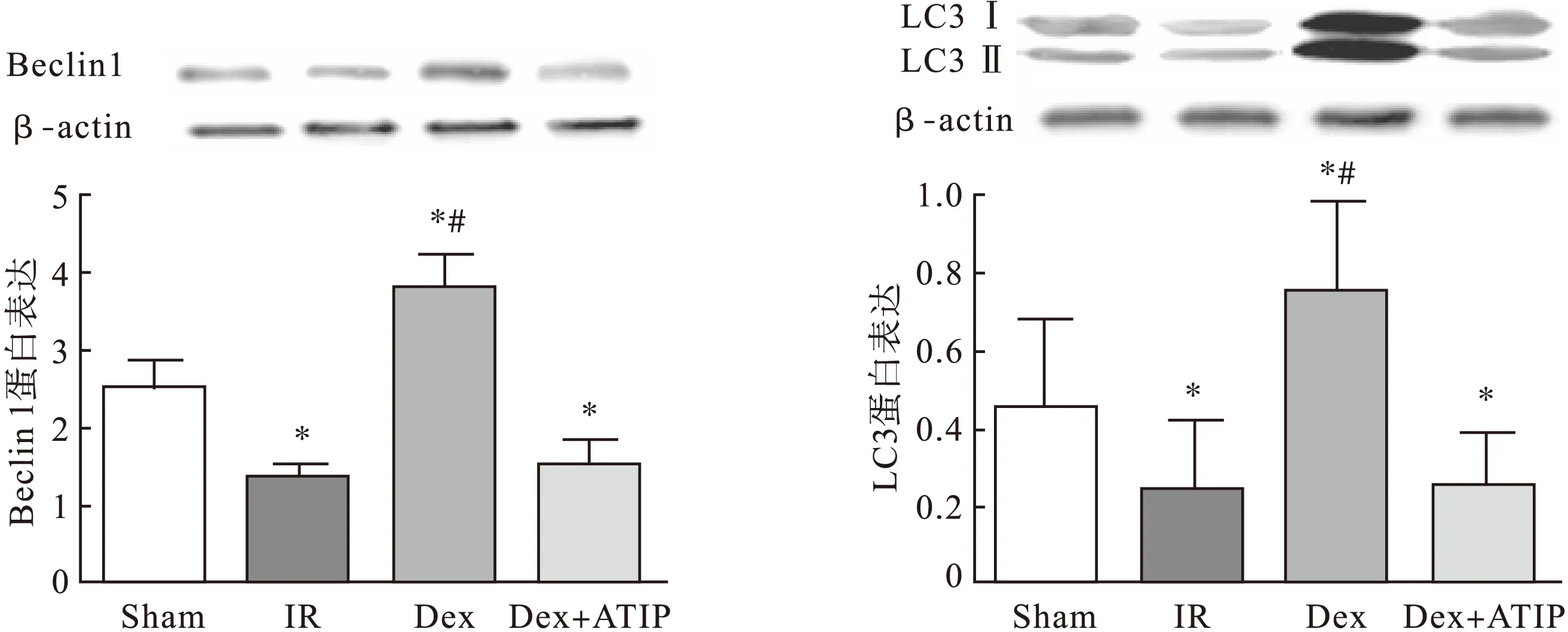
图3 Weston blot测定脊髓组织中自噬相关蛋白Beclin1和LC3的表达
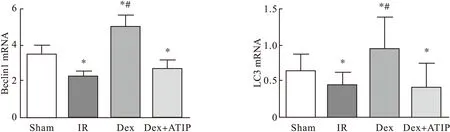
图4 RT-PCR测定脊髓组织中自噬相关蛋白Beclin1和LC3 mRNA
无创动脉夹夹闭主动脉弓模拟SCIRI是目前应用最广泛的动物模型之一,具有高度的重复性[2-3,9]。本实验观察显示,IR组大鼠术后各观察点Tarlov评分较Sham组降低,提示SCIRI可以引起下肢运动功能障碍。本研究中,Tarlov评分在术后48 h降低最明显,因此,选择术后48 h对脊髓组织进行病理学等的检查。HE染色结果显示,IR组神经元形态缺失,炎症和空泡化明显,脊髓前角正常神经元数目明显减少,而Dex组神经元形态基本完好,提示运动功能下降与神经元损伤密切相关,鞘内注射DEX可以维持运动神经元的形态和功能,且可被其特异性阻滞剂阿替美唑所抑制。
自噬广泛存在于真核细胞中,通过自噬溶酶体进行多种酶的消化及降解,维持细胞的自身稳态,净化自身多余或受损细胞[4,7]。正常情况下,自噬处于一个低水平表达的状态,适量自噬表达时,自噬体数量处于溶酶体的降解能力范围内,此时自噬的主要功能是为细胞提供能量,促进细胞存活[4,15]。病理情况下,细胞处于缺血缺氧状态,细胞内的三磷酸腺苷浓度迅速下降,引起单磷酸腺苷激活的蛋白激酶促进自噬形成,维持细胞功能[15]。既往研究发现,自噬参与脑缺血性和出血性疾病过程,影响了神经细胞的生存和死亡,且自噬途径的激活可能是缺血损伤早期的一种潜在的保护机制[7]。Beclin1和LC3是自噬相关的标记蛋白。Beclin1可以参与自噬体的形成,调节其他自噬蛋白在自噬前体膜的定位,是维持自噬/凋亡负反馈平衡的关键[16],而LC3Ⅱ则直接反映自噬发生程度[7]。本实验从蛋白和核酸水平证实,损伤后48 h,与Sham组比较,IR组Beclin1和LC3Ⅱ表达下降,而Dex组LC3Ⅱ表达明显上升,提示鞘内注射DEX可以诱导自噬发生,发挥神经保护作用,与郭倩等[17]研究结果一致。
综上所述,本研究通过观察鞘内注射右美托咪定对SCIRI模型中大鼠行为学、脊髓病理学、Beclin1和LC3蛋白、基因表达的影响,证实SCIRI损伤中可能存在自噬途径,鞘内注射DEX可以通过提高自噬相关蛋白Beclin1和LC3表达,提高Tarlov评分,改善下肢运动功能,揭示Dex对SCIRI发挥神经保护作用的潜在新机制,为临床改善脊髓损伤预后提供了新的治疗靶点。
参考文献:
[1]Svensson LG,Von Ritter CM,Groeneveld HT,et al.Cross-clamping of the thoracic aorta.Influence of aortic shunts,laminectomy,papaverine,calcium channel blocker,allopurinol,and superoxide dismutase on spinal cord blood flow and paraplegia in baboons[J].Ann Surg,1986,204(1):38-47.
[2]Li XQ,Lv HW,Tan WF,et al.Role of the TLR4 pathway in blood-spinal cord barrier dysfunction during the bimodal stage after ischemia/reperfusion injury in rats[J].J Neuroinflammation,2014,11:62.
[3]Li XQ,Wang J,Fang B,et al.Intrathecal antagonism of microglial TLR4 reduces inflammatory damage to blood-spinal cord barrier following ischemia/reperfusion injury in rats[J].Mol Brain,2014,7(1):28.
[4]Wu Z,Zhou Z,Zou R,et al.Electroacupuncture pretreatment induces tolerance against cerebral ischemia/reperfusion injury through inhibition of the autophagy pathway[J].Mol Med Rep,2015,11(6):4438-4446.
[5]Fan J,Zhang Z,Chao X,et al.Ischemic preconditioning enhances autophagy but suppresses autophagic cell death in rat spinal neurons following ischemia-reperfusion[J].Brain Res,2014,1562:76-86.
[6]Qi Z,Yan F,Shi W,et al.AKT-related autophagy contributes to the neuroprotective efficacy of hydroxysafflor yellow A against ischemic stroke in rats[J].Transl Stroke Res,2014,5(4):501-509.
[7]Wang P,Liang J,Li Y,et al.Down-regulation of miRNA-30a alleviates cerebral ischemic injury through enhancing Beclin 1-mediated autophagy[J].Neurochem Res,2014,39(7):1279-1291.
[8]Jung SH,Lee SK,Lim KJ,et al.The effects of single-dose intravenous dexmedetomidine on hyperbaric bupivacine spinal anesthesia[J].J Anesth,2013,10:10-16.
[9]Fang B,Li XQ,Bi B,et al.Dexmedetomidine attenuates blood-spinal cord barrier disruption induced by spinal cord ischemia reperfusion injury in rats[J].Cell Physiol Biochem,2015,36(1):373-383.
[10]Ma J,Zhang XL,Wang CY,et al.Dexmedetomidine alleviates the spinal cord ischemia-reperfusion injury through blocking mast cell degranulation[J].Int J Clin Exp Med,2015,8(9):14741-14749.
[11]Masuda GO,Yashiro M,Kitayama K,et al.Clinicopathological correlations of autophagy-related proteins LC3,Beclin 1 and p62 in gastric cancer[J].Anticancer Res,2016,36(1):129-136.
[12]艾琪勇,罗越,刘辉,等.脊髓缺血再灌注损伤的发病机制与治疗进展[J].实用医学杂志,2014,30(6):2678-2680.
[13]Reynolds PM,Mueller SW,MacLaren R.A comparison of dexmedetomidine and placebo on the plasma concentrations of NGF,BDNF,GDNF,and epinephrine during severe alcohol withdrawal[J].Alcohol,2015,49 (1):15-19.
[14]Yoshitomi O,Cho S,Hara T,et al.Direct protective effects of dexmedetomidine against myocardial ischemia-reperfusion injury in anesthetized pigs[J].Shock,2012,38(1):92-97.
[15]Zhou KL,Zhou YF,Wu K,et al.Stimulation of autophagy promotes functional recovery in diabetic rats with spinal cord injury[J].Sci Rep,2015,5:17130.
[16]Kang R,Zeh HJ,Lotze MT,et al.The Beclin 1 network regulates autophagy and apoptosis[J].Cell Death Differ,2011,18(4):571-580.
[17]郭倩,余音,潘乾广,等.白藜芦醇保护脑缺血/再灌注损伤与自噬关系的研究[J].中国药理学通报,2013,29(7):995-998.
Intrathecal injection with dexmedetomidine to improve neural motor function in rats with spinal cord ischemia reperfusion injury
LI Xiao-qian,FANG Bo,MA Hong*
(Department of Anesthesiology,the First Affiliated Hospital of China Medical University,Shenyang 110001,China)
[Abstract]ObjectiveTo observe the effects of intrathecal injection with dexmedetomidine on neuropathic autophagy and lower extremities motor function in rat model of spinal cord ischemia reperfusion injury (SCIRI).MethodsMale Sprague-Dawley rats were randomly divided into 4 groups(n=40):Sham group,IR group,Dex group and Dex+ATIP group.The NS 30 μL,DEX 10 μg (30 μL) and DEX 10 μg+atipamezole 10 μg (30 μL)was administered intrathecally for 3 d before surgery in IR group,Dex group and Dex+ATIP group,respectively.The lumbar intrathecal catheters were implanted in L5-6of rats and SCIRI models were established by aortic arch occlusion for 14 min.The lower extremities motor function was assessed by Tarlov scores.HE staining was performed for observing the neuronal morphology and counting the number of normal neurons in anterior horn of injured spinal cord at 48 h after IR.The spinal mRNA and protein expressions of Beclin1 and LC3 were assessed by Western blot and real-time PCR.ResultsCompared with Sham group,the lower extremities motor function in IR group was injured,and the Tarlov scores were decreased with lower expression of mRNA and protein of Beclin1and LC3 in spinal cord at 48 h after injury.Intrathecal injection with dexmedetomidine(Dex group) could increase the Tarlov scores,and improve the lower extremities motor function after ischemia reperfusion injury and the expression of mRNA and protein of Beclin1 and LC3 in the spinal cord(P<0.05),while no significant difference was observed between Dex+ATIP group and IR group.HE staining showed that Sham group had clear outline and complete structure of spinal cord anterior horn motor neurons without abnormal appearance of bleeding or edema at 48 h after IR injury.The Nissl substance in IR group and Dex+ATIP group disappeared with condensation or dissolution in nucleus of neurons and wide cytoplasmic vacuolating formation.The shape of neuron in Dex group was clear,and the number of normal neuron increased.ConclusionIntrathecal injection with dexmedetomidine can enhance the neuron autophagy,improve the lower extremities motor function after ischemia reperfusion injury by up-regulating the expression and protein of Beclin1 and LC3 in spinal cord.
Key words:Intrathecal injection;Dexmedetomidine;Autophagy;Beclin1;LC3
收稿日期:2016-01-14
基金项目:辽宁省科学技术计划项目(2012408002);国家自然科学基金(81271370)
*通信作者
DOI:10.14053/j.cnki.ppcr.201606002
