ABCB1基因多态性与甲基化对氯吡格雷和阿司匹林抵抗影响的研究进展
2016-07-19李新刚赵志刚
赵 坤,李新刚,赵志刚
ABCB1基因多态性与甲基化对氯吡格雷和阿司匹林抵抗影响的研究进展
赵坤,李新刚*,赵志刚*
首都医科大学附属北京天坛医院药学部,北京 100050
[摘要]氯吡格雷联合阿司匹林的双重抗血小板治疗是预防介入术后缺血事件再发生的标准药物治疗方案。然而仍有部分患者会出现氯吡格雷抵抗和阿司匹林抵抗现象。两种药物产生抵抗存在很多方面的影响因素,如患者的依从性、给药剂量、遗传因素等。遗传因素为主要因素,相关研究较多。目前,已经发布了CYP2C19基因多态性的药物剂量调整指南,但ABCB1基因对两种药物抵抗影响的研究并未达成一致的结论。本文对ABCB1基因多态性与甲基化对氯吡格雷抵抗和阿司匹林抵抗的影响进行综述,主要包括:氯吡格雷和阿司匹林抵抗的概念,ABCB1基因多态性与两药抵抗相关性,ABCB1基因启动子区域甲基化差异对药物抵抗的影响等。
[关键词]氯吡格雷抵抗;阿司匹林抵抗;ABCB1基因;多态性;甲基化
0引言
脑血管病已成为我国国民死亡原因之首,其中脑卒中是单病种致残率最高的疾病[1],严重危害了人类健康和生命安全。我国脑血管病患者中约70%为缺血性脑卒中[2]。氯吡格雷联合阿司匹林的双重抗血小板治疗已成为预防介入术后缺血事件再发生的标准药物治疗方案[3]。然而两种药物的抗血小板作用在患者之间存在很大的个体差异,部分患者仍会发生缺血事件,即出现氯吡格雷抵抗和阿司匹林抵抗现象。有报道,氯吡格雷、阿司匹林单独服用以及两药联合服用后抵抗的发生率分别为25.7%、17.1%和5.7%[4]。影响氯吡格雷和阿司匹林抵抗的决定性因素是遗传因素。转运体、药物代谢酶和药物受体的基因变异是药物反应产生个体差异的主要原因[5]。国内外专家学者也把研究的重点放在对氯吡格雷和阿司匹林抵抗的相关基因的研究,已经发布了CYP2C19基因多态性的药物剂量调整指南。目前对影响药物吸收ABCB1基因的研究也较多,但该基因对两药抵抗影响的研究并未达成一致的结论。ABCB1多态性和甲基化程度对药物吸收的影响,以及对氯吡格雷和阿司匹林抵抗的影响方面的明确结论亟待解决。
1氯吡格雷抵抗和阿司匹林抵抗
1.1氯吡格雷抵抗氯吡格雷是一种噻吩吡啶类的ADP受体拮抗剂抗血小板药物。1997年,美国食品药品管理局(FDA)就已经推荐氯吡格雷作为心肌梗死、脑卒中等疾病的二级预防用药[6]。
近年研究发现,氯吡格雷的抗血小板作用的个体化差异很大。部分患者尽管长期服用常规剂量(300 mg/d负荷量,维持量75 mg/d)的氯吡格雷,临床上仍不能有效地预防缺血性事件的发生,未达到预期的疗效,即出现氯吡格雷抵抗,也可称为氯吡格雷无反应或者低反应[7],但目前对于氯吡格雷抵抗并没有一个明确的标准定义。ADP诱导的血小板聚集率是广泛应用于检测氯吡格雷疗效的指标,目前国外研究多以用药后血小板聚集率与基线水平的差值≤10%的标准视为存在药物抵抗。将20 μmol/L ADP诱导的血小板聚集率的差值<10%定义为氯吡格雷无反应,10%~29%为氯吡格雷低反应,≥30%为正常[8]。目前检测血小板功能有多种方法,广泛应用的有比浊法(LTA)、血管扩张剂刺激磷蛋白(VASP)法、全血阻抗法、PFA-100和快速血小板功能分析仪(VerifyNow)[9]。
1.2阿司匹林抵抗阿司匹林是环氧化酶1 (COX-1)抑制剂类抗血小板药物,一般与氯吡格雷联合使用,作为双重抗血小板的药物治疗。临床发现并不是所有依从性好的患者均能得到较好的抗血小板作用,仍会有血栓的生成和栓塞事件的发生,出现阿司匹林抵抗[10],即服用常规剂量(300 mg/d负荷量,维持量100 mg/d)阿司匹林,不能有效抑制血小板功能及抑制血栓素合成,用10 μmol/L ADP诱导的血小板平均聚集率≥70%和用0.5 mg/L花生四烯酸(AA)诱导的平均聚集率≥20%称为阿司匹林抵抗[11]。临床阿司匹林抵抗,即规律服用常规剂量阿司匹林后,仍不能减少或避免缺血事件的发生[12]。但目前对阿司匹林抵抗也没有公认的定义。
2ABCB1基因多态性与氯吡格雷和阿司匹林抵抗
ABCB1是ATP结合盒亚家族B运载体1,也称多药耐药基因,编码一种质子泵P糖蛋白,具有外排作用,影响多种药物的吸收[13]。该蛋白为转运蛋白,能在ATP供能下将进入细胞内的作用底物主动泵出细胞外[14],在人体许多正常组织中,如肝脏、肾脏、肠道、血脑屏障和淋巴细胞等都有表达[15]。所以ABCB1基因的多态性与氯吡格雷、阿司匹林抵抗存在相关性。
到目前为止,在不同人群中共发现了近50个单核苷酸多态性,其中19个位于外显子区域,18个位于内含子区,11个为非同义突变[16]。对 ABCB1的基因表达、蛋白结合能力影响较大的3个SNPs分别为:第12外显子C1236T、第21外显子G2677T/A、第26外显子C3435T[17]。3个位点的变异与药物抵抗是否存在相关性仍存在争议。
2.1ABCB1基因多态性与氯吡格雷抵抗ABCB1编码的P-gp的表达量多少以及活性强弱可以影响氯吡格雷在肠内的吸收[18]。
目前,研究较多的是ABCB1的C3435T多态性与氯吡格雷抵抗的相关性。Mega等[19]发现,在2 932例服用氯吡格雷的患者中,ABCB1的3435TT基因型患者发生临床抵抗事件的风险是3435CT和3435CC患者的2倍左右。携带ABCB1 3435TT基因型个体的氯吡格雷抗血小板作用减弱。Wang等[20]研究了401例接受氯吡格雷常规治疗方案的急性冠脉综合征患者,测定氯吡格雷的血浆浓度及其活性和非活性代谢物的浓度。发现ABCB1 3435TT携带者的氯吡格雷血浆浓度相对于非携带者较低,氯吡格雷的抗血小板作用降低。Calderón-Cruz等[21]在对276例接受经皮冠状动脉介入治疗的患者的研究发现,22.1%的患者出现氯吡格雷抵抗,显示ABCB1的3435 TT基因型与氯吡格雷的反应相关联。Simon等[22]发现,在所研究的人群中,ABCB1 3435TT基因型的氯吡格雷血清浓度和活性的代谢产物减少,该基因的多态性与药物抵抗存在相关性。也有研究显示,携带ABCB1 3435TT基因的患者发生死亡、非致命性卒中、心肌梗死等事件的风险高于未携带者[23]。
Meta分析显示,ABCB1 C3435T位点基因多态性与氯吡格雷抵抗在亚洲地区有相关性,而在欧洲地区无相关性[24]。还有研究发现,ABCB1基因G2677T/A的基因型频率和等位基因分布频率在抵抗组和非抵抗组的差异无统计学意义(P>0.05)。中国汉族人群ABCB1基因G2677T/A多态位点与抵抗不存在相关性[25]。
2.2ABCB1基因多态性与阿司匹林抵抗有研究认为,阿司匹林抵抗并不存在,因肠溶阿司匹林致药物的吸收延迟而产生的“假抵抗”现象普遍存在,但长期服药(>7 d)后均未发现真正意义上的阿司匹林抵抗[26]。影响药物吸收的因素是使药物产生抵抗的重要因素,相关研究报道较少,Jeong等[27]研究认为,ABCB1基因C3435T位点的变异与东亚急性心肌梗死患者双重抗血小板药物(阿司匹林联合氯吡格雷)治疗下的不良事件不存在相关性。未见其他相关报道。ABCB1基因与阿司匹林抵抗是否存在相关性有待进一步研究。
3ABCB1甲基化与药物抵抗
在表观遗传修饰中,DNA的甲基化是其中一种重要形式。DNA甲基化将活化的甲基引入胞嘧啶的第5位碳原子上,在不改变DNA碱基序列的基础上使得基因的表达受到调控[28]。在基因的启动子区或第一外显子区存在高度密集的CpG序列,称CpG岛,只有CpG岛中的胞嘧啶可被甲基化。ABCB1基因启动子区域CpG二核苷酸含量较高(见图1)。哺乳动物的DNA甲基化多发生于CpG二核苷酸上,启动子区域的甲基化在整个基因DNA甲基化中占有举足轻重的地位[29]。近来研究还发现,ABCB1启动子区域甲基化程度的差异可以在许多细胞系中影响P-gp的表达[30]。
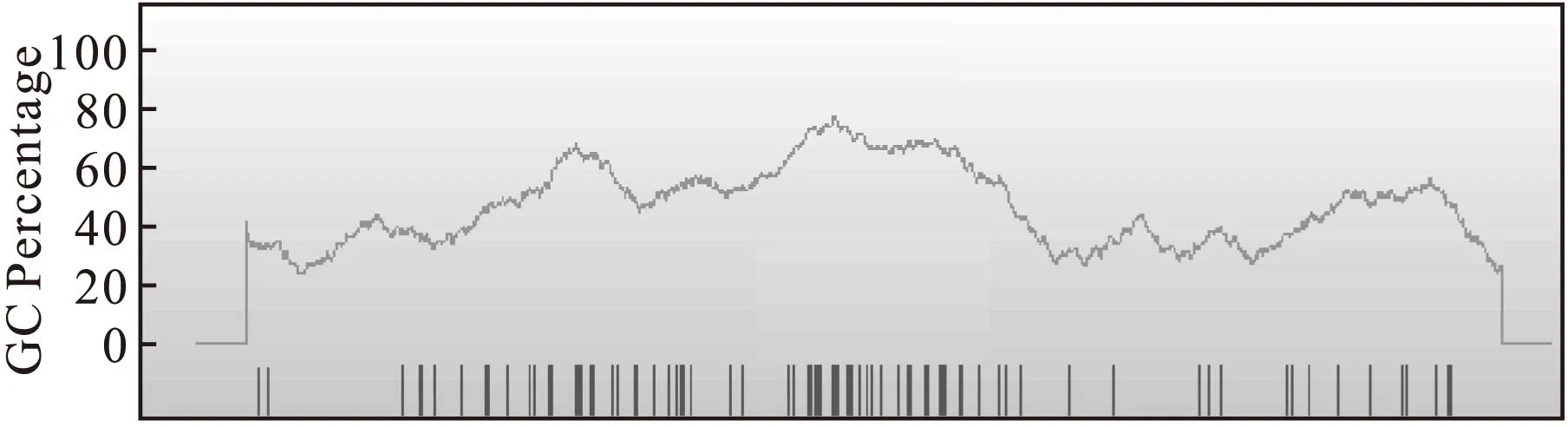
图1 ABCB1基因启动子区域CpG二核苷酸含量示意图
ABCB1基因启动子区甲基化与氯吡格雷抗血小板效果的关系的相关研究较少。Yang等[31]发现,在87例服用氯吡格雷的中国缺血性卒中患者(CYP2C19*1/*1基因型)中,根据最大血小板聚集(Maximum platelet aggregation,MPA)值分为4组,即Q1、Q2、Q3、Q4,MPA(Q1)<14.1%,MPA(Q4)>35.4%。结果发现,Q1组的ABCB1启动子甲基化水平是Q4组的1.8倍;Q1组的ABCB1表达是Q4组的0.62倍;并且ABCB1的表达与ADP诱导的最大血小板聚集呈正相关。研究表明,ABCB1启动子区甲基化水平与基因表达和最大血小板聚集率之间呈负相关,低甲基化是氯吡格雷抵抗的一个重要因素。然而ABCB1基因启动子区甲基化差异对阿司匹林抵抗的影响未见文献报道。
4结语
尽管存在氯吡格雷和阿司匹林抵抗,氯吡格雷联合阿司匹林仍是不可替代的防治缺血性事件的重要药物。ABCB1与两药的吸收直接相关,虽然该基因的多态性研究结果存在争议,但甲基化研究刚刚起步,有大量的未知信息有待于挖掘。该研究将有助于阐明药物抵抗的发生机制,指导临床调整抗血小板治疗方案,减少或避免临床不良事件的发生。基于基因多态性检测技术的药物基因组学已经被广泛应用于临床,在提高药物疗效、调整药物剂量以及减少不良反应方面发挥了重要作用,开辟了个体化医疗的新局面[32]。
参考文献:
[1]陈竺.全国第三次死因回顾抽样调查报告[M].北京:中国协和医科大学出版社,2008.
[2]赵德秀,王磊.缺血性脑卒中氯吡格雷抵抗与基因多态性的研究进展[J].北京师范大学学报(自然科学版),2010,46(4):448-451.
[3]Wong KS,Chen C,Fu J,et al.Clopidogrel plus aspirin versus aspirin alone for reducing embolisation in patients with acute symptomatic cerebral or carotid artery stenosis (CLAIR study):a randomised,open-label,blinded-endpoint trial[J].Lancet Neurol,2010,9(5):489-497.
[5]陈碧莲.抗血小板药物氯吡格雷的遗传药理学研究[D].长沙:中南大学,2007.
[6]赵玉亭.CYP450s及ABCB1基因多态性与缺血性脑卒中的复发风险的相关性研究[D].福州:福建医科大学,2014.
[7]杨蓉,吴方.氯吡格雷抵抗的研究进展[J].国际内科学杂志,2009,36(7):428-431.
[8]Lau WC,Gurbel PA,Watkins PB,et al.Contribution of hepatic cytochrome P450 3A4 metabolic activity to the phenomenon of clopidogrel resistance[J].Circulation,2004,109(2):166-171.
[9]肖迎平,韩玮,魏玉杰,等.氯吡格雷抵抗研究进展[J].医学综述,2013,19(11):2048-2051.
[10]Hankey GJ,Eikelboom JW.Aspirin resistance[J].Lancet,2006,367(9510):606-617.
[11]Patrono C.Aspirin resistance:definition mechanisms and clinical read-outs[J].Thromb Haemost,2003,1(8):1710-1713.
[12]Bhatt DL,Topol EJ.Scientific and therapeutic advances in antiplatelet therapy[J].Nat Rev Drug Discov,2003,2(1):15-28.
[13]韩运峰,冯艳萍,张树林.氯吡格雷抵抗的药物基因组学研究进展[J].中国分子心脏病学杂志,2010,10(4):249-253.
[14]徐萍.ABCB1遗传多态性和表观遗传学差异对P-糖蛋白功能的影响[D].长沙:中南大学,2008.
[15]Ceckova-Novotna M,Pavek P,Staud F.P-glycoprotein in the placenta:expression,localization,regulation and function[J].Reprod Toxicol,2006,22(3):400-410.
[16]Chinn LW,Kroetz DL.ABCB1 pharmacogenetics:progress,pitfalls,and promise[J].Clin Pharmacol Ther,2007,81(2):265-269.
[17]Hamidovic A,Hahn K,Kolesar J.Clinical significance of ABCB1 genotyping in oncology[J].J Oncol Pharm Pract,2010,16(1):39-44.
[18]Taubert D,von Beckerath N,Grimberg G,et al.Impact of P-glycoprotein on clopidogrel absorption[J].Clin Pharmacol Ther,2006,80(5):486-501.
[19]Mega JL,Close SL,Wiviott SD,et al.Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITON-TIMI 38 trial:a pharmacogenetic analysis[J].Lancet,2010,376(9749):1312-1319.
[20]Wang XQ,Shen CL,Wang BN,et al.Genetic polymorphisms of CYP2C19 2 and ABCB1 C3435T affect the pharmacokinetic and pharmacodynamic responses to clopidogrel in 401 patients with acute coronary syndrome[J].Gene,2015,558(2):200-207.
[21]Calderón-Cruz B,Rodríguez-Galván K,Manzo-Francisco LA,et al.C3435T polymorphism of the ABCB1 gene is associated with poor clopidogrel responsiveness in a Mexican population undergoing percutaneous coronary intervention[J].Thromb Res,2015,136(5):894-898.
[22]Simon T,Verstuyft C,Mary-Krause M,et al.Genetic determinants of response to clopidogrel and cardiovascular events[J].N Engl J Med,2009,360(4):363-375.
[23]Momary KM,Dorsch MP,Bates ER.Genetic causes of clopidogrel nonresponsiveness:which ones really count[J].Pharmacotherapy,2010,30(3):265-274.
[24]彭锐,张洪,张英,等.氯吡格雷抵抗与ABCB1 3435C>T基因位点多态性的Meta分析[J].中国药学杂志,2015,50(10):909-912.
[25]李国标,苏启表,古宏标,等.ABCB1基因位点G2677T/A单核苷酸多态性与氯吡格雷抵抗的相关性研究[J].广东药学院学报,2013,29(5):552-556.
[26]Grosser T,Fries S,Lawson JA,et al.Drug resistance and pseudoresistance:an unintended consequence of enteric coating aspirin[J].Circulation,2013,127(3):377-385.
[27]Jeong YH,Tantry US,Kim IS,et al.Effect of CYP2C19*2 and *3 loss-of-function alleles on platelet reactivity and adverse clinical events in East Asian acute myocardial infarction survivors treated with clopidogrel and aspirin[J].Circ Cardiovasc Interv,2011,4(6):585-594.
[28]Herman D,Leakey TI,Behrens A,et al.CHST11 gene expression and DNA methylation in breast cancer[J].Int J Oncol,2015,46(3):1243-1251.
[29]Schübeler D.Function and information content of DNA methylation[J].Nature,2015,517(7534):321-326.
[30]Takane H,Kobayashi D,Hirota T,et al.Haplotype-oriented genetic analysis and functional assessment of promoter variants in the MDR1 (ABCB1) gene[J].J Pharmacol Exp Ther,2004,311(3):1179-1187.
[31]Yang J,Zhou JS,Zhao YX,et al.ABCB1 hypomethylation is associated with decreased antiplatelet effects of clopidogrel in Chinese ischemic stroke patients[J].Pharmazie,2015,70(2):97-102.
[32]刘治军,胡欣,傅得兴.药物基因组学在个体化医疗中的应用进展和实例[J].药品评价,2010,20:41-47.
Research advances in the effect of ABCB1 gene polymorphism and methylation on clopidogrel and aspirin resistance
ZHAO Kun,LI Xin-gang*,ZHAO Zhi-gang*
(Department of Pharmacy,Beijing Tiantan Hospital,Capital Medical University,Beijing 100050,China)
[Abstract]The standard strategy in preventing the recurrence of the ischemic event after interventional treatment for ischemic stroke is dual antiplatelet therapy with clopidogrel plus aspirin.However,some patients still have clopidogrel and aspirin resistance.Many factors can affect clopidogrel and aspirin resistance,such as the patient′s compliance,dose,genetic factors and so on.The related researches on genetic factors have been reported.The drug dosing guidelines of CYP2C19 gene polymorphism have been released,but the correlation of ABCB1 gene with resistances has not reached a consistent conclusion.This article summarizes the relationship of ABCB1 gene polymorphism and methylation with clopidogrel and aspirin resistance,including the concept of clopidogrel and aspirin resistance,the association of ABCB1 gene polymorphisms with two drugs resistances and the impact of ABCB1 gene promoter methylation on drug resistance.
Key words:Clopidogrel resistance;Aspirin resistance;ABCB1 gene;Polymorphism;Methylation
收稿日期:2015-10-14
基金项目:脑血管病转化医学北京市重点实验室开放课题(2014NXGZ01)
*通信作者
DOI:10.14053/j.cnki.ppcr.201606033
