血糖波动对糖尿病大鼠氧化应激及神经病变的影响
2016-07-18马香香李亚坤陈慧晓赵志刚
马香香 李亚坤 陈慧晓 赵志刚
(郑州大学人民医院 内分泌科 河南 郑州 450003)
血糖波动对糖尿病大鼠氧化应激及神经病变的影响
马香香李亚坤陈慧晓赵志刚
(郑州大学人民医院 内分泌科河南 郑州450003)
【摘要】目的研究血糖波动对糖尿病大鼠神经病变的影响及氧化应激的作用。方法将SD大鼠随机分为3组:正常对照组(NC组)、稳定高血糖组(DS组)、波动高血糖组(DF组)。采用链脲佐菌素腹腔注射诱发糖尿病,DF组每天定时腹腔注射胰岛素及葡萄糖,建立血糖波动模型,同时DS组给予等体积的生理盐水建立稳定高血糖模型。12周后测定坐骨神经运动传导速度(MNCV),检测血清丙二醛(MDA)、谷胱甘肽(GSH)。 结果与NC组比较,DS组和DF组大鼠坐骨神经MNCV减慢(P<0.05),血清MDA增高、GSH水平下降(P<0.05);与DS组相比,DF组MNCV进一步减慢(P<0.05),MDA增高、 GSH水平下降(P<0.05)。结论波动高血糖可使糖尿病大鼠神经病变加重,其机制可能与氧化应激水平增高有关。
【关键词】血糖波动;神经病变;氧化应激
糖尿病神经病变作为糖尿病并发症之一,是主要的致残原因,严重影响患者的生存质量,发病机制尚未明确[1]。以往研究多针对慢性持续性高血糖的作用,而关于波动性高血糖对神经损伤的报道仍属少见,且主要是细胞实验及临床观察[2-3]。细胞实验发现血糖波动较持续性高血糖雪旺细胞氧化应激水平表达增高,细胞凋亡指数更高[2]。为此,本实验通过建立糖尿病血糖波动模型,通过检测氧化应激相关指标,探讨血糖波动对糖尿病神经病变的影响及可能机制,为临床选取平稳降糖模式,避免血糖波动提供基础证据。
1材料和方法
1.1实验动物分组选择无特定病原体(SPF)级SD雄性大鼠60只,200 g左右,购自河南省实验动物中心,随机分为正常对照组(NC组,n=16)和模型组(MC组,n=44),模型组腹腔注射STZ 60 mg/kg,建立糖尿病模型,72 h后测随机血糖,>16.7 mmol/L表示糖尿病造模成功。将糖尿病模型组随机分为持续高血糖组(DS组,n=20)和血糖波动组(DF组,n=20)。DF组于每天(8:30 am,14:30 pm)腹腔注射葡萄糖液2.5 g/kg。于每天(9:00 am,15:00 pm)腹腔注射胰岛素3 U制备糖尿病血糖波动大鼠模型,NC组和DS组均同时腹腔注射等量生理盐水。于12周后颈内静脉取血分离血清,用于血清学指标的测定。
1.2实验试剂及仪器STZ(美国Sigma公司);谷胱甘肽(glutathione,GSH)、丙二醛(methane dicarboxylic aldehyde,MDA)、大鼠糖化血红蛋白测定试剂盒(南京建成生物研究所);血糖仪、血糖试纸(拜安康);NTS-2000肌电图与诱发电位仪(上海诺诚医疗器械有限公司)。
1.3血糖及糖化血红蛋白测定血糖波动组造模成功后,每周检测1 d 7个时间点血糖,分别是(08:30、09:00、11:00、14:30、15:00、17:00、22:00)。12周末颈内静脉采血测糖化血红蛋白。
1.4氧化应激标志物的检测血糖波动组造模12周后,颈内静脉取血分离血清,MDA、GSH含量严格按照试剂盒测定。
1.5坐骨神经传导速度测定血糖波动组造模12周后,测大鼠坐骨神经运动传导速度(motor nerve conduction velocity,MNCV)。方法:麻醉大鼠,固定四肢,分离坐骨神经,采用肌电图与诱发电位仪测量坐骨神经MNCV。

2结果
2.1一般情况大鼠适应性喂养1周后禁食12 h,注射STZ(60 mg/kg)后,72 h内4只大鼠死亡,余存活的40只大鼠随机分为DS组20只,DF组20只。12周后NC组大鼠精神好、毛发光洁、摄食摄水量正常;DF和DS组大鼠均出现多饮多食多尿,毛乱无光泽,萎靡消瘦;DF组较DS组大鼠活动更少,更加消瘦;12周后DF组余16只;持续余17只,12周后3组大鼠体质量差异有统计学意义(P<0.05)。见表1。
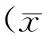
表1 血糖波动12周大鼠体质量及HbA1C水平比较±s)
注:与NC组比较,aP<0.05;与DS组比较,bP<0.05,cP>0.05。
2.2血糖波动每周1 d 7次进行血糖监测,NC组血糖波动在4.5~6.5 mmol/L,DS组19.5~25.6 mmol/L,DF组6.4~30.5 mmol/L。12周末测3组大鼠糖化血红蛋白(HbA1c),与NC组相比,DS组和DF组的HbA1c显著增高,差异有统计学意义(P<0.05);与DS组相比,DF组HbA1C稍降低,但差异无统计学意义(P>0.05)。见表1。
2.312周末坐骨神经MNCV与NC组相比,DS组和DF组的MNCV明显减慢,差异有统计学意义(P<0.05);与DS组相比,DF组MNCV明显减慢,差异有统计学意义(P<0.05)。见表2。
2.4第12周氧化应激指标与NC组相比,DS和DF组MDA水平明显升高,GSH水平明显下降,差异有统计学意义(P<0.05);与DS组相比,DF组MDA表达水平升高,GSH水平表达下降,差异有统计学意义(P<0.05)。见表2。

表2 血糖波动12周坐骨神经MNCV,血MDA、
注:与NC组比较,dP<0.05;与DS组比较,eP<0.05。
3讨论
目前研究认为糖尿病神经病变的机制主要是高糖毒性、氧化应激、神经营养、微血管病变及自身免疫等多因素相互作用,导致神经细胞损伤,神经纤维缺血性脱髓鞘,引起神经病变,其中氧化应激是神经病变的核心机制。神经组织对氧化应激高度敏感,其核心是高糖环境下线粒体呼吸链中活性氧生成过多,引起氧化应激,造成神经炎症、细胞凋亡导致神经损伤[1]。近年研究表明,在HbA1C相同的情况下,血糖波动较大者发生慢性并发症的风险增加[4]。研究发现,慢性间断高血糖与持续高血糖相比,更能引起心肌细胞、胰岛细胞的凋亡,其氧化应激水平更高[5-6];波动高血糖较持续高血糖更能提高氧化应激水平,促进肾脏系膜细胞的凋亡[7];此外血糖波动是死亡率一个重要的独立预测指标[8]。为此本实验错时腹腔注射胰岛素及葡萄糖,造成1 d内血糖最大波动幅度,建立血糖波动模型,探索血糖波动对糖尿病神经病变的影响及可能机制。
丙二醛(MDA)反映脂质过氧化的程度,可间接反映细胞损伤的程度;谷胱甘肽(GSH)是一种低分子自由基、过氧化氢和脂质过氧化物清除剂,起到保护细胞膜结构和功能完整的作用,故MDA、GSH是重要的氧化应激标志物,提示机体氧化应激水平。本实验中,与正常组相比,DS及DF组MDA水平显著增高(P<0.05),GSH水平明显下降(P<0.05),提示稳定性高血糖和波动性高血糖糖尿病大鼠较正常大鼠氧化应激水平明显增高;与DS组相比,DF组MDA水平升高、GSH水平下降更明显(P<0.05),提示血糖波动较稳定高血糖可加剧糖尿病机体的氧化应激反应。
神经传导速度代表有髓神经纤维的功能,已经成为诊断周围神经病变的“金标准”。与正常组相比,DS组及DF组大鼠坐骨神经MNCV明显减慢(P<0.05),提示稳定高血糖组和波动高血糖组大鼠较正常对照组其神经功能严重受损。与DS组相比,DF组坐骨神经MNCV进一步减慢(P<0.05),提示血糖波动可加剧神经功能受损,加重神经病变。
综上所述,高血糖情况下氧化应激是神经病变的核心机制,本实验结果波动高血糖组较稳定高血糖组有更高的氧化应激水平,坐骨神经传导速度也进一步减慢,提示血糖波动可加重神经病变,其机制可能与血糖波动增加氧化应激水平有关,因此避免血糖波动已成为糖尿病患者治疗面临的又一新挑战。
参考文献
[1]Sandireddy R,Yerra V G,Areti A,et al.Neuroinflammation and oxidative stress in diabetic neuropathy:futuristic strategies based on these targets[J].Int J Endocrinol,2014,2014:674987.
[2]Sun L Q,Xue B,Li X J,et al.Inhibitory effects of salvianolic acid B on apoptosis of schwann cells and its mechanism induced by intermittent high glucose[J].Life Sci,2012,90(3-4):99-108.
[3]王国凤,尹冬,徐宁,等.血糖波动与糖尿病周围神经病变的相关性[J].中国糖尿病,2014,22(2):115-117.
[4]Hirseh I B.Glycemic:it’s not just about A1C any more![J].Diabetes Technol Ther,2005,(7):780-783
[5]Zhang W,Zhao S,Li Y,et al.Acute blood glucose fluctuation induces myocardial apoptosis through oxidative stress and nuclear factor-κB activation[J].Cardiology,2013,124(1):11-17.
[6]Shi X L,Ren Y Z, Wu J. Intermittent high glucose enhances apoptosis in INS-1 cells[J].Exp Diabetes Res,2011,2011:754673.
[7]许益笑,王德选,李素娟,等.血糖波动对糖尿病大鼠肾脏氧化应激与凋亡的影响[J].中华内分泌与代谢杂志,2012,28(4):325-329.
[8]Krinsley J S.Glycemic variability:a strong independent predictor of mortality in critically ill patients[J].Crit Care Med,2008,36(11):3008-3013.
Effects of oscillating blood glucose level on oxidative stress and diabetic neuropathy in diabetic rats
Ma Xiangxiang,Li Yakun,Chen Huixiao,Zhao Zhigang
(DepartmentofEndocrinologyandMetabolism,thePeople’sHospitalofZhengzhouUniversity,Zhengzhou450003,China)
【Abstract】ObjectiveTo explore the effects of oscillating blood glucose on oxidative stress and diabetic neuropathy in diabetic rats. MethodsSD rats were randomly divided into 3 groups: normal control group (NC group), diabetes sustained hyperglycemia group (DS group), diabetes fluctutating hyperglycemia group (DF group). Streptozotoein-induced diabetic model was established with SD rats and the oscillating high blood glucose animal model was induced by intraperitoneal injection of insulin and glucose at different time points every day. At the same time, DS group was given the same volume of physiological saline to establish the stable high blood glucose animal model. 12 weeks later,sciatic motor nerve conduction velocity (MNCV), blood malondialdehyde (MDA) and glutathione (GSH) were determined. ResultsCompared with NC group, the DS and DF groups had a significant increase of MDA and a decrease of MNCV, GSH(P<0.05). There was a significant increase of MDA and a decrease of MNCV, GSH in the rats with oscillating blood glucose than those with stable high blood glucose(P<0.05). ConclusionOscillating high blood glucose could induce more severe neuropathy and the mechanism may be related to the increased oxidative stress.
【Key words】diabetic neuropathy;oscillating high blood glucose;oxidative stress
通讯作者:赵志刚,E-mail:mxx123xx@126.com。
【中图分类号】R 363
doi:10.3969/j.issn.1004-437X.2016.06.002
(收稿日期:2015-10-21)
