高效液相色谱法同时检测稻田样品中5种除草剂的残留量
2016-07-18龚道新张小东聂红英杨丽华
吴 亮,龚道新, *,张小东,聂红英,杨丽华
(湖南农业大学 a.资源环境学院;b.农业环境保护研究所,湖南 长沙410128)
高效液相色谱法同时检测稻田样品中5种除草剂的残留量
吴亮a,龚道新a, b*,张小东a,聂红英b,杨丽华a
(湖南农业大学 a.资源环境学院;b.农业环境保护研究所,湖南 长沙410128)
摘 要:建立一种高效液相色谱法同时检测稻田土壤、稻田水和糙米中二甲四氯、2,4,5–T、高效氟吡甲禾灵、精吡氟禾草灵和精喹禾灵5种除草剂残留的方法。土壤样品用0.05%磷酸溶液和乙腈混合液(体积比为1∶2)提取,水样品用乙酸乙酯萃取,糙米样品用0.04 mol/L NaOH提取,用弗罗里硅土柱净化。采用带紫外检测器的高效液相色谱仪测定,以乙腈与水为流动相梯度洗脱,在紫外波长229 nm下检测,用外标法定量。结果表明,5种除草剂在质量浓度0.05~5.00 mg/L的线性关系良好,相关系数(R)达0.999 7~0.999 9;土壤和糙米中添加水平为0.05~1.00 mg/kg时,5种除草剂的平均回收率为78.8%~107.8%,相对标准偏差(RSD≤7.5, n=5)为1.1%~9.2%;当水中添加水平为0.01~0.50 mg/L时,平均回收率为86.2%~109.2%,相对标准偏差(RSD≤6.5, n=5)为1.2%~6.5%。5种除草剂的检出限为0.01~0.02 mg/kg。方法在土壤、糙米和水样中的定量限分别为0.05、0.05 mg/kg和0.01 mg/L。该方法的前处理过程简单,且准确度、精密度和灵敏度均符合农药残留分析的技术要求。
关 键 词:高效液相色谱法;除草剂;稻田水;稻田土壤;糙米;农药残留
投稿网址:http://xb.ijournal.cn
氯代苯氧羧酸类除草剂为内吸性激素类选择性除草剂。此类除草剂的水溶性较强,难被生物降解,在使用过程中极易造成土壤和水体污染[1]。芳氧苯氧丙酸酯类除草剂是近 20年来在氯代苯氧羧酸类除草剂的基础上进一步优化开发而成的,其优异的活性和极高的选择性,使其在世界除草剂市场的地位日趋重要,但其对生态环境产生的影响也日渐增大[2–3]。目前,对除草剂残留的分析由对单一除草剂的单项检测逐渐向对多种除草剂的多残留分析发展,多采用液相色谱法或液相色谱质谱联用法测定[4–7],如丁春霞等[8]采用高效液相色谱法测定了植烟土壤和水中3种芳氧苯氧丙酸脂类除草剂的残留;程静等[9]利用液相色谱串联质谱法测定了大米、小麦、玉米等谷物中6中苯氧羧酸类除草剂的残留。
GB2763—2014中规定了糙米中二甲四氯的最大残留限量(MRL)为0.05 mg/kg。高效氟吡甲禾灵、精吡氟禾草灵和精喹禾灵属芳氧苯氧丙酸脂类除草剂在谷物类上的最大残留限量,目前尚无明确规定。二甲四氯和2,4,5–T属氯代苯氧羧酸类除草剂被广泛应用于小麦、水稻、大豆、玉米等的生产过程中[10–11]。已有的多残留分析方法都偏向于检测其中的1类,且大多是对水、土壤和农产品等的除草剂残留量进行测定,对稻田环境样品中上述2类除草剂残留的分析方法尚少见报道。笔者基于高效液相色谱梯度洗脱技术,建立了同时测定稻田土壤、水和糙米中5种除草剂的高效液相色谱分析方法,旨在为除草剂的科学施用及对环境安全进行全面评价提供技术支撑。
1 材料与方法
1.1 试验样品
样品均取自湖南农业大学教学科研田间水稻试验基地(取样区域未使用过上述5种除草剂)。用取土器多点随机取耕作层(0~15 cm)土壤样品约1 kg,去碎石、杂草和植物根茎等杂物后混匀,装入样本容器中保存,备用。于水稻分蘖期随机采集稻田水2 000 mL,装入封口塑料瓶中保存,备用。于水稻成熟收获期随机采集稻谷约1 kg,晒干后用砻谷机脱壳,用粉碎机粉碎后装入密封袋中。上述制备好的样品于-20 ℃下保存,备用。
1.2 主要仪器与试剂
主要仪器:Agilent Technologies 1260 型高效液相色谱仪(美国安捷伦科技有限公司,配有紫外检测器和化学工作站);RE–2000A 型旋转蒸发器(上海亚荣生化仪器厂);CCA–20 低温冷却水循环泵(巩义市予华仪器有限责任公司);2HWY–2102型恒温振荡器(上海智城分析仪器制造有限公司)。
主要试剂:甲醇(江苏汉邦科技有限公司)、乙腈、乙酸乙酯、正己烷、二氯甲烷、磷酸(天津恒兴化学试剂有限公司);无水硫酸钠、氯化钠(天津市博迪化工有限公司);氟罗里硅土(150~250 μm,650℃烘烤3 h,加5%水失活后使用)。以上试剂除甲醇、乙腈为HPLC级外,其余均为A.R.级。二甲四氯标准品(纯度为95.0%)、2,4,5–T标准品(纯度为97.0%)、高效氟吡甲禾灵标准品(纯度为95.3%)、精吡氟禾草灵标准品(纯度为94.8%)和精喹禾灵标准品(纯度为96.7%)均购于阿拉丁试剂(上海)有限公司。
1.3 混合标准溶液的配制及液相色谱条件
用乙腈分别配制二甲四氯、2,4,5–T、高效氟吡甲禾灵、精吡氟草灵、精喹禾灵储备液(1 000 mg/L),根据需要,将混合中间标准溶液用乙腈梯度稀释成试验所需质量浓度的混合标准工作溶液。
色谱柱:Agilent zorbax C18柱(4.6 mm×250 mm,5 μm);柱温40 ℃;流速0.8 mL/min;进样量20 μL;流动相A为磷酸水溶液(pH=3),B为乙腈。梯度洗脱条件见表1。
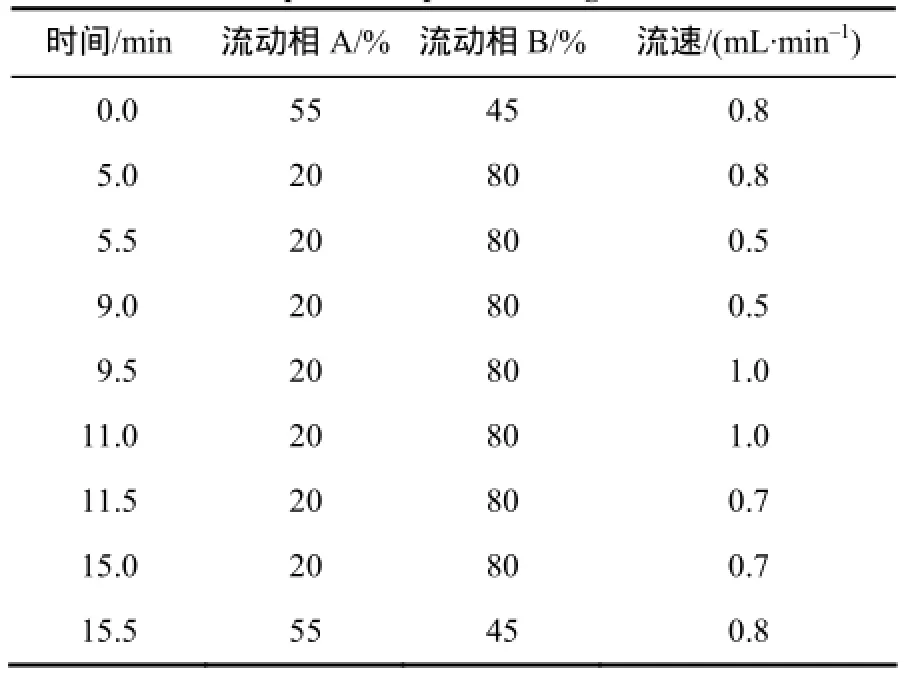
表1 流动相及梯度洗脱条件Table 1 Mobile phase composition for gradient and elution
在此条件下,二甲四氯、2,4,5–T、高效氟吡甲禾灵、精喹禾灵和精吡氟草灵的保留时间分别约为7.2、8.5、12.0、13.4、14.7 min。
1.4 样品的提取及提取浓缩液的净化
1.4.1 稻田土壤样品的提取
准确称取稻田土壤样品20.0 g,并将其置于250 mL具塞三角瓶中,加入60 mL 0.05%磷酸溶液与乙腈的混合液(体积比为1∶2),在恒温振荡器中振荡提取30 min,用布式漏斗减压抽滤,将抽滤液转移至100 mL具塞玻璃试管中,加入8.0 g氯化钠,剧烈振摇1 min,静置10 min后,准确移取上层乙腈30 mL至三角瓶中,在旋转蒸发仪上42 ℃浓缩近干,用色谱乙腈定容至5.0 mL,过0.45 μm有机系滤膜,供HPLC检测。
1.4.2 稻田水样品的提取
准确量取稻田水样 100 mL,并将其置于 250 mL分液漏斗中,用 20%的磷酸溶液调节水样 pH值至2~3,再加入10.0 g氯化钠,摇匀,待氯化钠溶解后静置5 min。分别用40、30、20 mL乙酸乙酯萃取3次,收集乙酸乙酯层萃取液过装有无水硫酸钠的筒型漏斗,合并萃取液,在旋转蒸发仪上浓缩近干,用色谱乙腈定容至5.0 mL,过0.45 μm有机系滤膜,供HPLC检测。
1.4.3 糙米样品的提取
准确称取糙米样品10.0 g,并将其置于离心管中,加入0.04 mol/L的氢氧化钠溶液30 mL,恒温振荡1 h后离心5 min(4 000 r/min),收集全部上层清液,用磷酸调pH至pH<3,加入10.0 g氯化钠和40 mL乙酸乙酯剧烈振摇1 min,4 000 r/min离心5 min,移取上层有机相45 mL,旋蒸至近干,用2 mL乙酸乙酯和甲醇混合液(体积比为3∶7)溶解,待弗罗里硅土层析柱净化。
1.4.4 提取浓缩液的净化
层析柱中的填充物从下至上依次为少许脱脂棉、2.0 g无水硫酸钠、3.5 g弗罗里硅土、2.0 g无水硫酸钠。先用10 mL乙酸乙酯和甲醇混合液(体积比为 3∶7)预淋,再将上述提取浓缩液无损失移入弗罗里硅土净化柱中,用50 mL乙酸乙酯和甲醇混合液(体积比为3∶7)少量,多次洗脱,收集全部洗脱液,于旋转蒸发仪上浓缩近干,再用色谱乙腈定容至2.0 mL,待HPLC检测。
1.5 标准曲线的绘制及添加回收试验
1.5.1 标准曲线的绘制
在上述选定的HPLC条件下,5种除草剂的回归方程、线性相关系数(R)和检出限见表2。
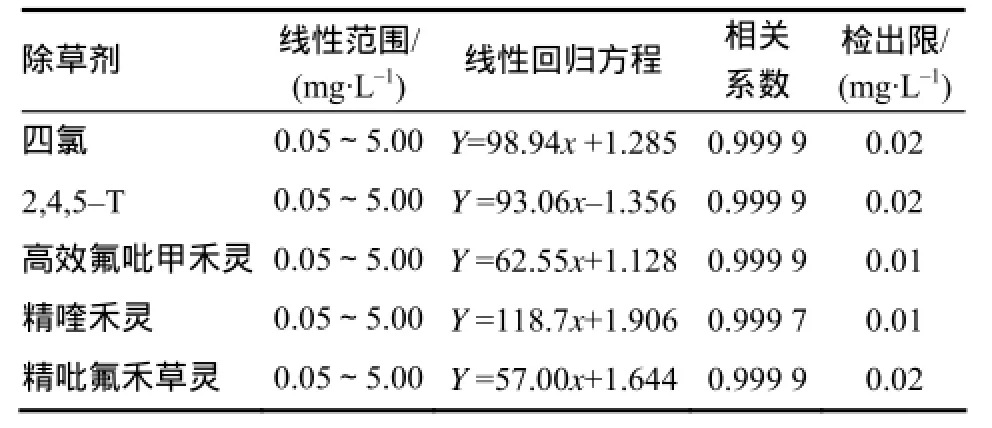
表2 5种除草剂的回归方程、线性相关系数和检出限Table 2 Regression equation, linear correlation coefficient and detection limits of five herbicides
1.5.2 添加回收试验
在稻田土壤、田间水和糙米中分别添加3个不同浓度的二甲四氯、2,4,5–T、高效氟吡甲禾灵、精喹禾灵和精吡氟禾草灵混合标准溶液,每个浓度水平样品重复5次,按优选的方法进行处理和测定。
2 结果与分析
2.1 各样品提取剂的选取
2.1.1 稻田土壤提取溶剂的确定及适宜提取条件
稻田土壤采用乙腈和磷酸混合提取,提取方法简单,杂质较少,无需净化。进一步考察乙腈与磷酸的不同比例及磷酸的不同浓度对提取效率的影响,发现乙腈与磷酸体积比大于 2∶1后回收率不再增加,且磷酸的浓度对提取效率的影响较大,回收率随提取体系磷酸浓度的升高而升高,但提取杂质也随提取体系磷酸浓度的升高而增多。杂质增多导致进行HPLC分析时基线不稳定。综合考虑,认为以体积比为 1∶2的 0.05%磷酸和乙腈混合液为提取溶剂较为适宜。
2.1.2 稻田水提取溶剂的确定
二氯甲烷、正己烷和乙酸乙酯对稻田水样中目标物质提取效果的考察结果表明,用二氯甲烷虽能获得良好的提取效果,但提取物中有一杂质对高效氟吡甲禾灵的测定有严重干扰;用正己烷提取时二甲四氯与2,4,5–T的回收率很低,仅为20%左右,而其他3种目标物质的回收率均在90%以上,这可能是因为二甲四氯与2,4,5–T的极性较大,易溶解于水相;用极性比正己烷更大的乙酸乙酯提取时,5种目标物的回收率均较理想。综合考虑,选取乙酸乙酯作为稻田水的提取溶剂。
2.1.3 糙米提取溶剂的确定及适宜提取条件
参照已有谷物类除草剂的提取方法,考察2种提取方式对糙米的提取效果, 结果表明,NaOH溶液提取后再经乙酸乙酯液液分配萃取的杂质比直接用酸性溶液提取的杂质要少得多,对目标物的干扰也明显较少。此外,离心分离比分液漏斗多次萃取的分离简便,且不产生乳化现象。综合考虑,认为对糙米的适宜提取方式为先在碱性条件下提取,再用乙酸乙酯萃取后离心。
2.2 净化条件的确定
净化试验结果表明,中性氧化铝和酸性氧化铝对5种目标物质的吸附性太大,严重影响回收率。硅胶柱净化虽杂质少,但5种目标物质回收率的差异大。弗罗里硅土虽对二甲四氯与2,4,5–T有一定的吸附性,但整体净化效果好。由体积比2∶8、3∶7、 4∶6的乙酸乙酯和甲醇对5种目标物的洗脱率可知,用50 mL乙酸乙酯和甲醇(体积比为3︰7)洗脱,过填装有3.5 g弗罗里硅土的层析柱进行净化的效果较好,5种除草剂的回收率均符合农药残留分析的要求,故选用弗罗里硅土作提取液的净化剂,用乙酸乙酯和甲醇混合体系作洗脱溶剂。
2.3 HPLC检测条件
2.3.1 检测波长的选择
5种目标物的紫外最大吸收波长均为220~236 nm,考虑到特定波长下5种目标物质均需具备较好的灵敏度和特异性,通过对比试验,认为 229 nm为比较适宜的检测波长。
2.3.2 分离条件的优化
弱有机酸二甲四氯与2,4,5–T在甲醇或乙腈–水流动相体系 C18柱分离条件下出峰较快,不利于与杂质分离,高效氟吡甲禾灵、精吡氟禾草灵与精喹禾灵的出峰较慢,单一条件下进行同时分析的保留时间过长,为缩短分析时间,采用梯度洗脱提高分离效果。试验中发现以乙腈作流动相能获得比甲醇更好的分离效果,其典型色谱图见图1。

1 二甲四氯;2 2,4,5–T;3 高效氟吡甲禾灵;4 精喹禾灵;5 精吡氟禾草灵。混合标准溶液浓度为1.00 mg/L。图1 5种除草剂混合标准工作溶液的高效液相色谱图Fig.1 HPLC chromatogram of the working standard solution mixed with five herbicides
2.4 方法的准确度、精密度和回收率
添加回收试验结果(表3、表4、表5、图2)表明:5种除草剂在稻田土壤中的添加回收率为88.7%~107.8%,相对标准偏差为1.1%~7.5%(表3);在稻田水中的添加回收率为86.2%~109.2%,相对标准偏差为1.2%~6.5%(表4);在糙米中的添加回收率为78.7%~95.2%。方法的精密度和准确度均符合农药残留分析与检测的技术要求[12]。

表3 5种除草剂在稻田土壤中的添加回收率及相对标准偏差Table 3 Fortified recoveries and relative standard deviation of five herbicides in paddy soil

表4 5种除草剂在稻田水中的添加回收率及相对标准偏差Table 4 Fortified recoveries and relative standard deviation offive herbicides in paddy water
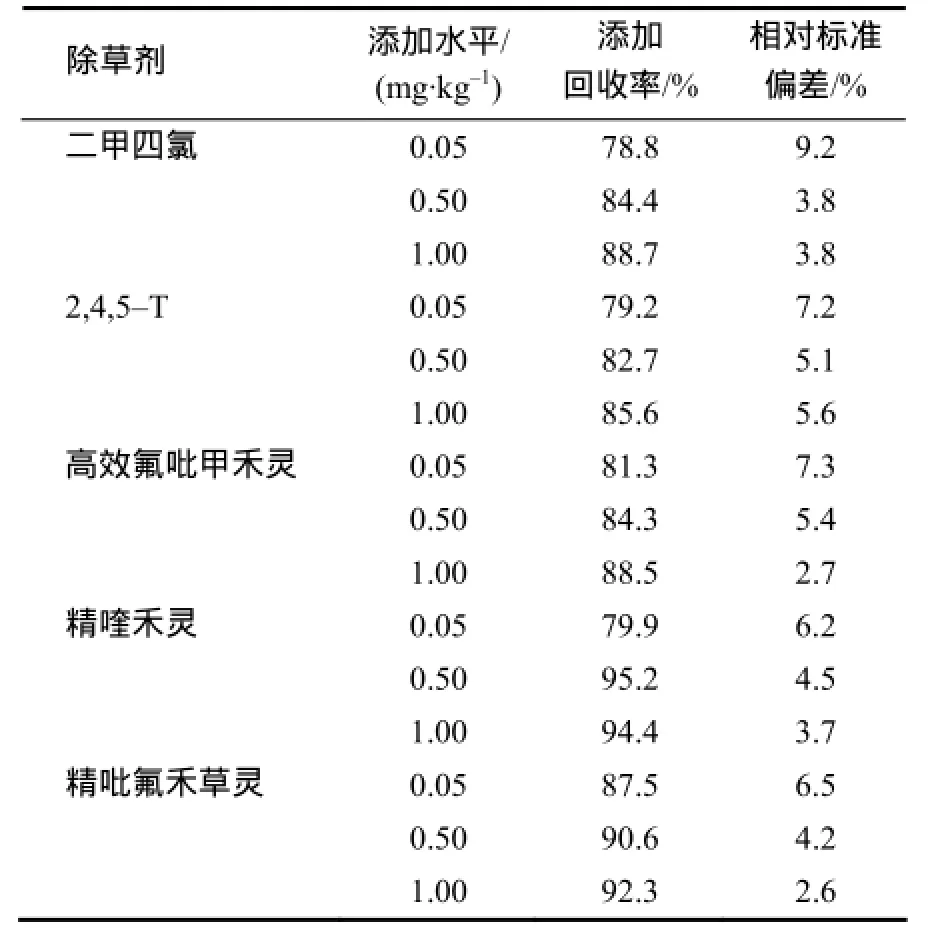
表5 5种除草剂在糙米中的添加回收率及相对标准偏差Table 5 Fortified recoveries and relative standard deviation of five herbicides in coarse rice

a 土壤空白样品;b 土壤样品添加5种除草剂(0.50 mg/kg);c 水空白样品;d 水样中添加5种除草剂(0.05 mg/L);e 糙米空白样品;f 糙米样品中添加5种除草剂(0.50 mg/kg)。1 二甲四氯;2 2,4,5–T;3 高效氟吡甲禾灵;4 精喹禾灵;5 精吡氟禾草灵。图2 稻田空白样品及其添加回收的高效液相色谱图Fig.2 HPLC chromatogram of blank sample and addition recovery samples of the rice field
3 结论与讨论
试验结果表明:稻田土壤样品用乙腈与0.05%磷酸溶液的混合液提取;稻田水样用乙酸乙酯提取;糙米样品用0.04 mol/L溶液提取,经乙酸乙酯萃取离心分离后再经弗罗里硅土层析柱净化,采用HPLC流动相乙腈与水梯度洗脱,在紫外波长229 nm下进行分析检测,5种除草剂在质量浓度0.05~5.00 mg/L的线性关系良好,土壤和糙米在0.05、0.50、1.00 mg/kg 3个添加水平下的平均回收率为78.8%~107.8%,相对标准偏差为1.1%~9.2%,稻田水样在0.01、0.05、 0.50 mg/L 3个添加水平下的平均回收率为86.2%~109.2%,相对标准偏差为1.2%~6.5%。5种除草剂的检出限为0.01~0.02 mg/kg,方法在土壤、糙米和水样中的定量限分别为0.05、0.05 mg/kg和0.01 mg/L。该方法操作简便,分离效果好,可用于对稻田土壤、田间水和糙米中5种常见除草剂进行同时分析和检测。
参考文献:
[1] 刘乾开,朱国念.新编农药手册[M].2版.上海:上海科学技术出版社,1999:401–403.
[2] Doganlar Z B.Quizalofop–p–ethyl–induced phytotoxicity and genotoxicity in Lemna minor and Lemna gibba[J]. Journal of Environmental Science and Health,2012,47(11):1631–1643.
[3] 俞少勇,陈日萍,陈彤,等.高效氟吡甲禾灵对大鼠睾丸生精细胞的损失作用[J].毒理学杂志,2006,20(6):390–392.
[4] 牟仁祥,陈铭学.稻米中13种苯氧羧酸类除草剂多残留的高效液相色谱–质谱测定[J].分析测试学报,2008,27(9):973–976.
[5] 张蓓蓓,张勇,赵永刚,等.水中苯氧羧酸类除草剂的液相色谱–串联质谱测定方法研究[J].分析测试学报,2013,32(1):89–93.
[6] 于彦彬,张嵘,李莉,等.固相萃取液相色谱串联质谱法测定土壤中9种苯氧羧酸类除草剂的残留量[J].分析化学,2014,42(9):1354–1358.
[7] 任颖俊,龚道新,郑琛,等.气相色谱法同时测定土壤中4种农药的残留量[J].湖南农业大学学报(自然科学版),2015,41(2):209–213.
[8] 丁春霞,龚道新,肖浩,等.高效液相色谱法同时测定植烟土壤和水中3种除草剂的残留量[J].中国烟草科学,2013,34(5):95–99.
[9] 程静,丁磊,蒋俊树,等.液相色谱串联质谱法测定谷物类农产品中苯氧羧酸类除草剂多残留[J].食品科学,2010,31(20):389–393.
[10] 刘长令.世界农药大全:除草剂卷[M].北京:化学工业出版社,2002.
[11] 刘一宾,张怿.世界农药新进展[M].北京:化学工业出版社,2007.
[12] 杨丽华,龚道新,罗俊凯,等.高效液相色谱法同时分析水稻和稻田中吡嘧磺隆和苯噻酰草胺的残留量[J].湖南农业大学学报(自然科学版),2013,39(3):291–297.
责任编辑:王赛群
英文编辑:王 库
Simultaneous determination of five herbicides residue in paddy soil samples by high performance liquid chromatography
Wu Lianga,Gong Daoxina, b*,Zhang Xiaodonga,Nie Hongyingb,Yang Lihuaa
(a.College of Resource and Environment; b.Institute of Agricultural Environmental Protection, Hunan Agricultural University, Changsha 410128, China)
Abstract:To simultaneously determine residues of five herbicides, namely MCPA,2,4,5–T, haloxyfop–p–methyl,quizafop–p–ethyl and fluazifop–p–butyl in paddy soil, water and coarse rice, a new method was developed using high performance liquid chromatography . The residues in soil was extracted with mixed solution of 0.05% ortho-phosphoric acid and aetonitrile (volume ratio of 1∶2), and those in water was extracted with ethyl acetate , while in coarse rice was dissolved by 0.04 mol/L sodium hydroxide aqueous, then purified by a florisil column. Five herbicides were detected at uv wavelength of 229 nm with acetonitrile-water (pH=3) as mobile phase through gradient elution in HPLC, external standard was adopted as the quantification method. The linearity was good (r>0.999 7) in concentration range of 0.05 to 5.00 mg/L .Mean recoveries of five herbicides in soil and coarse rice were between 78.8% and 107.8% (RSD≤7.5, n=5)at fortification levels of 0.05 to 1.00 mg/kg, while they were between 86.2% and 109.2%(RSD≤6.5, n=5)in water at levels from 0.01 to 0.50 mg/kg. Under these optimal condition, The limit of detection for the five ingredients were between 0.01 to 0.02 mg/kg, and the limit of quantification in soil, coarse rice and water were 0.05 mg/kg, 0.05 mg/kg,and 0.01 mg/L respectively. Pre-treatment process of the method was simple, and sensitivity and accuracy of the method meet the technical requirement for the analysis and detection of pesticide residues.
Keywords:high performance liquid chromatography; herbicides; paddy water; paddy soil; coarse rice; pesticide residue
中图分类号:S481.8
文献标志码:A
文章编号:1007−1032(2016)03−0322−06
收稿日期:2015–10–20 修回日期:2016–04–07
基金项目:农业部农药登记残留项目(2014H277)
作者简介:吴亮(1989—),男,湖南涟源人,硕士研究生,主要从事农药残留与环境行为研究,wuliang866808@163.com;*通信作者,龚道新,博士,教授,主要从事农药残留分析及其生态毒理与环境行为研究,gdx4910@163.com
