油菜菌核病菌致病性分化及弱毒现象
2016-07-18邓小军李桂芳庞茜丹朱宏建高必达
邓小军,李桂芳,魏 颖,庞茜丹,朱宏建*,高必达
(1.湖南农业大学植物保护学院,湖南 长沙 410128;2.植物病虫害生物学与防控湖南省重点实验室,湖南 长沙410128;3.南方粮油作物协同创新中心,湖南 长沙 410128)
油菜菌核病菌致病性分化及弱毒现象
邓小军1,2,3,李桂芳1,2,魏颖1,2,庞茜丹1,2,朱宏建1,2,3*,高必达1, 2
(1.湖南农业大学植物保护学院,湖南 长沙 410128;2.植物病虫害生物学与防控湖南省重点实验室,湖南 长沙410128;3.南方粮油作物协同创新中心,湖南 长沙 410128)
摘 要:对湖南省常德、益阳两地的196个油菜菌核病菌株进行分离纯化,采用离体叶片法测定它们的致病力,发现两地区油菜菌核病菌的致病力明显分化。运用纤维素吸附法提取19个弱致病力菌的dsRNA,其中3个菌株含有dsRNA,菌株CY019菌丝稀疏,菌核量少。进一步利用尖端脱毒获得不含dsRNA的菌株CY019VF,通过活体茎秆接种,发现其致病力得到恢复,表明CY019致病力下降可能与其所携带的dsRNA病毒有关。
关 键 词:油菜菌核病菌;致病力;弱毒株系
投稿网址:http://xb.ijournal.cn
核盘菌(Sclerotinia sclerotiorum)可寄生 400多种植物,引起植物菌核病[1]。油菜菌核病是油菜生产中的首要病害。由于核盘菌寄主范围广,抗逆性强,传播方式多、抗病资源匮乏[2],油菜菌核病的化学防治效果不理想。
对不同地区不同寄主的核盘菌进行的生物学特性研究表明,核盘菌存在明显的致病性分化[3]。刘万仁等[4]分离了60多个核盘菌菌株,对致病力进行测定,发现各菌株间存在致病力差异。聂峰杰等[5]在油菜上分离得到致病力减退的油菜菌核病菌,其中菌株SMX6–1–4和SCG1–1–1没有致病性,表明油菜菌核病菌中存在致病力的分化。Boland等[6]报道核盘菌菌株91致病力下降,与其含有的dsRNA有关。油菜菌核病菌中dsRNA、DNA、+ssRNA以及–ssRNA病毒均已被鉴定并证明与油菜菌核病菌致病力减退有关[7–8]。油菜菌核病菌中含有大量病毒资源,这为真菌病毒用于油菜菌核病生物防治提供了可能[9]。于晓等[10]发现,DNA病毒SsHADV–1粗提液能抑制油菜菌核病的发生,对油菜菌核病有一定的治愈作用,具有较好的生物防治潜力。
笔者分离纯化了湖南省常德、益阳两地的196个油菜菌核病菌株,通过离体叶片法接种,发现菌株致病力分化明显,19个菌株致病力减退,编号为CY019的菌株菌丝稀疏,菌核量少,存在dsRNA,脱毒后菌株CY019VF致病力得到恢复,表明CY019致病力下降可能与其所携带的 dsRNA病毒有关,现将结果报道如下。
1 材料与方法
1.1 材料
于湖南省常德、益阳地区采集油菜菌核病菌菌株196株(常德104株,益阳92株)。供试油菜为湖南省农业科学院作物研究所选育的湘杂油9号。
1.2 方法
1.2.1 病原菌分离纯化和致病力测定
采用组织分离法[11]分离油菜菌核病菌核,剪取5 mm×5 mm菌核,70%乙醇消毒30 s,无菌水清洗3遍,晾干,置于PDA平板中央,20 ℃培养,纯化菌株。
采用离体叶片接种法[12]测定油菜菌核病菌株的致病力。选取大小一致、生长健康的油菜叶片,用无菌水洗净叶面,自然晾干。在每块叶片叶脉的对称位置放置培养3 d的5 mm菌饼,以不含菌丝的PDA培养基作为对照,重复3次,20 ℃保湿培养。72 h后观察发病情况,采用十字交叉法测量病斑直径。
利用牙签菌丝体接种法[13]对弱毒菌株和弱毒脱毒菌株进行活体茎秆接种,以无菌牙签作为对照,重复3次,观察发病情况。
1.2.2 弱致病力菌株的鉴定及弱毒现象分析
运用简易提取方法提取弱致病力菌株基因组DNA,采用通用引物ITS–4和ITS–5(ITS4:5′−TCCT CCGCTTATTGATATGC−3′;ITS5:5′–GGAAGTAA AAGTCGTAACAAGG−3′) PCR扩增真菌rDNA–ITS序列,扩增产物经1%凝胶琼脂糖电泳检测,送铂尚生物技术有限公司测序。测得的序列于NCBI数据库中进行BLASTn比对,并通过MEGA6软件用邻接法构建系统进化树。系统进化树的每个分支的统计学显著性分析采用自展法(bootstrap)进行检验,重复效验1 000次。
运用纤维素吸附法[14]提取真菌的dsRNA病毒,dsRNA病毒粗提液经DNaseI和S1 Nuclease在37℃水浴处理40 min,消除混有DNA和单链RNA的污染。处理后的提取物进行 1.0%琼脂糖凝胶电泳40 min,凝胶成像系统观察,剩余提取物于–20 ℃短暂保存。
利用尖端脱毒法,挑取生长2 d的弱致病力菌株菌丝尖端于新的PDA培养皿中央,培养2 d后,再挑取尖端菌丝于新的 PDA培养基。反复挑取 5次后,通过dsRNA提取检测病毒消除情况。
2 结果与分析
2.1 油菜菌核病菌株致病力的分化
对分离纯化的196个油菜菌核病菌株进行致病性测定,常德最强致病力菌株的病斑直径达 68.8 mm,有9个菌株病斑直径大于60.0 mm(表1);益阳最强致病力菌株的病斑直径达64.3 mm,有7个菌株病斑直径大于60.0 mm(表2)。共有19个菌株表现出致病力减退(常德13个,益阳6个),表明菌株间存在致病力的分化。强致病菌株在离体油菜叶片上产生较大的病斑,接种2 d初现病斑,4 d发病明显,出现褐色水渍状圆形病斑,8 d时强致病力菌株菌丝聚集成团,形成菌核原基,弱致病力菌株接种离体油菜叶片几乎不发病(图1),分离自常德的弱毒菌株CY019菌丝稀疏,菌核量少。

表1 常德油菜菌核病菌株的致病力Table 1 Virulence of Sclerotinia sclerotiorum strains from Changde

表1 (续)

表2 益阳油菜菌核病菌株的致病力Table 2 Virulence of Sclerotinia sclerotiorum strains from Yiyang

图1 油菜菌核病菌株接种离体叶片的发病情况Fig.1 Detached leaves inoculated with Sclerotinia scleotiorum strain
2.2 弱致病力菌株dsRNA筛选结果
运用纤维素吸附法对 19个弱致病力菌株进行dsRNA提取,用DNAse I和S1 Nuclease处理去除提取液中的DNA和ssRNA后,1%凝胶电泳检测到菌株CY019、CY080和YY077中含有2.5 kb到10 kb的dsRNA条带(图2)。
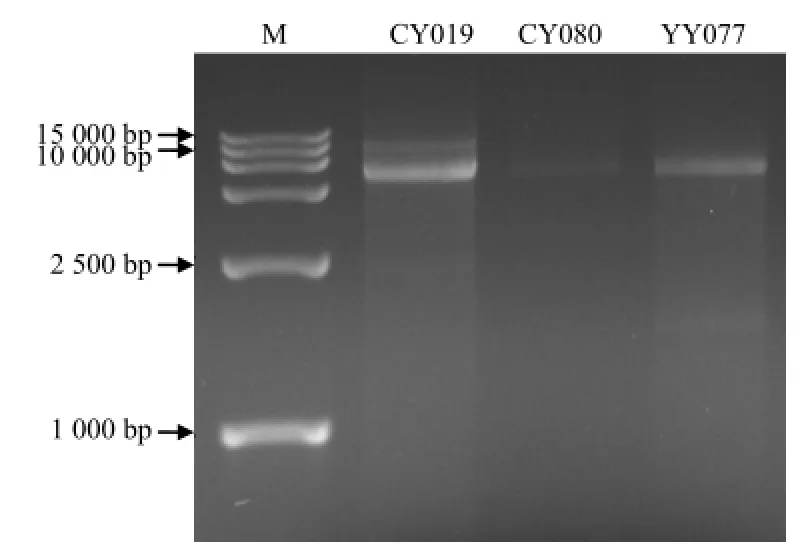
图2 致病力减退菌株dsRNA筛选电泳结果Fig.2 Electrophoresis of dsRNAs extracted from the attenuated strains
运用菌丝尖端脱毒法获得的 CY019的衍生菌株CY019VF,经dsRNA提取检测,不含dsRNA条带(图3)。将CY019和CY019VF通过扩增ITS序列进行比对和系统进化分析,确定 CY019和CY019VF为同一种真菌,即油菜菌核病菌(图4)。

图3 菌株CY019与CY019VF的dsRNA检测结果Fig.3 Electrophoresis of dsRNAs from strain CY019 and strain CY019VF
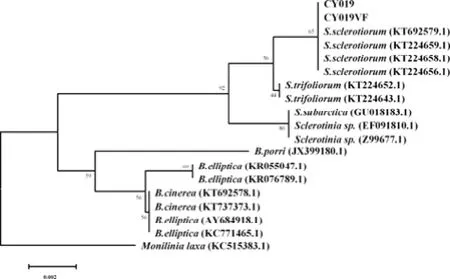
图4 菌株CY019 和 CY019VF的ITS序列进化Fig.4 The phylogenetic analysis of ITS sequence of strain CY019 and strain CY019VF
菌株CY019与CY019VF在PDA培养基上的生长形态如图5所示。两者菌落形态正常,CY019菌丝稀疏,CY019VF菌丝紧密,7 d后CY019VF菌株开始产生菌核,9 d后CY019菌株开始产生菌核,CY019产生菌核数量比CY019VF少。
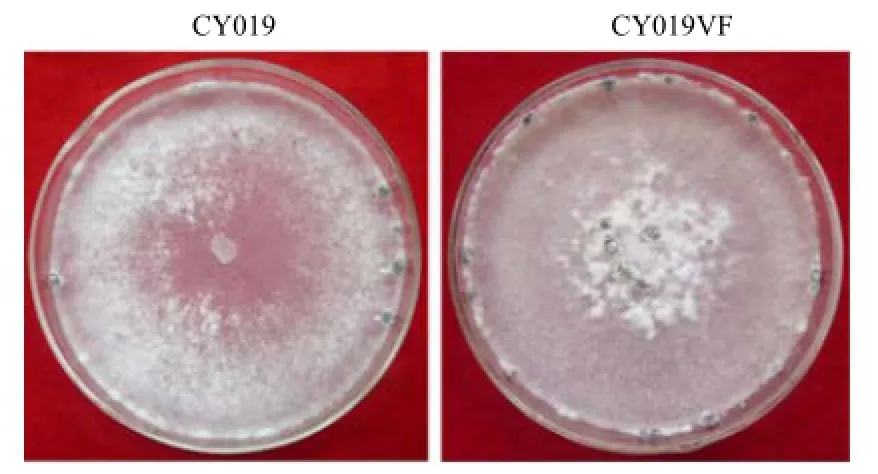
图5 CY019与CY019VF的菌落形态Fig.5 Colony morphology of strain CY019 and strain CY019VF
接种CY019VF菌株的油菜茎秆3 d后出现浅褐色水渍状梭形病斑,而CY019菌株接种及对照无明显症状。接种CY019VF菌株的油菜茎秆7 d时形成较大梭形病斑,病斑边缘水渍状暗褐色,中间凹陷,表生絮状菌丝,表皮裂开,而接种CY019的病斑扩展缓慢,直至12 d后才形成较小的、褐色且中间凹陷梭形病斑(图6),说明CY019为弱致病力菌株。消除dsRNA后,CY019VF菌株致病力得到恢复,由此推断CY019致病力下降与其所含dsRNA有关。

图6 油菜菌核病菌株接种油菜茎秆的发病情况Fig.6 The morbidity in rape inoculated with Sclerotinia scleotiorum strain stem
3 讨论
对常德、益阳地区196个油菜菌核病菌株进行分离纯化和致病力测定,发现菌株间致病力明显分化,但油菜菌核病致病力分化与地域无关。部分菌株表现出致病力减退的现象。有研究表明, 油菜菌核病菌Ep–lPN的致病力下降与RNA病毒的侵染有关[15]。本研究试图从dsRNA病毒入手,寻找引起油菜菌核病菌弱毒现象的原因,通过纤维素吸附法筛选菌株CY019、CY080、YY077含有dsRNA病毒,对菌株CY019进行病毒消除获得无dsRNA衍生菌株CY019VF,通过菌落形态、产菌核能力、活体油菜茎秆接种比较,发现菌株CY019致病力下降可能与其所携带的dsRNA病毒有关。
以往研究表明,植物病原真菌致病力的衰退与多种因素有关,包括DNA病毒、dsRNA因子、真菌质粒或线粒体DNA突变等[5],但某些菌株致病力减退的原因不排除是由某些含量很低且不能通过 dsRNA提取检测到的其他真菌病毒造成的,所以对于其他菌株致病力衰退的原因还有待进一步研究,这些菌株可能为研究油菜菌核病菌致病机理提供材料。
已报道油菜菌核病菌中 dsRNA病毒的种类多样[16],相同的dsRNA带型不一定是相同的病毒,同一菌株中不同的 dsRNA条带可能是不同的病毒混合侵染,而 ssRNA病毒在复制过程也能产生dsRNA中间体,可以通过提取dsRNA的方法提取出来,虽然笔者筛选的 dsRNA较单一,但目前还不能确定该菌株所含 dsRNA病毒的种类和属性,以及引起寄主低毒力的具体原因。对于该菌株内病毒的基因组序列的获得和研究具体病毒对寄主核盘菌的作用是下一步研究方向, 油菜菌核病菌弱毒现象机理也有待进一步研究。
参考文献:
[1] Bolton M D,Thomma B P H J,Nelson B D.Sclerotinia sclerotiorum (Lib.) de Bary:biology and molecular traits of a cosmopolitan pathogen[J].Molecular Plant Pathology, 2006,7(1):1–16.
[2] 吴力游,刘学端.油菜抗菌核病突变体筛选方法研究[J].湖南农业大学学报(自然科学版),1997,23(6):515–519.
[3] 李沛利,叶华智.核盘菌致病性分化研究[J].植物保护,2006,32(5):29–31.
[4] 刘万仁,王崇仁,吴友三.核盘菌生态型和致病性分化的研究[J].沈阳农业大学学报,1990,21(2):141–145.
[5] 聂峰杰,黄丽丽,康振生.核盘菌弱毒现象及其生防潜能的研究进展[J].中国油料作物学报,2013,35(3):334–340.
[6] Boland G J,Hall R.Index of plant hosts of Sclerotinia sclerotiorum[J].Canadian Journal of Plant Pathology, 1994,16(2):93–108.
[7] Yu X,Li B,Fu Y P,et al.A geminivirus-related DNA mycovirus that confers hypovirulence to a plant pathogenic fungus[J].Proc Natl Acad Sci USA,2010,107(18):8387–8392.
[8] Liu L J,Xie J T,Cheng J S,et al.Fungal negativestranded RNA virus that is related to bornaviruses and nyaviruses[J].Proc Natl Acad Sci USA,2014,111(33):12205–12210.
[9] Xie J T,Jiang D H.New insights into mycoviruses and exploration for the biological control of crop fungal diseases[J].Annual Review of Phytopathology,2014,52:45–68.
[10] Yu X,Li B,Fu Y P,et al.Extracellular transmission of a DNA mycovirus and its use as a natural fungicide[J]. Proc Natl Acad Sci USA,2013,110(4):1452–1457.
[11] 方中达.植病研究方法[M].北京:农业出版社,1979:115.
[12] 冉毅,文成敬,牛应泽.油菜菌核病抗性鉴定方法的比较及抗源的筛选[J].植物保护学报,2007,34(6):601–606.
[13] 刘勇,布朗·特伯德.油菜菌核病田间抗性鉴定和筛选I.火柴棍茎杆菌丝接种法[J].西南农业学报,1993(6):42–46.
[14] Morris T J,Dodds J A.Isolation and analysis of double-stranded RNA from virus-infected plant and fungal tissue[J].Phytopathology,1979,69(8):854–858.
[15] 李国庆,姜道宏,朱斌,等.同核盘菌菌株 Ep–1PN 弱毒性状相关的RNA及其属性[J].自然科学进展,1999, 9(A12):1245–1249.
[16] Jiang D,Fu Y,Li G,et al.Viruses of the plant pathogenic fungus Sclerotinia sclerotiorum[J].AdvVirus Res,2013, 86:215–248.
责任编辑:罗慧敏
英文编辑:罗 维
Pathogenicity differentiation and hypovirulence of Sclerotinia sclerotiorum
Deng Xiaojun1,2,3,Li Guifang1,2,Wei Ying1,2,Pang Xidan1,2,Zhu Hongjian1,2,3*,Gao Bida1,2
(1.College of Plant Protection, Hunan Agricultural University, Changsha 410128, China; 2.Hunan Provincial Key Laboratory for Biology and Control of Plant Diseases and Insect Pests, Changsha 410128, China; 3.Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China, Hunan Agricultural University, Changsha 410128, China)
Abstract:One hundred and ninty-six Sclerotinia sclerotiorumstrains from Changde and Yiyang of Hunan province were isolated and purified. Virulence of these strains was measured by inoculating detached leaves. The results showed pathogenicity differentiation of these S. sclerotiorum strains from the two areas was apparent. Using CF cellulose, dsRNA extraction were conducted on 19 hypovirulent strains, dsRNA screening showed that dsRNA were extracted from 3 strains (CY019, CY080 and YY077). CY019 has an abnormal phenotype with sparse hyphae and low production of sclerotia. A dsRNA-free strain CY019VF was obtained from CY019 using hypha tip isolation and showed the restored pathogenicity by in vivo inoculation in rape stem. These results indicate the attenuated virulence of strain CY019 could relate to its dsRNA.
Keywords:Sclerotinia sclerotiorum; pathogenicity; attenuated strains
中图分类号:S435.654
文献标志码:A
文章编号:1007−1032(2016)03−0317−05
收稿日期:2016–01–17 修回日期:2016–03–05
基金项目:公益性行业(农业)科研专项(201103016);中国博士后科学基金项目(2013M542114);国家科技支撑计划项目(2012BAD15B04–1)
作者简介:邓小军(1989—),男,湖南衡阳人,硕士研究生,主要从事真菌病毒研究,704474718@qq.com;*通信作者,朱宏建,博士,副教授,主要从事分子植物病理学研究,hongjian62@163.com
