拟南芥sscd1–1点突变对其表达的影响
2016-07-18韩成云支添添任春梅
黄 弈,韩成云,支添添,任春梅,2*
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.作物基因工程湖南省重点实验室,湖南 长沙 410128;3.宜春学院化学与生物工程学院,江西 宜春336000)
拟南芥sscd1–1点突变对其表达的影响
黄弈1,韩成云3,支添添1,任春梅1,2*
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.作物基因工程湖南省重点实验室,湖南 长沙 410128;3.宜春学院化学与生物工程学院,江西 宜春336000)
摘 要:为了探明拟南芥sscd1–1突变体中sscd1–1突变基因表达水平的降低是由剪切效率所致还是由自身启动子影响所致,分别构建了由外源35S启动子驱动的SSCD1正常基因和sscd1–1突变基因的表达载体及由内源自身启动子驱动的 SSCD1正常基因和 sscd1–1突变基因的表达载体,并将其转入到拟南芥 sscd1–1突变体中。采用RT–PCR分析sscd1–1突变基因的表达。结果显示:外源35S启动子驱动的sscd1–1突变基因的表达与正常基因相比没有明显差别,而内源自身启动子驱动的sscd1–1突变基因的表达显著降低,这表明sscd1–1的点突变没有影响其剪切效率;sscd1–1突变基因表达水平的降低是由内源自身启动子影响所致。
关 键 词:拟南芥;sscd1–1;启动子;基因表达
投稿网址:http://xb.ijournal.cn
在动物体内,酪氨酸降解途径是一条必不可少的代谢途径[1]。酪氨酸降解途径的最后一步是延胡索酰乙酰乙酸水解酶(FAH)将延胡索酸乙酰乙酸水解成乙酰乙酸和延胡索酸。FAH缺失会导致动物患先天性致死病症。目前,关于植物中酪氨酸降解途径的研究尚少。在笔者的前期研究中,通过 EMS诱变,在拟南芥中分离出了短日照条件下发生细胞死亡的sscd1–1突变体,并对SSCD1基因进行了图位克隆,发现该基因编码FAH[2–6]。sscd1–1突变体的单碱基突变位点发生在该基因第4个外显子的最后一个碱基,由G变成A。由于sscd1–1突变体的突变位点发生在剪接识别位点,所以,推测mRNA的剪切很可能会受其影响。在前期研究中,笔者通过RT–PCR分析和cDNA扩增测序,发现突变体的cDNA序列除1个碱基发生了突变外,其他都没有变化,说明突变体没有发生剪接位点的改变[6],但RT–PCR结果显示突变体mRNA的表达水平明显下降,所以,据此可推测sscd1–1突变体转录水平的下降可能是由剪切效率降低所致或者是由内源自身启动子调控所致。本研究中以拟南芥Col–0野生型和sscd1–1突变体为材料,分别构建了由外源35S启动子驱动的SSCD1正常基因和sscd1–1突变基因的表达载体,及由内源自身启动子驱动的 SSCD1正常基因和sscd1–1突变基因的表达载体,并将其转入到拟南芥中,检测SSCD1基因mRNA的表达。现将研究结果报道如下。
1 材料与方法
1.1 材料
拟南芥(Arabidopsis thaliana)野生型Col–0和突变体sscd1–1[6]以及载体pMyc2[7–8]和pFLAG[8]由作物基因工程湖南省重点实验室植物信号传导课题组保存。
1.2 植物的培养
将拟南芥种子用消毒液浸泡10 min,无菌水清洗3次,播种于含1%蔗糖的MS固体培养基上,避光4 ℃春化3 d后,转入人工气候箱生长,培养温度为(22±2) ℃。长日照光周期为16 h光照/8 h黑暗,短日照光周期为8 h光照/16 h黑暗。待拟南芥种子生长7 d后,移栽到盛有浸透营养液的人工土壤(东北黑土与蛭石的体积比为1∶1)中,盖透明塑料薄盖生长1~2 d后再置于光照培养室生长。
1.3 表达载体的构建
1.3.1 引物设计及 SSCD1全基因和含内源启动子SSCD1的克隆
根据TAIR网站上公布的拟南芥SSCD1基因序列,用软件 Primer Premier 5设计 2对引物pMS–F/pMS–R、pFS–F/pFS–R。以Col–0野生型和sscd1–1突变体基因组 DNA为模板,分别扩增SSCD1基因和含内源启动子的SSCD1基因。根据载体pMyc2和pFLAG带有的限制性酶切位点,在正、反引物的5′端分别加上SmaⅠ和SacⅠ位点,序列为pMS–F(5′–CCCGGGATGGCGTTGCTGAA GTCTTT–3′)、pMS–R(5′–GAGCTCACTTATTGTTA ATGGGTTGG–3′);pFS–F(5′–GAGCTCCCCTCCAC CACCATCGCCAG–3′)和 pFS–R(5′–CCCGGGAGG CGGTGAAGGAACAATTT–3′),序列下划线部分“CCCGGG”为SmaⅠ位点,“GAGCTC”为SacⅠ位点。引物pMS–F/pMS–R和pFS–F/pFS–R的退火温度分别为55 ℃和66 ℃。将扩增后的PCR产物经1.0%琼脂糖凝胶电泳检测后,切胶,回收,纯化。
1.3.2 载体连接和基因测序及农杆菌转化
用 SmaⅠ和 SacⅠ限制性内切酶分别对上述PCR产物和pMyc2及pFLAG载体进行双酶切,经1.0%琼脂糖凝胶电泳检测后分别回收目的片段和目的载体。用 T4连接酶将 SSCD1正常基因和sscd1–1突变基因分别连接至pMyc2载体的相应位点;将含内源启动子的SSCD1正常基因和sscd1–1突变基因分别连接至 pFLAG载体的相应位点,分别构建pMyc2–35S::SSCD1、pMyc2–35S::sscd1–1的表达载体和 pFLAG–en::SSCD1、pMyc2–en::sscd1–1的表达载体。采用热激法将重组载体转化至大肠杆菌 DH5α,取阳性克隆送华大基因公司测序。采用电击法将测序验证正确的重组载体转化到根癌农杆菌AGL–1中,挑取阳性克隆进行菌落PCR鉴定。
1.3.3 农杆菌介导的拟南芥遗传转化以及转化子筛选鉴定
挑取已转入重组载体的阳性农杆菌单菌落于含有卡那霉素(50 mg/L)、羧苄青霉素(100 mg/L)的YEB液体培养基中活化,采用浸化法[9]转化拟南芥sscd1–1突变体,并收获T0代种子。在含有卡那霉素(50 mg/L)的 MS培养基上筛选转 pMyc2–35S:: SSCD1表达载体和转pMyc2–35S::sscd1–1表达载体的转基因植株,在含有潮霉素(20 mg/L)的MS培养基上筛选转pFLAG–en::SSCD1表达载体和转pMyc2–en::sscd1–1表达载体的转基因植株。将筛选到的转基因植株T1代抗性苗移入土中,后代单株收种。挑选T2代抗性符合3∶1分离比的转基因株系,自交纯合后用于基因表达分析试验。
1.4 基因表达分析
分别取生长14 d的Col–0野生型、sscd1–1突变体以及转基因植株的莲座叶片,采用Trizol法提取总RNA。按照ReverTra Ace qPCR RT Kit的操作说明,以总RNA为模板,反转录合成第一链cDNA进行RT–PCR分析,重复试验2次。SSCD1基因的引物为5′–CCTCGTCCTGCCGTCGCTAT–3′和5′–CTTGTGGATGGCCCTGACCT–3′;内参 ACT2的引物为5′–TTCCGCTCTTTCTTTCCAAGCTCA–3′和5′–AAGAGGCATCAATTCGATCACTCA–3′。反应程序:94 ℃预变性2 min; 94 ℃变性30 s,50~55 ℃退火 30 s,72 ℃延伸45 s,共25个循环;72 ℃终延伸10 min。
2 结果与分析
2.1 sscd1–1突变体中SSCD1基因的表达
SSCD1基因表达水平的RT–PCR检测结果(图1)显示,野生型中SSCD1基因的表达量较高,而sscd1–1突变体中SSCD1基因的表达量与野生型相比明显降低,而且长、短日照条件下的表达情况没有明显差别。这表明SSCD1基因在sscd1–1突变体中mRNA的表达水平显著下降,且不受光周期的影响。
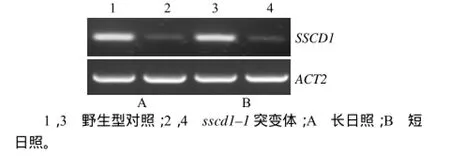
图1 SSCD1基因表达的RT–PCR检测结果Fig.1 SSCD1 gene expression detected by RT–PCR
2.2 sscd1–1点突变对其剪切的影响
从含有潮霉素的MS培养基中分别筛选出35S启动子驱动SSCD1正常基因和sscd1–1突变基因转入sscd1–1突变体的纯合株系各2个。转基因植株中SSCD1基因表达水平的RT–PCR检测结果(图2)显示,35S启动子驱动的SSCD1正常基因的表达水平与sscd1–1突变基因的表达水平相比没有明显差别,而且其在长、短日照条件下的表达水平基本相同。结合sscd1–1突变体没有发生剪接位点改变这一研究结果,可以推断sscd1–1剪接位点的突变没有影响其剪切效率。

图2 35S启动子驱动SSCD1基因表达的RT–PCR检测结果Fig.2 Gene expression from SSCD1 driven by 35S promoter in RT–PCR detection
2.3 sscd1–1突变体内源启动子对其表达的影响
从含有潮霉素的MS培养基中分别筛选出内源启动子驱动SSCD1正常基因和sscd1–1突变基因转入sscd1–1突变体的纯合株系各2个。转基因植株中SSCD1基因表达水平的RT–PCR检测结果(图3)显示,内源启动子驱动sscd1–1突变基因的表达水平相对于 SSCD1正常基因的显著降低,而且其在长、短日照条件下的表达水平基本相同。这表明sscd1–1突变基因表达水平的降低是由内源自身启动子的影响所致。

图3 内源启动子驱动SSCD1基因表达的RT–PCR检测结果Fig.3 SSCD1 gene expression driven by the endogenous promoter in RT–PCR detection
3 结论与讨论
本试验中分别构建了由外源35S启动子驱动的SSCD1正常基因和sscd1–1突变基因的表达载体,及由内源自身启动子驱动的 SSCD1正常基因和sscd1–1突变基因的表达载体,并将其转入到sscd1–1突变体中。转基因植株中SSCD1正常基因和sscd1–1突变基因表达水平的RT–PCR检测结果表明,sscd1–1的点突变没有影响其剪切效率,sscd–1–1突变基因表达水平的降低是由内源自身启动子的影响所致。
在本研究中,SSCD1基因突变位点发生在一个外显子右末端和内含子左末端的分界点,即发生在左剪接位点(Left splicing junction),由G突变成A。在内含子两端分别有2个非常保守的碱基,左剪接位点为GT,右剪接位点为AG。从理论上讲,内含子在剪接位点的这种特征称为 GT–AG规则(GT–AG role),剪接位点GT或AG的突变均可以阻止剪接出现[10]。因为sscd1–1突变体没有发生剪接位点改变[6],35S启动子驱动sscd1–1突变基因的表达水平相对于SSCD1正常基因的没有明显差别,所以,sscd1–1剪接位点突变没有影响该基因的剪切效率。这一现象的原因有待研究。内源自身启动子驱动的sscd1–1突变基因的表达相对于正常基因的显著降低,表明sscd1–1突变基因表达水平的降低是由内源自身启动子的影响所致。
真核基因表达调控在后基因组时代的研究中占有十分重要的地位,它将有助于进一步阐明重要的生命现象,解释细胞行为和疾病的发生机理[11]。本研究中拟南芥 sscd1–1点突变对其表达影响的研究可为植物中酪氨酸降解途径的研究提供参考。
参考文献:
[1] Lindblad B,Lindstedt S,Steen G.On the enzymic defects in hereditary tyrosinemia[J].Proc Natl Acad Sci USA,1977,74:4641–4645.
[2] Aponte J,Sega G,Hauser L,et al.Point mutations in the murine fumarylacetoacetate hydrolase gene:Animal models for the human genetic disorder hereditary tyrosinemia type 1[J].Proc Natl Acad Sci USA,2001,98:641–645.
[3] Dixon D,Edwards R.Enzymes of tyrosine catabolism in Arabidopsis thaliana[J].Plant Sci,2006,171:360–366.
[4] Grompe M,al-Dhalimy M,Finegold M,at el.Loss of fumarylacetoacetate hydrolase is responsible for the neonatal hepatic dysfunction phenotype of lethal albino mice[J].Genes Dev,1993(7):2298–2307.
[5] St-Louis M,Tanguay R.Mutations in the fumarylacetoacetate hydrolase gene causing hereditary tyrosinemia type I:Overview[J].Hum Mutat,1997,9:291–299.
[6] Han C Y,Ren C M,Zhi T T,et al.Disruption of fumarylacetoacetate hydrolase causes spontaneous cell death under short-day conditions in Arabidopsis[J].Plant Physiology,2013,162(4):1956–1964.
[7] Xu L,Liu F,Lechner E,at el.The SCF(COI1)ubiquitin-ligase complexes are required for jasmonate response in Arabidopsis[J].Plant Cell,2002,14:1919–1935.
[8] Ren C M,Pan J W,Peng W,et al.Point mutations in Arabidopsis cullin1 reveal its essential role in jasmonate response[J].Plant J,2005,42:514–524.
[9] Clough S,Bent A.Floral dip:A simplified method for Agrobacteriummediated transformation of Arabidopsis thaliana[J].Plant J,1998,16:735–743.
[10] 阎隆飞,张玉麟.分子生物学[M].北京:中国农业大学出版社,1997.
[11] 夏慧煜.剪接位点识别与选择性剪接机制的初步研究[D].北京:清华大学,2004.
责任编辑:王赛群
英文编辑:王 库
Effects of Arabidopsis point mutation sscd1–1 on its expression
Huang Yi1, Han Chengyun3, Zhi Tiantian1, Ren Chunmei1,2*
(1.College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410128, China; 2.Crop Gene Engineering Key Laboratory of Hunan Province, Changsha 410128, China; 3.College of Chemistry and Biology Engineering, Yichun University, Yichun, 336000, China)
Abstract:To investigate whether the reduction of the gene’s transcription level from mutated sscd1–1 in Arabidopsis is induced by splicing efficiency or its own promoter regulation, expression vectors of exogenous 35S promoter and endogenous promoter driven by normal SSCD1 gene and sscd1–1 mutated gene respectively were firstly constructed, then it was transformed into Arabidopsis sscd1–1 mutant, the expression of the sscd1–1 mutated gene was analyzed by RT–PCR. The results showed that its expression did not affected by 35S promoter driven by sscd1–1 mutated gene,however, the expression level of sscd1–1 mutated gene driven by its endogenous promoter was significantly decreased. Hence, the point mutation in sscd1–1 did not affect the splicing efficiency of the sscd1–1 gene, the reduction of sscd1–1 expression level was caused by its endogenous promoter.
Keywords:Arabidopsis; sscd1–1; promoter; gene expression
中图分类号:Q786
文献标志码:A
文章编号:1007−1032(2016)03−0247−04
收稿日期:2015–09–29 修回日期:2016–04–14
基金项目:国家自然科学基金项目(30671121);江西省科学技术厅青年科学基金计划项目(20151BAB214011)
作者简介:黄弈(1990—),男,湖南株洲人,硕士研究生,主要从事植物分子遗传学研究,435399406@qq.com;*通信作者,任春梅,博士,教授,主要从事植物分子遗传学研究,rencm66@163.com
