环孢素A对瘢痕疙瘩成纤维细胞增殖及凋亡的影响
2016-07-18戴海英徐建国王晓云
沈 頔, 邢 新, 杨 超, 戴海英, 徐建国, 王晓云
作者单位:200433 上海,第二军医大学附属长海医院 整形外科
论著-瘢痕研究专题
环孢素A对瘢痕疙瘩成纤维细胞增殖及凋亡的影响
沈 頔, 邢 新, 杨 超, 戴海英, 徐建国, 王晓云
作者单位:200433 上海,第二军医大学附属长海医院 整形外科
目的 研究环孢素A对瘢痕疙瘩成纤维细胞增殖及凋亡的影响。方法 用环孢素A作用于体外培养的瘢痕疙瘩成纤维细胞。Annexin V-FITC/PI 流式细胞术检测成纤维细胞凋亡率,DAPI 染色观察成纤维细胞的凋亡形态,CCK-8比色法检测环孢素A对成纤维细胞增殖的影响,并计算半数抑制浓度。结果 随着环孢素A浓度增高,成纤维细胞凋亡率不断增高,差异具有统计学意义(P<0.05)。通过数据分析获得的半数抑制浓度为(1.908±0.280) g/L。结论 环孢素A对瘢痕疙瘩成纤维细胞的增殖具有抑制作用,并有望在瘢痕疙瘩的防治中发挥重要作用。
瘢痕疙瘩; 环孢素A; 成纤维细胞; 细胞凋亡; 细胞增殖
瘢痕疙瘩是一种临床上常见的纤维组织增生性疾病,是皮肤对损伤的过度反应。其主要的病理变化是成纤维细胞的过度增生及胶原蛋白的过度增殖及沉积[1]。目前对于瘢痕疙瘩还没有一种完全彻底有效的治疗方法,但瘢痕疙瘩内药物注射始终是一种重要的治疗方式。使用的药物多为抑制胶原蛋白沉积及成纤维细胞增殖,如曲安奈德、5-氟尿嘧啶等。环孢素A因其强大的抑制胶原形成及抑制细胞增殖作用而被广泛用于器官移植的抗排异中[2]。自2015年2~10月,第二军医大学附属长海医院整形外科对环孢素A在体外对于瘢痕疙瘩成纤维细胞增殖的影响进行研究,以探讨其在临床治疗上应用的可行性。
1 对象与方法
1.1 细胞培养 取第二军医大学长海医院整形外科及上海交通大学医学院附属第九人民医院整形外科的7例手术瘢痕疙瘩标本(臀部、肩部各1例,耳垂2例,胸前3例),患者均无系统性疾病及激素、药物注射史。对用于实验的所取组织患者均知情同意。手术台上获取标本后,用手术刀将瘢痕切成适当大小的组织块。在超净台上,削取1 mm厚的瘢痕疙瘩组织片,采用组织块贴壁法培养。待细胞基本爬满瓶底后,以0.2%胰蛋白酶消化,按1∶2分瓶培养[3]。
1.2 实验分组 根据所要处理的环孢素A浓度不同分为3组,分别加入0.5、1.0、2.0 g/L浓度的环孢素A。每组设置一组阴性对照组和空白对照组。
1.3 Annexin V-FITC/PI流式细胞术检测成纤维细胞凋亡率 将3、4代细胞按1×105/ml,每孔3 ml接种到6孔板上,设对照孔。培养72 h后,弃上清液,用0.2%胰酶消化。每个标本收集约1×105个细胞。分别加入AnnexinV-FITC 2.5 μl和PI 2.5 μl后,进行流式细胞仪检测。
1.4 DAPI染色观察成纤维细胞的凋亡形态 将3、4代细胞按照1×105/ml,每孔3 ml,接种于预先铺好玻片的6孔细胞培养板中,设对照孔。培养72 h后,取出载玻片,按分组分别加入条件养液5 ml。培养24 h,依次加入1∶3的冰醋酸+甲醇固定液2 ml和1 μg/ml的DAPI染液2 ml,避光90 min染色。玻片翻转倒置在载玻片上,滴加柠檬酸缓冲液(pH 5.5)数滴,封固后荧光显微镜下观察。
1.5 CCK-8比色法检测环孢素A对成纤维细胞增殖的影响并计算半数抑制浓度 将3、4代细胞按照1×105/ml,每孔100 μl,接种到96孔板上,设置阴性对照组(不加药孔)和空白对照组(加入PBS)。孵育72 h后,每组分别加入条件养液24 h后,依次加入CCK-8液10 μl。用自动酶联检测仪测定波长450 nm(参考波长为650 nm)时的吸光度A值,计算抑制率。并使用SPSS 18.0软件分析其半抑制浓度(IC50值)。
2 结果
2.1 流式细胞仪检测凋亡率 0.5、1.0、2.0 g/L浓度的药物处理24 h后,经流式细胞仪定量显示,细胞凋亡率分别为(26.90±6.51)%、(74.80±9.56)%、(77.00±16.30)%,组间两两比较,差异有统计学意义(P<0.05);与对照组(2.86±2.18)%比较,差异均有统计学意义(P<0.05)。
2.2 DAPI荧光染色 对照组细胞内见细胞染色质均匀,未见明显凋亡细胞(图1);实验组见凋亡细胞的核染色质高度凝集,边缘化,细胞核裂解为碎块,产生凋亡小体(图2)。
2.3 CCK-8比色法检测环孢素A对成纤维细胞增殖的影响并计算半数抑制浓度 经0.5、1.0、2.0 g/L的环孢素A干预24 h后,各组间两两比较,差异有统计学意义(P<0.05,表1)。用SPSS 18.0软件进行分析,半数抑制浓度IC50为(1.908±0.280) g/L。
3 讨论
目前治疗瘢痕疙瘩的常见方法有手术切除[4]、药物注射等,其常用的注射药物有曲安奈德[5]、干扰素、5-氟尿嘧啶等。环孢素A是一种传统的免疫抑制药物。环孢素A进入细胞后,与胞浆中的一种受体亲环蛋白结合,形成复合物。该形成的复合物可作用于细胞内的磷脂化酶-钙调神经磷酸酶,从而抑制若干细胞因子,如 IL-2、IL-3、IL-4、GM-CSF的产生和释放,并抑制IL-2受体的表达[6]。转化生长因子β是一种对细胞外基质合成及伤口愈合具有促进作用的细胞因子。其被证明是导致纤维化的主要因素之一[7]。在瘢痕疙瘩中,转化生长因子β浓度异常升高。抑制转化生长因子β的生物活性可以抑制基质生成和凋节纤维化过程[8]。环孢素A可能通过抑制转化生长因子β而发挥一定的抗纤维化作用。有相关研究表明,同为免疫抑制剂的他克莫司,可以通过该途径抑制瘢痕疙瘩的增殖[9]。

图1 DAPI荧光染色对照组 图2 DAPI荧光染色实验组
表1 不同浓度环孢素A作用24 h对瘢痕疙瘩成纤维细胞增殖的影响

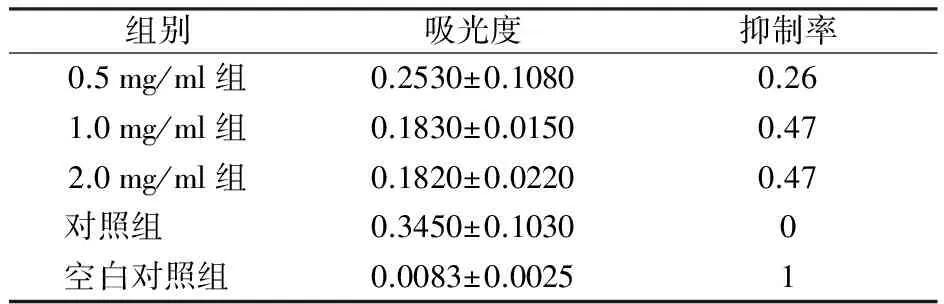
组别吸光度抑制率0.5mg/ml组0.2530±0.10800.261.0mg/ml组0.1830±0.01500.472.0mg/ml组0.1820±0.02200.47 对照组0.3450±0.10300 空白对照组0.0083±0.00251
细胞凋亡在维持机体内在平衡方面起非常重要的作用。学者推论在瘢痕的发生与创伤修复过程中,成纤维细胞正常凋亡的障碍使成纤维细胞增殖,分泌过多的胶原和细胞外基质,导致病理性瘢痕发生[10]。正常情况下,组成机体的细胞本身处在不断地更新中。这种更新是一种动态平衡。细胞增殖与细胞凋亡之间的平衡是机体稳态的基本条件,成纤维细胞过度增殖或凋亡减少就会导致病理性瘢痕的产生[11]。环孢素A可以通过促使过度增殖的瘢痕疙瘩成纤维细胞凋亡来发挥一定的抗纤维化作用。
笔者通过CCK-8比色法发现,环孢素A在体外对瘢痕疙瘩成纤维细胞有明显的抑制作用(P<0.01),且具有明显浓度依赖性。通过采用Annexin V-FITC/PI流式细胞术检测凋亡。随着药物浓度的增加,细胞凋亡率随之升高。通过DAPI荧光染色观察细胞凋亡形态,实验组可见典型的细胞凋亡形态;而对照组细胞内间细胞染色质均匀,未见明显凋亡细胞。
目前瘢痕疙瘩发生变化机制还不完全明确[12]。总结近年来多数学者的研究发现,我们猜测环孢素A治疗瘢痕的主要作用机制可能有:⑴抑制成纤维细胞增殖。⑵降低成纤维细胞胶原合成和分泌能力。⑶诱导成纤维细胞凋亡。⑷抑制瘢痕内局部血管增生。本研究采用较低浓度环孢素A干预体外培养瘢痕疙瘩成纤维细胞,可抑制细胞增殖和诱导细胞凋亡,并发现存在明显的浓度依赖性。为了减少药物可能的毒副作用,并且为了获得较好效果,我们推荐的半数抑制浓度为(1.908±0.280) g/L。
综上所述,体外环孢素A对以瘢痕疙瘩成纤维细胞的作用较为明显,但对于其在人体内治疗瘢痕疙瘩的效果仍有待于进一步地研究。
[1] Igota S, Tosa M, Murakami M, et al. Identification and characterization of wnt signaling path way in keloid pathogenesis[J]. 1nt J Med Sci, 2013,10(4):344-354.
[2] 吕春英. 环孢霉素A在青光眼滤过手术中抗瘢痕形成的临床应用[J]. 中华现代眼科学杂志, 2005,12(4):322-323.
[3] 薛 斌, 王 璞, 董浦江. 人瘢痕疙瘩成纤维细胞原代培养及生物学行为研究[J]. 激光杂志, 2007,28(2):95-97.
[4] 李威扬, 简 彩, 楚菲菲, 等. 手术切除联合即时放射疗法治疗瘢痕疙瘩疗效分析[J]. 中国美容整形外科杂志, 2013,24(3):157-159.
[5] 郝晓亮, 王少华. 曲安奈德注射和电子线照射及手术治疗兔耳瘢痕的研究[J]. 中华医学美学美容杂志, 2014,20(3):215-218.
[6] Garbaisz D, Turoczi Z, Aranyi P, et al. Attenuation of skeletal muscle and renal iniury to the lower limb following ischemia-reperfusion using mPTP inhibitor NIM-811[J]. PLoS One, 2014,9(6):e101067.
[7] Bran GM, Goessler UR, Hormann K, et al. Keloids:current concepts of pathogenesis[J]. Int J Mol Med, 2009,24(3):283-293.
[8] Chen J, Zeng B, Yao H, et al. The effect of TLR4/7 on the TGF-B-induced Smad signal transduction pathway in human keloid[J]. Burns, 2013,39(3):465-472.
[9] 刁建升, 马显杰. 瘢痕疙瘩发病机制和药物治疗研究新进展[J]. 中国美容整形外科杂志, 2013,24(3):187-189.
[10] 左宗宝, 李小静, 宁金龙, 等. 5-氟尿嘧啶对体外培养瘢痕疙瘩成纤维细胞的抑制及半数抑制浓度[J]. 中国组织工程研究与临床康复, 2008,12(7):1235-1238.
[11] Burd A, Huang L. Hypertrophic response and keloid diathesis: two very different forms of scar[J]. Plast Reconstr Surg, 2005,116(7):150e-157e.
[12] 杨宏凤, 高 鸽, 孙 然, 等. 瘢痕疙瘩发病机制及外科治疗进展[J]. 中华实验外科杂志, 2013,30(7):1543-1544.
Effects of Cyclosporin A on the proliferation and apoptosis of fibroblasts in keloids
SHENDi,XINGXin,YANGChao,DAIHai-ying,XUJian-guo,WANGXiao-yun.
(DepartmentofPlasticSurgery,ChanghaiHospitalAffiliatedtheSecondMilitaryMedicalUniversity,Shanghai200433,China)
XINGXin,Email:xingxin56@yahoo.com.cn
Objective To study the biological effect of Cyclosporin A on the proliferation and apoptosis of fibroblasts in keloids. Methods Cyclosporine A was used on cultured keloid fibroblasts, then we Annexin V-FITC/PI flow cytometry, DAPI staining and CCK-8 colorimetric were used to detect the rate of fibroblast apoptosis, the apoptotic fibroblasts form and the half inhibitory concentration, respectively. Results With the increased concentration of Cyclosporin A, the apoptosis rate of fibroblasts constantly increased with a statistically significant difference. Data analysis was obtained by the half inhibitory concentration (1.908±0.280) g/L. Conclusion Cyclosporin A inhibits the proliferation of fibroblasts in keloids and is expected to play an important role in the prevention of keloids.
Keloids; Cyclosporin A; Fibroblasts; Cell apoptosis; Cell proliferation
沈 頔(1983-),男,上海人,主治医师,博士研究生.
邢 新,200433,第二军医大学附属长海医院 整形外科,电子信箱:xingxin56@yahoo.com.cn
10.3969/j.issn.1673-7040.2016.11.002
R619.6
A
1673-7040(2016)11-0645-03
2016-08-13)
