缓释前列腺素E2对成骨细胞凋亡的影响
2016-07-18于国宁白雪涛白艳洁
于国宁,白雪涛,白艳洁
实验研究
缓释前列腺素E2对成骨细胞凋亡的影响
于国宁,白雪涛,白艳洁
目的 探讨缓释前列腺素E2(PGE2)对成骨细胞MC3T3-E1凋亡的影响。方法 使用以往实验制备的粒径均匀的缓释PGE2,以无添加物培养基、空白微球作为对照组,PGE2和缓释PGE2微球为实验组(浓度分别为0.0125, 0.0500, 0.2000, 0.8000, 3.2000, 12.8000 μmol/L),与成骨样细胞株MC3T3-E1孵育,分别于不同时间,流式细胞仪检测细胞凋亡情况。结果 PGE2、缓释PGE2对MC3T3-E1细胞的凋亡具有双向调节作用;0.0125 μmol/L PGE2、缓释PGE2对MC3T3-E1细胞的凋亡具有抑制作用(P<0.05);0.0500 μmol/L PGE2、缓释PGE2对MC3T3-E1细胞的凋亡无明显抑制作用;0.2000、0.8000、3.2000、12.8000 μmol/L PGE2、缓释PGE2对MC3T3-E1细胞的凋亡具有一定的促进作用(P<0.05);缓释PGE2对MC3T3-E1细胞凋亡的抑制/促进作用明显高于等浓度的PGE2,并具有时间和剂量依赖性。结论 PGE2-MSs具有明显的缓释特征,影响成骨细胞MC3T3-E1的凋亡,并呈时间和剂量依赖性。
前列腺素E2; 缓释微球; 成骨样细胞株; 凋亡; 小鼠
前列腺素E2(prostaglandin E2, PGE2)是具有高生物活性的脂类化合物,是一种复杂的多功能的骨代谢调节因子。其参与血管形成、骨修复和软骨代谢。PGE2 现已被公认为组织工程骨和软骨组织再生解决方案中重要的靶分子[1]。但由于PGE2是一种局部激素,其在局部合成、灭活,且半衰期极短(一般为1~2 min),因此,限制了它的应用。乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid, PLGA)是聚乳酸与羟基乙酸按照不同配比制备成的生物降解型高分子聚合缓释材料,是少数取得美国FDA批准的载体材料之一。基于此,在骨科、口腔科等领域的研究中,笔者构建PLGA-PGE2微球控释系统缓释PGE2,充分观察其在骨改建中的重要作用。自 2014年6月至2015 年12月,辽宁省人民医院以PLGA为药物载体,探讨缓释PGE2对成骨细胞凋亡的影响,以期为未来实验探索缓释药物载体在骨改建过程中的作用机制提供量化指标和理论依据。现报道如下。
1 材料与方法
1.1 实验细胞
小鼠颅顶前成骨细胞亚克隆 14 (MC3T3-E1 Subclonel4),购自中国科学院上海细胞库 (ATCC CRL-2594)。
1.2 主要试剂与仪器
MEM培养基、MTT、TritonX-100(美国SIGMA公司);小牛血清白蛋白(美国XIASI公司);胎牛血清(美国HYCLONE公司);OriCellTM小鼠成骨诱导培养液(美国CYAGEN BIOSCIENCES公司);二甲基亚砜(DMSO)、EDTA、Trito-X100(华美公司);PGE2(武汉三洹);缓释PGE2(沈阳药科大学自制);HeRA Cell CO2恒温培养箱 (德国KENDRO公司);Tecan Sunrise型酶标仪(奥地利TECAN公司);CK40型倒置显微镜( 日本OLYMPUS公司);eppendorf 5804 R型低温高速离心机(EPPENDORF中国有限公司);SW-CT-IF型超净工作台(上海博讯);BP 211D型电子天平(德国SARTORIUS公司);Series 1000型超低温冰箱(美国KELVINATOR公司);Tecan Sunrise全自动酶标仪(奥地利TECAN公司);RCT Basic恒温磁力搅拌器(德国IKA公司);FACSCalibur流式细胞仪(美国BD公司)。
1.3 实验方法
1.3.1 成骨细胞株MC3T3-E1的细胞培养 将小鼠MC3T3-E1细胞按3×105/瓶培养于100.0 ml 10%小牛血清DMEM培养液中,置于CO2孵箱(饱和湿度95%、5%CO2、37 ℃)孵育。根据细胞生长状况以及培养液pH值变化,1、2 d换液1次,待细胞培养至对数生长期时传代。
1.3.2 成骨样细胞株MC3T3-E1的传代培养 当MC3T3-E1细胞株生长形成单层,铺满培养瓶底80%时,在无菌条件下传代。用D-Hank′s液清洗铺满细胞的培养瓶后,加入0.25%胰蛋白酶+0.02%EDTA 0.5 ml,室温下观察3~5 min,见瓶底出现针孔样透明时,吸去胰酶,加入含10%小牛血清的DMEM培养液,吹打细胞制成细胞悬液,按1∶3传代,置于CO2孵箱,每2 d换液1次。1.3.3 成骨样细胞株MC3T3-E1的冻存和复苏 将铺满100 ml培养瓶的MC3T3-E1细胞用0.25%胰蛋白酶+0.02%EDTA消化收集后,加入1 ml冻存液(含40%DMEM,50%小牛血清,5%DMSO和5%甘油),吸入冻存管,分4阶段从4℃~-196℃缓慢放入液氮罐内长期保存(约1℃/min)。细胞复苏时采用快速复温法,将液氮中冻存的装有MC3T3-E1细胞的冻存管取出后立即置于37℃水浴中复温,融化后立即以DMEM培养液离心清洗3次(1500 r/min, 10 min),再接种于细胞培养瓶,并置于CO2孵箱内培养。
1.3.4 缓释PGE2对小鼠成骨样细胞株MC3T3-E1细胞凋亡的影响 ⑴将处于对数生长期的MC3T3-E1细胞用0.25%胰蛋白酶+0.02%EDTA消化收集后,加入10%FCS的MEM培养液制成2×105/ml细胞悬液加于12孔培养板,每孔1.0 ml,待细胞铺满孔底后,分别取用OriCellTM小鼠成骨诱导培养液稀释的不同浓度(0.0125、0.0500、0.2000、0.8000、3.2000、12.8000 μmol/L)PGE2和缓释PGE2加于24孔培养板中,2个对照组分别添加等量培养液、空白微球,将培养板置于37℃,5%CO2饱和湿度培养箱中培养。每2 d换液1/2。分别于第4、 6、 8、 10天取出,细胞凋亡的检测采用 Annexin V-PI 双染色法。⑵用不含 EDTA 的胰酶消化各实验组细胞,吹打制成单细胞悬液,加入 10 ml 离心管中。⑶加入预冷的无钙、镁离子的 PBS 缓冲液离心, 1000 r/min,5 min,洗涤细胞2次,弃上清。⑷加入孵育缓冲液进行离心,1000 r/min,5min。⑸加入100 μl 标记溶液重新悬浮细胞,避光条件下孵育15 min。⑹重复步骤⑶。⑺加入荧光溶液,4℃下避光孵育 20 min。⑻采用流式细胞仪进行细胞凋亡检测。
1.4 统计学处理
2 结果
PGE2和缓释PGE2作用MC3T3-E1细胞10 d后,流式细胞仪检测结果见图1。可见PGE2和缓释PGE2对MC3T3-E1细胞凋亡的作用是双向的;低浓度(0.0125 μmol/L)PGE2和缓释PGE2对MC3T3-E1细胞凋亡的抑制作用最强,凋亡发生率最低,与对照组相比差异具有统计学意义(P<0.05);而高浓度(3.2 μmol/L)PGE2和缓释PGE2则抑制MC3T3-E1细胞增殖,促进细胞凋亡,与对照组相比差异具有统计学意义(P<0.05);缓释PGE2对MC3T3-E1细胞凋亡的抑制作用明显大于等浓度的PGE2(P<0.05)。
图2是不同浓度PGE2和缓释PGE2分别作用MC3T3-E1细胞4、6、8、10 d后,细胞凋亡百分比的柱状图。由图中可见,0.0125 μmol/L PGE2和缓释PGE2对MC3T3-E1细胞凋亡的抑制作用最强,凋亡发生率最低(P<0.05);0.0500 μmol/L PGE2和缓释PGE2是促进或抑制成骨细胞凋亡的临界浓度;而0.2000、0.8000、3.2000、12.8000 μmol/L浓度则抑制MC3T3-E1细胞增殖,促进细胞凋亡的发生;随着作用时间的延长,缓释PGE2对MC3T3-E1细胞凋亡的促进大于相同浓度PGE2对MC3T3-E1细胞凋亡的促进作用。
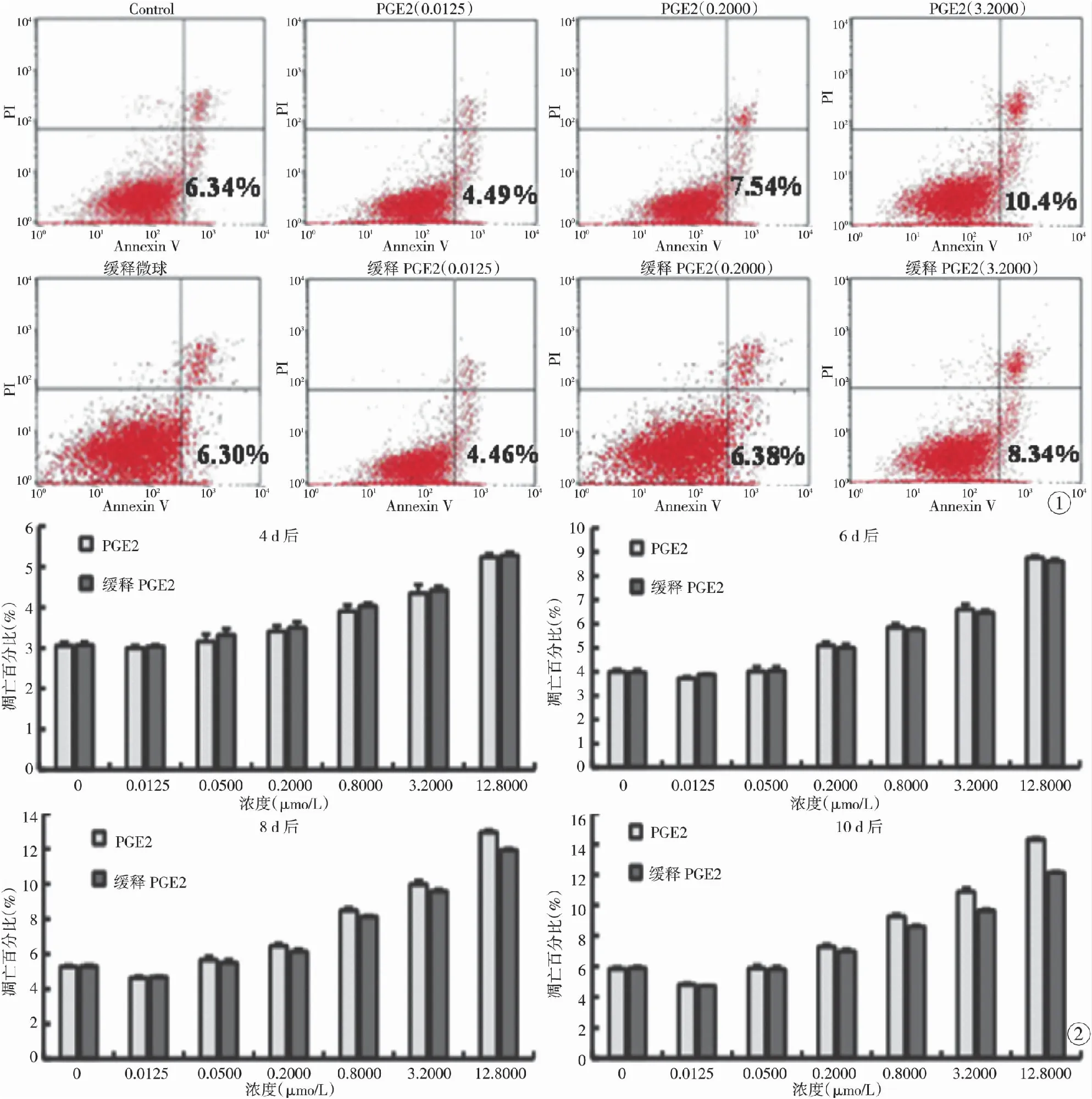
图1 双变量流式细胞仪散点图(左下象限代表活细胞,右上象限代表死细胞,右下象限则代表凋亡细胞) 图2 不同剂量PGE2、缓释PEG2微球对成骨细胞凋亡影响
Fig 1 Scatterplot of double variable flow cytometry (left lower quadrant represents the living cells, upper right quadrant shows the dead cells, the lower right quadrant represents the apoptotic cells). Fig 2 Effect of PGE2 and sustained release PEG2 on osteoblast apoptosis with different concentrations.
3 讨论
PLGA是少数取得美国FDA的批准的载体材料之一,并已逐步用于临床、组织工程支架[1-3]和药物载体[4-9]。因其毒性低、安全性高、稳定性好、生物相容性良好,常作为多肽、蛋白质及抗肿瘤类药物的载体。其通过自身降解,可在几周或几个月内以较稳定的速率释放药物,维持有效血液浓度,减少药物半衰期的给药次数,适用于半衰期短而又需要长期使用的药物。现已广泛用于组织工程支架和药物载体。因此本实验选PLGA为药物载体,与对照组比较,载体安全无细胞毒性反应。
MC3T3-E1成骨样细胞系来源于胎鼠颅骨,并且具有专一向成骨细胞分化的特性,因此,是研究成骨细胞分化调控机制的理想细胞系。成骨细胞MC3T3-El细胞株是日本学者Koala等从新生C57BL/6小鼠颅顶骨中分离培养所建立的一株成骨细胞株。该细胞株具备碱性磷酸酶活性、Ⅰ型胶原合成和基质矿化等体外培养成骨细胞的各种生物学特性,是一种良好的体外培养成骨细胞株[10],可作为一个良好的成骨细胞体外模型系统。本研究以MC3T3-E1成骨样细胞系分化为成骨细胞过程中生物性能的变化来考察药物载体的缓释效果,疗效肯定,在细胞凋亡过程中与对照组相比均有显性意义。
Paralkar等[11]研究显示,1×10-6mol/L PGE2处理人成骨样细胞24 h后,细胞中BMP-7的mRNA水平和蛋白水平都显著增加;权金星等[12]发现,PGE2对OCIL mRNA表达的调节存在明显的时间效应和剂量依赖关系, 0.1 μmol/L 的PGE2在处理细胞6 h后,对OCI LmRNA表达的上调幅度最大;王乐禹等[13]用10 μmol/L PGE2处理MC3T3-El成骨细胞2 h和4 h后,检测其对成骨细胞增殖活力和细胞周期的影响,证明了10 μmol/L PGE2可抑制成骨细胞的增殖; 2.84 μmol/L PGE2处理小鼠成牙骨质细胞OCCM-30 3 d和6 d时,能明显抑制细胞增殖,并提高ALP的活力[14];而300 nmol/L PGE2处理OCCM-30细胞3周后,可明显降低矿化结节生成的数量,而30~300 nmol/L PGE2处理OCCM-30细胞6 d时,就可明显抑制ALP的活力。
本实验通过预实验设定6个实验浓度,即0.0125、0.0500、0.2000、0.8000、3.2000、12.8000 μmol/LPGE2分别处理MC3T3-El成骨细胞后,结果显示PGE2对成骨细胞凋亡的作用是双相的。这与其他学者关于PGE2对骨形成具有双相调节作用,即在低浓度或有糖皮质激素存在的情况下,PGE2可促进成骨细胞的分化,从而促进骨形成;而在高浓度或有胰岛素样生长因子-1存在的情况下,PGE2可抑制胶原的合成,从而抑制骨形成[15]的观点,其本质上是一致的。
本实验观察了PGE2-MSs微球的缓释作用,在以往研究中,笔者已进行过相关微球的体外药物释放度测定的实验,结果证实低分子量的微球具有持续的药物缓释效果。本实验中,由于具体时间的缓释浓度累积及代谢量无法精确控制,故设计缓释微球的终释放量等于PGE2组的起始浓度。在本实设定的4个观察时间点(4、6、8、10 d)上,随着时间变化,缓释PGE2微球出现明显的缓释特征,其对凋亡的促进作用逐渐增强,与PGE2组比较,差异具有统计学意义(P<0.05),结合以往实验[16]的结果,进一步确定了PLGA-PGE2微球在成骨细胞实验中具有缓释作用。
[1] Liu C, Huang Y, Pang M, et al. Tissue-engineered regeneration of completely transected spinal cord using induced neural stem cells and gelatin-electrospun poly (lactide-co-glycolide)/polyethylene glycol scaffolds[J]. PLoS One, 2015,10(3):e0117709.
[2] Ju R, Wen Y, Gou R, et al. The experimental therapy on brain ischemia by improvement of local angiogenesis with tissue engineering in the mouse[J]. Cell Transplant, 2014,23 (Suppl 1):S83-S95.
[4] Kapoor DN, Bhatia A, Kaur R, et al. PLGA: a unique polymer for drug delivery[J]. Ther Deliv, 2015,6(1):41-58.
[5] Ige PP, Dipsingh SN. Preparation and in vitro-in vivo evaluation of surface-modified poly(lactide-co-glycolide) nanoparticles as controlled release carriers for flutamide delivery[J]. J Microencapsul, 2015,32(3):231-239.
[6] Wang K, Qi J, Weng T, et al. Enhancement of oral bioavailability of cyclosporine A: comparison of various nanoscale drug-delivery systems[J]. Int J Nanomedicine, 2014,28(9):4991-4999.
[7] Ebrahimi E, Khandaghi AA, Valipour F, et al. In vitro study and characterization of doxorubicin-loaded magnetic nanoparticles modified with biodegradable copolymers[J]. Artif Cells Nanomed Biotechnol, 2014,27:1-9.
[8] Ma G. Microencapsulation of protein drugs for drug delivery: strategy, preparation, and applications[J]. J Control Release, 2014,193:324.
[9] Cao Y, Wang B, Wang Y, et al. Dual drug release from core-shell nanoparticles with distinct release profiles[J]. J Pharm Sci, 2014,103(10):3205-3216.
[10] Wang L, Zhang X, Guo Y, et al. Involvement of BMPs/Smad signaling pathway in mechanical response in osteoblats[J]. Cell Physiol Biochem, 2010,26(6):1093-1102.
[11] Paralkar VM, Grasser WA, Mansolf AL, et al. Regulation of BMP-7 expression by retinoic acid and prostaglandin E(2)[J]. J Cell Physiol, 2002,190(2):207-217.
[12] 权金星, 王宝利, 郑 纺, 等. 前列腺素E2调节大鼠成骨细胞OCIL基因表达的信号通路研究[J]. 中华内分泌代谢杂志, 2011,27(8):683-686.
[13] 王乐禹, 胡晓芳, 欧阳钧, 等. 前列腺素E2对MC3T3-E1成骨细胞基因表达谱的影响[J]. 中华创伤杂志, 2011,27(8):746-751.
[14] Oka H, Miyauchi M, Sakamoto K, et al. Prostaglandin E2 inhibits mineralization and enhances matrix metalloproteinase-13 in mature cementoblasts mainly via the EP4 pathway[J]. Arch Oral Biol, 2008,53(3):243-249.
[15] Saegusa M, Murakami M, Nakatani Y, et al. Contribution of membrane-associated prostaglandin E2 synthase to bone resorption[J]. J Cell Physiol, 2003,197(1):348-356.
[16] 白艳洁, 徐 晖, 张 扬. 前列腺素E2缓释微球对成骨样细胞株MC3T3-E1生物学性能的影响[J]. 中国美容整形外科杂志, 2015,26(4):235-238.
Effects of sustained release prostaglandin E2 on apoptosis of osteoblasts
YUGuo-ning,BAIXue-tao,BAIYan-jie.
(DepartmentofOrthopedicSurgery,People′sHospitalofLiaoningProvince,Shenyang110016,China)
BAIYan-jie,Email:yanjiebai2008@sina.cn
Objective To explore the effect of sustained release prostaglandin E2 (PGE2) on apoptosis of MC3T3-E1 cells. Methods The prior preparation of uniform PGE2-MSs (sustained release microspheres) was used, additive-free culture medium and blank microspheres as the control group, while PGE2 and PGE2-MSs (concentrations were 0.0125, 0.0500, 0.2000, 0.8000, 3.2000, 12.8000 μmol/L, respectively) served as the experimental groups. All samples were incubated with ossification cell line MC3T3 and then cell apoptosis were detected by flow cytometry at different times. Results PGE2, sustained release of PGE2 had a regulatory action on the apoptosis of MC3T3-E1 cells. 0.0125 μmol/L PGE2, sustained release PGE2 had inhibitory action on the apoptosis of MC3T3 E1 cells (P<0.05); 0.0500 μmol/L PGE2, sustained release PGE2 had no obvious inhibitory action on the apoptosis of MC3T3 E1 cells , 0.2000, 0.8000, 3.2000, 12.8000 μmol/L PGE2, sustained release PGE2 had certain promotive action on the apoptosis of MC3T3 E1 cells (P<0.05) in a time-dependent manner. The effect of sustained release PGE2 was significantly higher than PGE2 at the same concentration. The effect was time and dose-dependent. Conclusion PGE2-MSs has obvious characteristics of sustained release which affect the apoptosis of osteoblast MC3T3-E1. The effect was time and dose-dependent.
Prostaglandin E2; Sustained release microspheres; Osteoblast-like cell; Apoptosis; Mice
辽宁省科学事业公益研究基金(2014001023)
110016 辽宁 沈阳, 辽宁省人民医院(骨外科:于国宁;口腔正畸科:白艳洁);中国医科大学附属第四医院 麻醉科(白雪涛)
于国宁(1977-),男,辽宁沈阳人,主治医师,博士.
白艳洁,110016,辽宁省人民医院 口腔正畸科,电子信箱:yanjiebai2008@sina.cn
10.3969/j.issn.1673-7040.2016.02.018
R318
A
1673-7040(2016)02-0121-05
2015-12-10)
