苯胺致小鼠肝细胞和淋巴细胞DNA损伤及其修复效应
2016-07-15边高鹏刘瑞祥史宝忠焦海华
边高鹏,刘瑞祥*,史宝忠,焦海华
(1.长治学院生物科学与技术系,山西长治 046011;2.太行山生态与环境研究所,山西长治 046011)
苯胺致小鼠肝细胞和淋巴细胞DNA损伤及其修复效应
边高鹏1,2,刘瑞祥1,2*,史宝忠1,2,焦海华1
(1.长治学院生物科学与技术系,山西长治 046011;2.太行山生态与环境研究所,山西长治 046011)
【摘要】目的 研究苯胺的遗传毒性及其修复动力学效应。方法 应用单细胞凝胶电泳(SCGE)技术,检测100 mg/kg苯胺单次灌胃3、8、16、24、32 h后,对KM小鼠肝细胞和淋巴细胞DNA损伤及时效关系。结果 SCGE实验结果显示肝细胞从8 h开始尾长和尾矩逐渐增大,至16 h DNA损伤程度达到最大,相比对照组差异有显著性(P<0.01),随着时间的延长,DNA损伤程度逐渐减轻,在32 h DNA损伤已恢复正常,与对照组相比差异无显著性(P>0.05);而淋巴细胞则在16 h开始尾长和尾矩逐渐增大,24 h时达到最大,32 h时DNA损伤逐渐恢复。结论苯胺对肝细胞和淋巴细胞具有潜在的遗传毒性;2个DNA损伤指标的变化存在明显的时间效应关系,说明这两种细胞具有有效DNA修复机制。
【关键词】苯胺;单细胞凝胶电泳;DNA修复
近年来随着聚氨酯、橡胶助剂等行业的迅速扩张,苯胺作为染料、医药、橡胶助剂、农药等精细化工的重要原料,其市场需求不断增加,目前我国年生产超过3000 kt[1]。随之而来的安全生产以及苯胺废水的处理,特别是近年来频发的苯胺泄露,使人类接触的可能性越来越高,尤其是从事苯胺职业生产的工人,引起人们对其生物安全性的关注。
苯胺由于具有较强的脂溶性,即使皮肤没有破损,也可通过皮肤接触侵入体内;另外由于其具有挥发性,还可经呼吸道进入人体[2]。苯胺进入人体血液系统后,首先氧化血红蛋白为高铁血红蛋白,失去携带氧能力,引起病人黏膜和皮肤出现紫绀等缺氧症状,然后促使血红蛋白的氨基酸变性,形成沉积于红细胞膜上赫恩滋小体,使膜脆性增大,细胞变形能力降低,易于破裂,发生溶血性贫血、中毒性肝病、急性肾功能衰竭等症状[3]。
在苯胺急性致突变系列试验中,姐妹染色单体交换试验显示苯胺可致中国仓鼠DON细胞发生姐妹染色单体交换[4];单细胞凝胶电泳试验表明可致SMMC-7721和肝脏原代细胞明显的DNA断裂[5,6],两种方法均呈现阳性结果;但Ames试验检测却呈阴性结果[7,8];微核实验虽显示骨髓和外周血细胞的微核率增加[9,10],但可能是假阳性或红细胞生成素增加的结果[11]。而在苯胺慢性毒性系列试验中,研究表明苯胺盐酸盐可诱导大鼠脾脏产生纤维瘤、肉瘤和血管肉瘤,但在小鼠未有发现[12,13];且长期从事苯胺生产的工人,神经系统疾病的发生率显著高于正常人,部分患者出现心肌酶明显增高,但未发现任何器官的癌变[14]。由上可知,苯胺急性、慢性毒性试验结果在不同试验方法和不同物种均存在差异,缺乏足够的证据表明苯胺具有致突变性,而且关于苯胺所致DNA损伤的修复研究也非常缺乏。因此,本研究采用100 mg/kg苯胺对KM小鼠进行体内染毒,应用较为敏感的DNA损伤和修复检测方法单细胞凝胶电泳(SCGE)技术,对小鼠外周血淋巴细胞和肝脏细胞进行DNA损伤及其时效关系测定,旨在评价苯胺对这两种细胞DNA损伤及其自身的DNA修复能力,为进一步研究苯胺的遗传毒性的靶器官以及修复动力学效应提供基础数据。
1 材料与方法
1.1 实验动物
5周龄SPF级KM小鼠,30只,雌雄各半,体重30~32 g,来源于山西省长治市康宝工业园实验动物培育基地【SCXK(晋)2010-0001】。
1.2 主要试剂和仪器
苯胺(分析纯)(天津市凯通化学试剂有限公司)、正常熔点琼脂糖(NMA)(西班牙原装)、低熔点琼脂糖(LMA)(美国Amresco公司)、十二烷基肌氨酸钠(华美生物工程公司),曲拉通-100(美国Sigma公司)、Gelred(北京华越洋生物科技有限公司)、电泳仪(北京六一仪器厂,DYY-6C型)、荧光显微镜(德国蔡司公司,ImageA2型)、倒置显微镜(重庆仪器有限公司)、数显控温电热套(北京中兴伟业仪器有限公司,SXKW-1000型)、磁力加热搅拌器(上海南汇电讯器材厂,79-2型)、电热干燥箱(江苏省东台县电器厂,202-2型)。
1.3 动物与分组
KM小鼠观察1周适应环境后,随机分为6组,每组5只,饲养于山西省长治市康宝工业园实验动物培育基地屏障环境【SYXK(晋)2010-0004】,自由采食、饮水。参照文献[15]设置1/2 LD50苯胺染毒剂量为100 mg/kg,除阴性对照组外,其余小鼠经口单次灌胃100 mg/kg苯胺溶液后,分别于3、8、16、24、32 h共5个时间段,通过尾部采血取样,然后断颈处死并解剖小鼠,制备肝脏细胞悬液。
1.4 细胞悬液制备
1.4.1 淋巴细胞悬液制备
分别在各个时间段取各组小鼠20 μL尾血,按照1∶5的比例加入100 μL的红细胞裂解液(3.735 g氯化铵、1.3 g三羟甲基氨基甲烷500 mL)混匀,裂解5 min,用1500 r/min离心10 min,弃上清,收集淋巴细胞。如发现红细胞裂解不完全,可重复上述步骤。将离心后的淋巴细胞中加适量PBS,调节细胞密度,以平均每个视野10~12个细胞为佳。
1.4.2 肝脏细胞悬液制备
单次染毒结束后分别在各个时间点将各组小鼠麻醉后颈椎脱臼处死,解剖后取出肝脏于PBS液中清洗干净后,眼科剪剪成糜状,擦镜纸过滤,加入5倍体积的红细胞裂解液去除多余的红细胞,1500 r/min离心10 min弃上清,加适量PBS混匀调整细胞密度。
1.5 DNA损伤的测定
参照刘茂林等[16]实验方法,并加以改进。取25 μL细胞悬液和75 μL低熔点琼脂糖混合均匀,立即取10 μL混合液滴于铺好底胶的载玻片上一侧,抹平后置于4℃冰箱待胶凝固后,在载玻片的一侧滴加85 μL左右提前煮沸的低熔点琼脂糖,涂第3层胶,重新放回4℃冰箱凝固。取30 mL的裂解液,将载玻片平放在裂解槽里,4℃条件下裂解2 h。裂解结束后蒸馏水水洗3次,每次5 min。将水洗干净载玻片放在电泳槽,4℃平衡后解旋30 min,开始电泳。在电压23 V、电流300 mA、4℃条件下,电泳40 min。电泳结束后蒸馏水清洗3次,滴加10 μL 的1∶10 Gelred荧光染液,染色1.5 min后在荧光显微镜(40倍)下观察并用CCD记录。将所得的照片转换为tiff格式,用CASP软件分析2种不同类型DNA损伤指标:尾长(TL)为尾部最末端与头部中心的距离;尾矩(TM)为尾部DNA占总DNA百分比与尾长的乘积表示。
1.6 统计学分析
实验所得数据均采用平均值 ±标准误表示,利用SPSS 17.0软件对染毒各时间段小鼠SCGE数据处理和分析,用ANOVA方差分析检验各时间段组别与阴性对照组尾长和尾矩的比较(显著性水平设为0.05)。
2 结果
2.1 苯胺对小鼠肝细胞DNA损伤
SCGE试验时,细胞核在经过裂解液除去绝大部分的蛋白质及其他成分后,剩余的DNA在电泳时,如果是正常的肝细胞,由于未受到DNA损伤,并未产生明显的DNA断片,那么DNA留在细胞核原位,SCGE图像接近圆形;而如果是经过苯胺染毒的肝细胞,可能由于受到DNA损伤而产生了DNA断片,那么DNA断片在电场作用下就会移出细胞核区域,SCGE图像出现拖尾。DNA片段越小、越多,拖尾也就越长,证明DNA损伤越明显。以100 mg/kg苯胺对小鼠经口单次灌胃后,如图1和表1所示,在3 h时,肝细胞SCGE图像并未出现明显拖尾,且尾长和尾矩与阴性对照组相比差异无显著性(P>0.05),表明此时肝细胞并未出现明显DNA损伤;从8 h开始肝细胞SCGE图像出现明显拖尾,尾长和尾矩也逐渐增大,至16 h达到最大,与阴性对照组相比差异有显著性(P<0.01),表明肝细胞从8 h出现明显DNA损伤,在16 h维持在较高水平;从24 h开始,随着时间的延长,发现肝细胞拖尾逐渐缩短,尾长和尾距出现下降趋势,在32 h时拖尾几乎消失,尾长和尾距与阴性对照组相比差异无显著性(P >0.05),表明肝细胞的DNA损伤从24 h时开始有明显的修复,32 h时近乎修复至正常水平。
表1 不同取样时间小鼠肝细胞尾长和尾距Tab.1 The tail length and tail moment of the hepatocytes at different sampling times(±s)
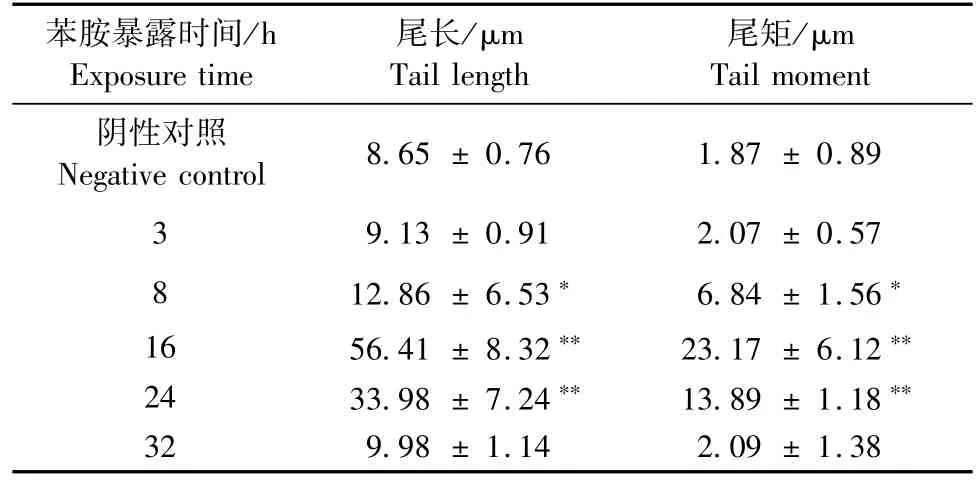
表1 不同取样时间小鼠肝细胞尾长和尾距Tab.1 The tail length and tail moment of the hepatocytes at different sampling times(±s)
注:*表示与阴性对照组差异有显著性(P<0.05),**表示与阴性对照组差异极显著(P<0.01)。Note.*indicates significant difference from the negative control group (P<0.05);**indicate extremely significant difference from the negative control group(P<0.01).
苯胺暴露时间/h Exposure time尾矩/μm Tail moment阴性对照Negative control 8.65±0.76 1.87±0.89 3 9.13±0.91 2.07±0.57 8 12.86±6.53* 6.84±1.56*16 56.41±8.32** 23.17±6.12**24 33.98±7.24** 13.89±1.18**32 9.98±1.14 2.09±1.38尾长/μm Tail length
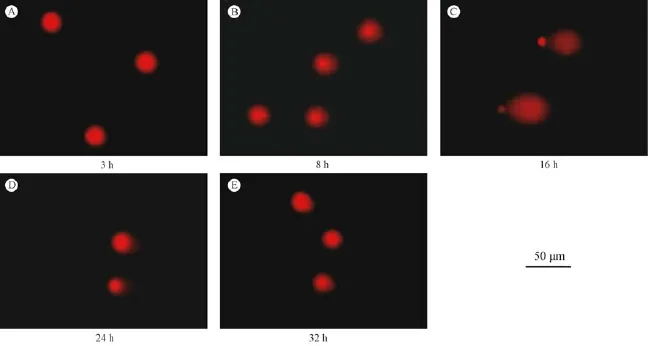
图1 不同取样时间小鼠肝细胞SCGE图像Fig.1 SCGE image of the hepatocytes at different sampling times
2.2 苯胺对小鼠淋巴细胞的DNA损伤
不同取样时间苯胺导致小鼠淋巴细胞SCGE试验结果(见图2),采用CASP图像分析软件将试验结果分别转化为距离和复合指标TL以及TM(见表2)。100 mg/kg苯胺单次染毒后,在3、8 h时,小鼠淋巴细胞并未出现明显拖尾,尾长和尾矩与阴性对照组相比差异无显著性(P>0.05);从16 h开始淋巴细胞出现明显拖尾,尾长和尾矩也增大,至24 h达到最大,与阴性对照组相比差异有显著性(P<0.01),表明外周血淋巴细胞的DNA损伤相比肝细胞出现较晚。随后,在32 h时发现肝细胞拖尾逐渐缩短,尾长和尾距也出现下降,但与阴性对照组相比差异仍显著(P<0.05),提示在苯胺染毒32 h时,已经出现修复,但未完全恢复至正常水平。
表2 不同取样时间小鼠淋巴细胞尾长和尾距(±s)Tab.2 The tail length and tail moment of the peripheral blood lymphocytes at different sampling times(±s)
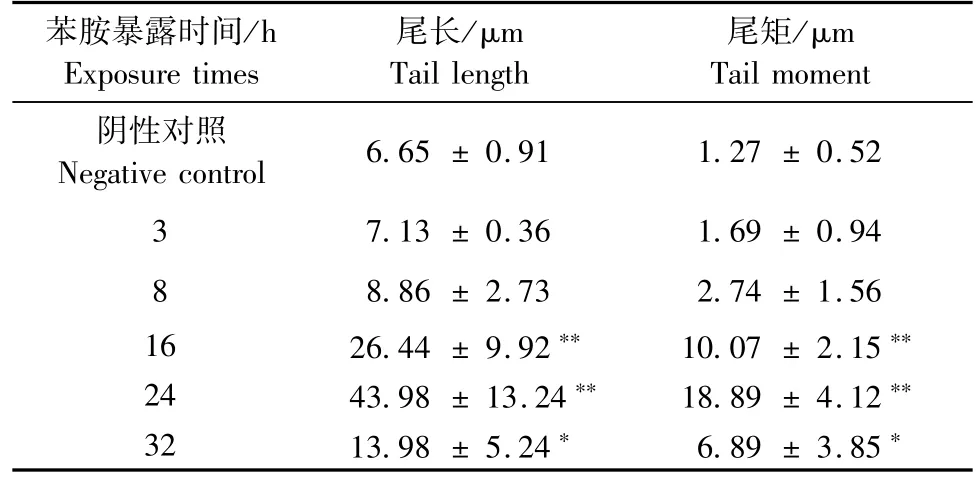
表2 不同取样时间小鼠淋巴细胞尾长和尾距(±s)Tab.2 The tail length and tail moment of the peripheral blood lymphocytes at different sampling times(±s)
注:*表示与阴性对照组差异有显著性(P<0.05),**表示与阴性对照组差异极显著(P<0.01)。Note.*indicates significant differences from the negative control group (P<0.05);**indicate extremely significant difference from the negative control group(P<0.01).
苯胺暴露时间/h Exposure times尾矩/μm Tail moment阴性对照Negative control 6.65±0.91 1.27±0.52 3 7.13±0.36 1.69±0.94 8 8.86±2.73 2.74±1.56 16 26.44±9.92** 10.07±2.15**24 43.98±13.24** 18.89±4.12**32 13.98±5.24* 6.89±3.85*尾长/μm Tail length

图2 不同取样时间小鼠淋巴细胞SCGE图像Fig.2 SCGE image of the lymphocytes at different sampling times
3 讨论
外界的异源物质经动物消化道吸收后,首先进入血液循环与淋巴细胞接触,然后转运至肝脏,在肝细胞丰富代谢酶的作用下进行生化反应以解毒,因此肝细胞是许多化学物质攻击的靶器官[17]。而淋巴细胞不仅可以活体取材、而且可以连续取样,常作为反映其他组织细胞DNA损伤的标志细胞[18]。因此肝细胞、淋巴细胞等是SCGE试验研究的常用细胞[19-22]。本研究以100 mg/kg的苯胺经口灌胃染毒后,结果发现苯胺分别在8、16 h开始诱发了肝细胞和外周血淋巴细胞的DNA断裂,说明苯胺单次染毒就能造成DNA单、双链的断裂损伤。这一点与另外一种DNA断裂的检测方法碱洗脱的实验结果相近,Parodi等[23]设置53、105、210、420、840 mg/kg浓度苯胺,通过单次注射方式对SD大鼠染毒4 h后,肝脏细胞也出现DNA断裂,但出现的时间要比本研究要早,推测可能是染毒方法的不同,腹腔注射染毒方式直接进入血液,引起DNA损伤要比消化道迅速。从2种细胞DNA损伤程度比较,肝细胞尾长的最大值比淋巴细胞的最大值高22.2%,肝细胞尾矩的最大值比淋巴细胞的最大值高18.4%,提示肝细胞比外周血淋巴细胞对苯胺或其代谢产物更加敏感,衡正昌等[18]以300 mg/kg的二氯乙烷对雄性KM小鼠经口灌胃染毒后,通过SCGE试验也观察到相似的现象,淋巴细胞的尾长在3、8、24 h均小于肝细胞。
SCGE试验已经成功地应用于DNA的损伤和修复的研究中[24,25]。本研究通过 SCGE试验发现肝细胞在16 h时维持在较高DNA损伤水平,而外周血淋巴细胞的DNA损伤作用出现较晚,在24 h时才达到高峰。苯胺经口灌胃染毒后,首先进入小鼠消化道,迅速随血液循环运送至肝脏。如果依据接触的时间效应推测,应是外周血淋巴细胞先于肝细胞出现DNA损伤,这与本实验结果并不相符。因此推测首先经消化道进入外周血的苯胺,并不能引起淋巴细胞明显的DNA损伤。但苯胺被肝脏细胞色素P450单加氧化酶活化为苯基羟胺[26],Wilmer等[27]的研究表明,50、100 μmol/L苯基羟胺就可致人类成纤维细胞SCE频率相比对照组上升40%,预示其具有明显DNA损伤效应。苯基羟胺首先攻击肝细胞导致DNA断裂,然后随肝脏血液循环再次进入外周血中,引起淋巴细胞的DNA损伤。
修复快且完全的细胞其致癌可能较小,而修复慢且损伤持续时间长的细胞其致癌可能较大。从肝细胞和淋巴细胞DNA断裂损伤恢复时间分析,肝细胞在24 h已有明显修复,32 h修复完全;而外周血淋巴细胞在在32 h始见修复作用,当然和其DNA损伤出现较晚有密切关系,但也有可能肝脏的血液循环非常迅速,大量的苯基羟胺转运至血液,导致淋巴细胞的DNA损伤无法及时修复。但这两种细胞对于苯胺所致DNA修复的差异,是否为细胞不同所致修复功能不同,还是损伤程度不同所致修复差异,还需进一步通过细胞培养实验来证实。
关于苯胺所致 DNA损伤修复的机制,Khan等[28,29]的研究表明,以0.5 mmol/kg苯胺通过饮水的方式染毒雄性SD大鼠30 d后,发现大鼠脾脏8-羟脱氧鸟苷DNA糖基化酶(NEIL1)和核酸内切酶(APE1)活性相比对照组都显著增加。提示苯胺诱导大鼠脾脏的DNA氧化损伤可以依赖碱基切除修复(BER)途径修复,首先由NEIL1启动识别受损核酸位点的糖苷水解酶,切断碱基N-糖苷键并去除,形成脱嘌呤部位,再由APE1切去含有AP位点的脱氧核糖-5-磷酸,继而在DNA聚合酶作用下重新放置一个正确的核苷酸,最后通过DNA连接酶将切口封闭,修复完成。由此推测小鼠肝细胞和淋巴细胞在苯胺单次染毒24 h和32 h后也发生相似的修复机制。
参考文献
[1] 李玉芳.苯胺的生产应用及市场分析[J].化学推进剂与高分子材料,2002,1(4):7-13.
[2] 姜红.苯胺中毒急救护理[J].工企医刊,2012,25(2):84 -85.
[3] 万继英.苯胺急性中毒血液中变性珠蛋白小体的检测及防治措施[J].医学信息,2010,23(6):15.
[4] Abe S,Sasaki M.Chromosome aberrations and sister chromatid exchanges in Chinese hamster cells exposed to various chemicals [J].J Natl Cancer Inst,1977,58(6):1635-1641.
[5] 贾莉,王彦军,董淑英,等.硝基苯和苯胺对大鼠原代肝细胞氧化损伤的作用[J].癌变·畸变·突变,2012,24(4):283-285.
[6] 贾莉,王伟,董淑英,等.苯胺和硝基苯对肝癌细胞SMMC-7721联合毒性作用研究[J].现代预防医学,2009,36 (23):4508-4511.
[7] Haworth S,Lawlor T,Mortelmans K,et al.Salmonella mutagenicity test results for 250 chemicals[J].Environ Mutagen,1983,5(1):3-142.
[8] Dunkel VC,Zeiger E,Brusick D,et al.Reproducibility of microbial mutagenicity assays:II.testing of carcinogens and noncarcinogens in salmonella typhimurium and Escherichia coli[J]. Environ Mutagen,1985,7(5):1-248.
[9] Witt KL,Knapton A,Wehr CM,et al.Micronucleated erythrocyte frequency in peripheral blood of B6C3F1 mice from shortterm,prechronic and chronic studies of the NTP carcinogenesis bioassay program[J].Environ Mol Mutagen,2000,36(3):163-194.
[10] George E,Andrews M,Westmoreland C.Effects of azobenzene and aniline in the rodent bone marrow micronucleus test[J]. Carcinogenesis,1990,11(9):1551-1555.
[11] Jones E,Fox V.Lack of clastogenic activity for aniline hydrochloride in the mouse bone marrow[J].Mutagenesis,2003,18 (3):283-285.
[12] Bomhard EM.High-dose clastogenic activity of aniline in the rat bone marrow and its relationship to the carcinogenicity in the spleen of rats[J].Arch Toxicol,2003,77(5):291-297.
[13] Weinberger MA,Albert RH,Montgomery SB.Splenotoxicity associated with splenic sarcomas in rats fed high doses of D&C Red No.9 or aniline hydrochloride[J].J Natl Cancer Inst,1985,75(4):681-687
[14] 黄立芳.苯胺中毒患者5例的急救护理[J].职业与健康,2002,18(8):153-153.
[15] Sasaki YF,Fujikawa K,Ishida K,et al.The alkaline single cell gel electrophoresis assay with mouse multiple organs:results with 30 aromatic amines evaluated by the IARC and U.S.NTP [J].Mutat Res,1999,440(1):1-18.
[16] 刘茂林,宋国华,高继萍,等.氟对大鼠肝组织细胞凋亡与DNA损伤的影响[J].中国实验动物学报,2013,21(3):85 -88.
[17] 谢颖,钟才高.对化学毒物诱导肝细胞线粒体损伤的保护作用机制研究进展[J].中国药理学与毒理学杂志,2012,26(5):684-687
[18] 衡正昌,李爱武,张遵真.二氯乙烷对小鼠DNA损伤的器官特异性及时效关系研究[J].卫生研究,2001,30(4):193-195.
[19] 钱宁,李达圣,甘世祥.5-氮胞苷对贵州小型猪淋巴细胞DNA损伤及修复的影响[J].中国实验动物学报,2002,10 (4):223-226.
[20] 王海霞,李永明,陈文华,等.番茄红素对小鼠脂类及细胞DNA氧化损伤的影响[J].中国实验动物学报,2008,16 (5):342-345.
[21] Wang Y,Xu C,Du LQ,et al.Evaluation of the comet assay for assessing the dose-response relationship of DNA damage induced by ionizing radiation[J].Int J Mol Sci,2013,14(11):22449-22461.
[22] Mohamed T,Aya T,Yoshinao Z,et al.Hepatocyte apoptosis in dairy cattle during the transition period[J].Can J Vet Res,2012,76(4):241-247
[23] Parodi A,Pala M,Russon P,et al.DNA damage in liver,kidney,bone marrow,and spleen of rats as determined by alkaline elution assay and sister chromatid exchange induction[J]. Cancer Res,1982,42(6):2277-2283.
[24] Collins AR.The comet assay for DNA damage and repair:principles,applications,and limitations[J].Mol Biotechnol,2004,26(3):249-261
[25] Hook SE,Lee RF.Interactive effects of UV,benzo[a]pyrene and cadmium on DNA damage and repair in embryos of the grass shrimp Paleomonetes pugio[J].Mar Environ Res,2004,58 (2):735-739
[26] Harrison JH,Jollow DJ.Contribution of aniline metabolites to aniline-induced methemoglobinemia[J].Mol Pharmacol,1987,32(3):423-431.
[27] Wilmer J.L,Kligerman AD,Erexson,GL.Sister chromatid exchange induction and cell cycle inhibition by aniline and its metabolites in human fibroblasts[J].Environ Mutagen,1981 (3):627-638.
[28] Ma H,Wang J,Abdel-Rahman SZ,et al.Induction of NEIL1 and NEIL2 DNA glycosylases in aniline-induced splenic toxicity [J].Toxicol Appl Pharmacol,2011,251(1):1-7.
[29] Ma H,Wang J,Abdel-Rahman SZ,et al.Oxidative DNA damage and its repair in rat spleen following subchronic exposure to aniline[J].Toxicol Appl Pharmacol,2008,233(2):247-253.
DNA damages in mouse hepatocytes and lymphocytes induced by aniline and their repair dynamics
BIAN Gao-peng1,2,LIU Rui-xiang1,2*,SHI Bao-zhong1,2,JIAO Hai-Hua1
(1.Department of Biological Sciences and Technology,Changzhi College,Changzhi Shanxi 046011,China;2.Taihang Mountain Institute of Ecology and Environment,Changzhi Shanxi 046011)
【Abstract】Objective To investigate the genotoxicity of aniline and repair dynamics in hepatocytes and lymphcytes.Methods Aniline was administered intragastrically to SPF Kunming mice(five mice in each group)in a single dose of 100 mg/kg body weight.The hepatocytes and peripheral blood lymphocytes were obtained at 3,8,16,24,and 32 hours after aniline administration,respectively.The control mice received tap water only.The DNA damages were detected by single cell gel electrophoresis assay(SCGE)and the time-effect relationship was analyzed.Results The results of SCGE experiment showed that both the tail lenth and tail moment of the hepatocyte DNA were increased gradually from 8 h,and reached the maximum at 16 h(P<0.01)after aniline administration.As time went on,DNA damage was recovered gradually,and the two DNA damage indexes were completely returned to control levels at 32 h after aniline administration (P>0.05).The two DNA damage indexes of peripheral blood lymphocytes started to increase at 16 h,reached the maximum at 24 h(P<0.01),and began to recover at 32 h after aniline administration.Conclusions Our findings suggeste that aniline may be a potential genotoxicant to hepatocytes and peripheral blood lymphocytes.There is a clear time-response relationship in terms of the two DNA damage indexes,indicating that hepatocytes and lymphocytes in mice possess an efficient DNA repair mechanism against aniline toxicity.
【Key words】Aniline;Single cell gel electrophoresis assay,SCGE;DNA repair;Mice
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0139-06
Doi:10.3969/j.issn.1005-4847.2016.02.006
[基金项目]中国科学院环境生物技术重点实验室开放研究基金(编号:EBT2013A001);山西省高等学校大学生创新创业训练重点项目(编号:2015426)。
[作者简介]边高鹏(1970-),男,硕士,研究方向:动物毒理学,E-mail:biangaopeng@163.com
[通讯作者]刘瑞祥(1964-),男,硕士,研究方向:环境毒理学,E-mail:liuruixiang1964@163.com
Corresponding author:LIU Rui-xiang,Email:liuruixiang1964@163.com
[收稿日期]2015-08-09
