一株缬草根际稀有放线菌的分离鉴定及其天然产物生物合成基因的筛查
2016-07-14安晓英马怡茗刘香香周童娜贾良辉
安晓英,马怡茗,刘香香,周童娜,颜 华,贾良辉
(西北农林科技大学 生命科学学院,陕西杨凌 712100)
一株缬草根际稀有放线菌的分离鉴定及其天然产物生物合成基因的筛查
安晓英,马怡茗,刘香香,周童娜,颜华,贾良辉
(西北农林科技大学 生命科学学院,陕西杨凌712100)
采用梯度稀释涂布平板法分离缬草根际土壤中的放线菌,从高氏一号培养基上分离得到1株放线菌BJA-103,对该菌形态特征、培养特征、生理生化特征及16S rDNA基因序列进行鉴定,并用简并PCR方法对其多种天然产物生物合成关键酶基因进行筛查。经分类鉴定,初步确定BJA-103为Amycolatopsiscoloradensis的一个菌株;PCR筛查结果显示,该菌株含有非核糖体肽合酶(NRPS)、Ⅰ型聚酮合酶(PKS-Ⅰ)、Ⅱ型聚酮合酶(PKS-Ⅱ)以及糖肽类抗生素合成关键酶P450单加氧酶的基因。
稀有放线菌;分类鉴定;16S rDNA;抗生素生物合成基因
缬草隶属败酱科(Valerianaceae)缬草属(Valeriana)多年生草本,全世界约有250余种,中国约有28种,主产于西南、西北和东北地区。缬草的根及根茎用于镇静安眠和解挛止痛[1-2]。植物根际是指生物和物理特性受到植物根系影响的紧密环绕根的区域,通常指距离根表面1~4 mm,甚至更小的区域。在植物根际区域内生长的微生物称为根际微生物。根际是土壤-植物生态系统物质交换的活跃界面。研究表明,根际放线菌产生抗菌抗生素和其他活性物质的比例显著高于根际周围土壤来源的放线菌[3]。因此,从根际微生物的代谢产物中寻找生物活性物质是人们从大自然中探寻宝藏的又一条途径。
稀有放线菌通常是指使用常规分离方法较链霉菌出菌率低很多的放线菌属,主要包括小单孢菌属(Micromonospora)、诺卡菌属(Nocardia)、马杜拉放线菌属(Actinomadura)、游动放线菌属(Actinoplanes)、拟无枝酸菌属(Amycolatopsis)、小双孢菌属(Microbispora)、糖多孢菌属(Saccharopolyspora)等。稀有放线菌可产生大量多样、独特、前所未有且结构复杂的抗菌低毒性化合物[4],且所产生的抗生素和生物活性代谢物近年来一直在稳定增长[5-7]。天然产物在药物发现和开发过程中具有非常重要的作用,1981-2006年引入全球市场约28%的新化学物质和42%的抗癌药物均为天然产物及其衍生物[8]。放线菌拟无枝酸菌属的成员主要是糖肽类(如万古霉素)和安莎霉素(如利福霉素)抗生素的产生菌,并且这些抗菌药物已成功应用于临床[9]。
随着现代分子生物学的快速发展,许多新的检测活性物质的方法也随之诞生[10],PCR筛选放线菌基因组中特异性抗生素生物合成基因簇是一种快速鉴定抗生素生物合成潜在菌株的有效方法。该方法从微生物基因组的角度出发,筛查抗生素生物合成酶基因,可较大程度减少候选菌株的筛选量,同时对具有活性抗生素合成酶基因的候选菌株可推测其产物的结构类型,便于对其进一步分离研究。
本试验对1株分离自缬草根际土壤中的放线菌BJA-103进行初步鉴定及抗生素生物合成基因筛查的研究,为进一步开发利用该菌株蕴含的天然产物资源打下基础。
1材料与方法
1.1试剂及仪器
PCR仪(BIO-RAD)、水平电泳仪(北京君意东方电泳设备有限公司);PCR试剂购于TaKaRa公司、PCR回收试剂盒购于北京天根生化科技有限公司、合成引物以及测序均在上海生工生物工程技术服务有限公司。
1.2培养基
分离及纯化培养基为高氏一号培养基(可溶性淀粉20.0 g、KNO31.0 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g),LB培养基用于大肠杆菌的培养,TSB培养基用于放线菌的液体培养(大豆蛋白胨3 g/L、Trypton 17 g/L、NaCl 5 g/L、K2HPO42.5 g/L、葡萄糖2.5 g/L、pH 7.3~7.5)。
1.3菌株分离与培养
放线菌BJA-103采用梯度稀释涂布平板法从缬草根际土壤用高氏一号培养基分离得到。经纯化后,用分离培养基高氏一号培养,纯培养物斜面保菌置于4 ℃冰箱进行保藏,将菌体接入φ=50%甘油中于-20 ℃冰箱保藏,备用。
1.4 菌株BJA-103的初步鉴定
1.4.1形态特征将菌株BJA-103接种到高氏一号培养基上,28 ℃培养7 d后,观察其生长情况。使用插片法,用光学显微镜观察插片上的气生菌丝、基内菌丝和孢子的形态特征。
1.4.2培养特征将BJA-103接种在酵母膏-麦芽膏琼脂培养基、燕麦片培养基、无机盐淀粉培养基、甘油天门冬酰胺培养基、营养琼脂培养基、察氏培养基、马铃薯葡萄糖培养基上,28 ℃培养,每2 d观察1次基内菌丝、气生菌丝的生长情况及颜色,是否产生可溶性色素及产生色素的颜色。
1.4.3生理生化特征对菌株的唯一碳源、唯一氮源、硝酸盐还原、H2S产生、明胶液化、牛奶凝固及胨化、淀粉水解、脲酶、纤维素分解、生长温度、pH、NaCl质量浓度等生理生化试验进行考察,参照文献[11]进行。
1.4.416S rDNA基因的PCR扩增及测序 收集高氏一号培养基上生长的BJA-103孢子,用微波法[12]提取总DNA,PCR扩增16S rDNA基因序列,选用通用引物F27序列:5′-AGAGTTTGATCCTGGCTCAG-3′,R1522序列:5′-AAGGAGGTGATCCAGCCGCA-3′。50 μL PCR扩增反应体系:10×Buffer(含Mg2+)5 μL ,2.5 mmol/L dNTP 4 μL ,上下游引物各1 μL,DNA模板1 μL , 2.5 U/μLTaq酶0.5 μL,超纯水35 μL。PCR反应按下述程序进行:95 ℃预变性5 min,95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸2 min,33个循环;72 ℃延伸10 min。利用天根生化科技(北京)有限公司生产的通用性DNA纯化回收试剂盒(离心柱型)对扩增产物进行回收,回收产物与pGM-T载体(50 ng/μL)连接,挑取阳性克隆测序。
1.4.5系统发育树的构建将菌株的16S rDNA基因序列在NCBI上Blast比对,获取与试验菌株相似的典型菌株的16S rDNA序列,选定1株典型链霉菌的16S rDNA序列作为外群,利用MEGA 5.05进行系统发育分析,构建Neighbor-Joining(N-J tree)系统发育树。
1.5菌株BJA-103天然产物生物合成途径关键酶基因的筛查
取TSB培养基培养的BJA-103菌丝体,用Kirby mix法[13]提取总DNA,根据文献[14-15]对菌株BJA-103进行5类天然产物生物合成关键酶基因进行PCR扩增筛查,A3F/A7R引物用于扩增非核糖体肽合酶基因(NRPS),KIF/M6R引物用于扩增Ⅰ型聚酮合酶基因(PKS-Ⅰ),ARO-PKS-F/ARO-PKS-R和PKSⅡ-F1/PKSⅡ-R1用于扩增Ⅱ型聚酮合酶基因(PKS-Ⅱ),Foxy/Roxy引物用于扩增糖肽类抗生素合成关键酶P450单加氧酶的基因(oxyB)、安莎类抗生素关键酶3,5-AHBA合酶基因(AHBA)引物为ANSA-F/ANSA-R。扩增所得片段均用DNA纯化回收试剂盒进行回收,并与pMD18-T载体(50 ng/μL)连接,挑取阳性克隆进行测序分析并构建系统发育树。所用引物及其扩增片段见表1。
2结果与分析
2.1菌株BJA-103的形态特征
由图1和图2可知,菌株BJA-103在高氏一号培养基上生长良好,菌落较小,正面呈白色,中间略有突起,基内菌丝不断裂,气生菌丝分枝,不规则断裂成节段,孢子稀少。
2.2菌株BJA-103的培养特征
菌株BJA-103在酵母膏-麦芽膏琼脂、无机盐淀粉、燕麦片培养基上生长良好,在甘油-天门冬酰胺培养基上生长中等,在察氏、营养琼脂、马铃薯培养基上生长较差,并且在酵母膏-麦芽膏琼脂和马铃薯培养基上,可分别产生红褐色和灰绿色可溶性色素(表2)。
2.3菌株BJA-103 碳氮源利用及生理生化特征
由表3可知,菌株BJA-103为革兰氏阳性菌,其可利用阿拉伯糖、木糖、葡萄糖等多种碳源,可利用丙氨酸、丝氨酸、缬氨酸、精氨酸、赖氨酸、羟脯氨酸、酪氨酸、甲硫氨酸等氮源,不能利用谷氨酸、天门冬氨酸。能使硝酸盐还原、明胶分解、牛奶凝固与胨化、淀粉分解、尿素分解,不产生H2S,不降解纤维素,对酸碱有一定的耐受度,中温生长,能耐受70 g/L NaCl(表3)。
2.4BJA-103菌株的16S rDNA基因序列分析及系统发育N-J树构建
测序结果表明,菌株BJA-103的16S rDNA序列由1 509个碱基构成,将其提交至NCBI进行Blast,发现其与Amycolatopsiscoloradensisstrain IMSNU 22096(NR 042038.1)相似度最高,同源性达99%,表明BJA-103为该菌属的成员。系统发育树见图3。
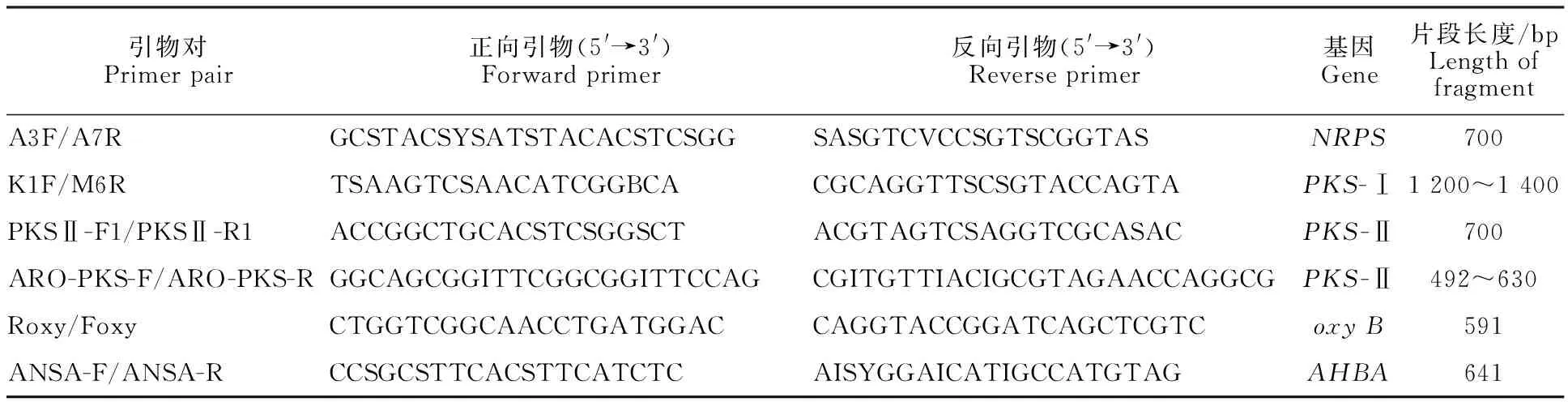
表1 BJA-103菌株PCR筛查所用引物及其匹配的生物合成途径关键酶基因

图1 BJA-103在高氏一号培养基

图2 BJA-103在高氏一号培养基

培养基Medium气生菌丝Aerialmycelium基内菌丝Substratemycelium可溶性色素Solublepigment酵母膏-麦芽膏琼脂 Yeastextract-maltextractagar白色 White白色 White红褐 Red-brown甘油-天门冬酰胺 Glycerol-asparagineagar白色 White白色 White-无机盐淀粉 Inorganicsalts-starchagar白色 White白色 White-燕麦片 Oatmealagar白色 White白色 White-察氏 Czapek’smedium白色 White白色 White-营养琼脂 Nutrientagar白色 White白色 White-马铃薯琼脂 Potatoagar黄色 Yellow褐色 Brown灰绿 Gray-green
注:“-”表示不产生可溶性色素。
Note:“-” means no soluble pigment is formed.
2.5天然产物生物合成途径关键酶基因的筛查
由PCR筛选结果(表4)可知,菌株BJA-103含NRPS、PKS-Ⅰ、PKS-Ⅱ以及糖肽类抗生素合成关键酶P450单加氧酶的编码基因,而安莎类抗生素关键酶3,5-AHBA合成酶基因未检测到。

表3 菌株BJA-103碳氮源利用及生理生化特性
注:“+”表示检测结果阳性;“-”表示检测结果阴性;表4同。
Note:“+” indicates a positive test results; “-” indicates a negative test results;the same as table 4.

图3 根据16S rDNA构建的N-J系统发育树

天然产物合酶基因NaturalproductssynthasegenePCR结果PCRresultNRPS+PKS-Ⅰ+PKS-Ⅱ(PKSⅡ-F1/PKSⅡ-R1)+PKS-Ⅱ(ARO-PKS-F/ARO-PKS-R)+oxyB+AHBA-
2.6糖肽类抗生素生物合成关键酶P450单加氧酶基因oxyB的克隆及分析
2.6.1菌株BJA-103系统发育亲源关系分析图3为以菌株BJA-103的16S rDNA序列构建的系统发育树,由图4可知BJA-103与糖肽类抗生素产生菌Amycolatopsiscoloradensis在同一分支上,初步确定放线菌BJA-103为A.coloradensis属的成员,且推测菌株BJA-103也具有产生糖肽类抗生素的潜能。
2.6.2糖肽类抗生素合成关键酶P450单加氧酶基因oxyB的扩增利用oxyB基因兼并引物,以BJA-103总DNA为模板,PCR扩增发现阳性条带(图4),将条带回收T载体送测序,序列NCBI Blast比对后,构建的系统进化树表明(图5),菌株BJA-103的oxyB基因与Amycolatopsis属的亲源关系较近,且与其亲源关系最近的为Amycolatopsissp. MJM2582(KF882511.1)。而Streptomycessp. WAC1420(JX026280.1)也位于其中,且与Amycolatopsis属的oxyB基因片段有亲源关系,推测该链霉菌属中的糖肽类抗生素生物合成基因簇发生了基因水平漂移[16]。
2.6.3NRPS基因的扩增将条带回收连接T载体送测序(图6),结果得到2个NRPS序列,2个片段相互之间的相似度为55.42%(图7),再将这2个片段进行NCBI Blast比对后,构建系统进化树表明(图7),与其相似度最高的序列及其相似性分别为Amycolatopsislurida NRRL 2430 complete genome(91%),Amycolatopsissp.WAC1375 genomic sequence(90%)。

M. DL 2 000 Marker;1~8. 退火温度分别为64 ℃,63 ℃,62 ℃,61 ℃,60 ℃,59 ℃,58 ℃,57 ℃下oxyB基因的PCR产物PCR products ofoxyBgene under the annealing temperature 64 ℃,63 ℃,62 ℃,61 ℃,60 ℃,59 ℃,58 ℃ and 57 ℃, respectively
图4菌株BJA-103的oxyB基因扩增电泳结果
Fig.4Agrose electrophoresis ofoxyB
gene amplification of BJA-103

图5 菌株BJA-103的oxy B基因的系统发育树

M. DL 2000 Marker;1~5.NRPS基因的PCR产物PCR products ofNRPSgene
图6菌株BJA-103的NRPS基因扩增电泳结果
Fig.6Agrose electrophoresis ofNRPS
gene amplification of BJA-103
3讨 论
根据菌株BJA-103的形态特征、培养特征、碳氮源利用及生理生化特征、16S rDNA基因序列分析,以及基于16S rDNA基因构建的系统发育树,初步确定放线菌BJA-103为Amycolatopsiscoloradensis的一个菌株。天然产物生物合成关键酶基因的PCR筛查结果显示,该菌株具有合成非核糖体肽类、聚酮类及糖肽类等多种抗生素的潜能。
目前,拟无枝酸菌属的2个代表菌株东方拟无枝酸菌HCCBl0007(产万古霉素)和地中海拟无枝酸菌U32(产利福霉素)的全基因组已经测序,并且万古霉素是一种糖肽类抗生素。本试验中,菌株BJA-103被初步确定为糖肽类产生菌Amycolatopsiscoloradensis的成员,同时在该菌中也检测到糖肽类抗生素合成关键酶P450单加氧酶基因oxyB的基因,由此可见,该菌株产糖肽类抗生素的可能性很大。但由于基因沉默等多种原因,产抗生素的种类及多少都有待进一步研究。此外,东方拟无枝酸菌(Amycolatopsisorientalis)并无PKS-Ⅱ基因,而菌株BJA-103检测到该基因的存

图7 菌株BJA-103的NRPS基因的系统发育树
在,说明菌株BJA-103的天然产物合成基因资源较为丰富。
因此,通过设计抗生素生物合成关键酶基因的简并引物用PCR方法来检测微生物中的抗生素基因,能够快速有效地锁定潜力菌株,既缩短试验的时间,又为发现新的生物活性化合物提供重要思路。
Reference:
[1]陈磊,秦路平,郑汉臣,等.缬草的化学成分、植物资源和药理活性[J].药学实践杂志,2000,18(5):277-279.
CHEN L,QIN L P,ZHENG H CH.The chemical composition,plant resources and pharmacological activity ofValerian[J].TheJournalofPharmaceuticalPractice,2000,18(5):277-279(in Chinese).
[2]石晋丽.国产缬草属药用植物资源的研究[D].北京:北京中医药大学,2004.
SHI J L.Study on the medicinal plant resources ofValerianain China[D].Beijing:Beijing University of Chinese Medicine,2004(in Chinese with English abstract).
[3]JANIEE L,ANTONY J,STRAP H M,etal.Studies on the microbial populations of the rhizosphere of big sagebrush(Artemisiatridentata)[J].JournalofIndustrialMicrobiology&Biotechnology,2004,31(6):278-88.
[4]BERDY J.Bioactive microbial metabolites[J].JournalofAntibiotics,2005,58(1):1-26.
[5]FENICAL W,JENSEN P R.Developing a new resource for drug discovery:marine actinomycete bacteria[J].NatureChemicalBiology,2006,2(12):666-673.
[6]LAM K S.Discovery of novel metabolites from marine actinomycetes[J].CurrentOpinioninMicrobiology,2006,9(3):245-251.
[7]SUBRAMANI R,AALBERSBERG W.Marine actinomycetes:an ongoing source of novel bioactive metabolites[J].MicrobiologicalResearch,2012,167(10):571-580.
[8]NEWMAN D J,CRAGG G M.Natural products as sources of new drugs over the last 25 years[J].JournalofNaturalProducts,2007, 70(3):461-477.
[9]LAZZARINI A,CAVALETTI L,TOPPO G,etal.Rare genera of actinomycetes as potential producers of new antibiotics[J].AntonievanLeeuwenhoek,2000,78(3/4):399-405.
[10]SCHIRMER A,GADKARI R,REEVES C D,etal.Metagenomic analysis reveals diverse polyketide synthase gene clusters in microorganisms associated with the marine spongeDiscodermiadissoluta[J].AppliedandEnvironmentalMicrobiology,2005,71(8):4840-4849.
[11]徐丽华,李文均,刘志恒,等.放线菌系统学[M].北京:科学出版社,2007:40-47.
XU L H,LI W J,LIU ZH H,etal.Actinomycetes Systematics[M].Beijing:Science Press,2007:40-47(in Chinese).
[12]徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组DNA[J].微生物学通报,2003,30(4):82-84.
XU P,LI W J,XU L H,etal.A microwave-based method for genomic DNA extraction from actinomycetes[J].Microbiology,2003,30(4):82-84(in Chinese with English abstract).
[13]KIESER T,BIBB M J,Buttner M J,etal.PracticalStreptomycesgenetics[M].Norwich:The Jonh Innes Foundation,2000:168-169.
[14]AYUSO-SACIDO A,GENILLOUD O.New PCR primers for the screening of NRPS and PKS-I systems in actinomycetes:detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J].MicrobialEcology,2005,49(1):10-24.
[15]WOOD S A,KIRBY B M,GOODWIN C M,etal.PCR screening reveals unexpected antibiotic biosynthetic potential inAmycolatopsissp. strain UM16[J].JournalofAppliedMicrobiology,2007,102(1):245-253.
[16]SOSIO M,STINCHI S,BELTRAMETTI F,etal.The gene cluster for the biosynthesis of the glycopeptide antibiotic A40926 byNonomuraeaspecies[J].ChemicalBiology,2003,10(6):541-549.
Identification of an Rare Actinomycetes and Screening of Natural Products Biosynthesis Genes from Valerian Rhizosphere Soil
AN Xiaoying, MA Yiming, LIU Xiangxiang,ZHOU Tongna,YAN Hua and JIA Lianghui
(College of Life Sciences, Northwest A&F University, Yangling Shaanxi712100, China)
Actinomycetes were isolated from valerian rhizosphere soil using dilution-plate method, one of them was identified based on morphological, cultural, physiological, biochemical characteristics and 16S rDNA gene sequence, and the key enzyme genes of natural products biosynthesis pathways were screened by degenerate PCR. The results showed that actinomycetes BJA-103 isolated from Gause Ⅰ medium was preliminarily identificated as a member of the genusAmycolatopsiscoloradensis. PCR check-screening of its natural products biosynthesis genes revealed that it possessed the genes of nonribosome polypeptide synthetase(NRPS), polyketides synthetase Ⅰ (PKS-Ⅰ ), polyketides synthetase Ⅱ(PKS-Ⅱ) and glycopeptide P450monooxygenase.
Rare actinomycetes;Identification;16S rDNA;Antibiotic biosynthesis genes
2015-05-13
2015-06-15
The Fundamental Research Funds for the Central Universities of China (No.Z109021426,Z109021432); Open Fund of the State Key Laboratory of Microbial Metabolism, Shanghai Jiao Tong University (No.MMLKF14-09); Research Fund for the Doctoral Program of Higher Education of China (No.20120204120034,20120204120042).
AN Xiaoying,female,master student.Research area:microbial resources and utilization.E-mail: anxiaoying23@163.com
JIA Lianghui,male,associate professor.Research area:microbial metabolic engineering and chemical biology.E-mail: jialianghui@nwsuaf.edu.cn
(责任编辑:史亚歌Responsible editor:SHI Yage)
2015-05-13修回日期:2015-06-15
中央高校基本科研业务费(Z109021426,Z109021432);上海交通大学微生物代谢国家重点实验室开放基金(MMLKF14-09);高校博士点基金(20120204120034,20120204120042)。
安晓英,女,硕士研究生,研究方向为微生物资源与利用。E-mail:anxiaoying23@163.com
贾良辉,男,副教授,主要从事微生物代谢工程和化学生物学的研究。E-mail:jialianghui@nwsuaf.edu.cn
Q935
A
1004-1389(2016)07-1080-07
网络出版日期:2016-06-30
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160630.1635.038.html
