甘蓝过量表达硝酸还原酶基因对硝酸盐积累的影响
2016-07-14张正英陈玉梁
张正英,陈玉梁
( 1.甘肃省农业科学院,兰州 730070;2.甘肃省农业科学院 生物技术研究所,兰州 730070)
甘蓝过量表达硝酸还原酶基因对硝酸盐积累的影响
张正英1,陈玉梁2
( 1.甘肃省农业科学院,兰州730070;2.甘肃省农业科学院 生物技术研究所,兰州730070)
为探索过量表达硝酸还原酶基因对甘蓝(BrassicaoleraceaL. var.capitataL.)硝酸盐积累的影响,以‘中甘11号’下胚轴为外植体,采用根癌农杆菌(Agrobacteriumtumefaciens)介导法将烟草硝酸还原酶基因(NR)导入甘蓝,获得13株卡那霉素抗性植株。PCR和Southern blot检测证实,NR基因已经成功导入并整合到甘蓝的基因组。4个转基因株系硝酸盐质量分数明显低于非转基因供体株系,降幅为13.9%~23.0%。说明:将重组硝酸还原酶基因导入甘蓝且得到超量表达,创制低硝酸盐育种材料的方法可行。
甘蓝;农杆菌介导法;硝酸还原酶基因;硝酸盐质量分数

甘蓝(BrassicaoleraceaL. var.capitataL.)是人们喜食的蔬菜之一。以甘蓝、花椰菜、娃娃菜等优势蔬菜产品为主的 “高原夏菜” 已成为甘肃农业的亮点,销往全国80多个大中城市[7]。甘蓝存在硝酸盐积累的品种特异性,是较易积累硝酸盐的蔬菜品种之一[8-9]。近年来,因栽培中过度使用化学肥料、农药造成蔬菜化肥农药残留问题突出,重茬栽培叶类蔬菜硝酸盐危害尤为明显[10-11]。都韶婷等[12]研究显示,筛选低硝酸盐积累的蔬菜品种是降低蔬菜硝酸盐积累的一种可行措施。
甘蓝转基因研究已在抗虫、抗旱、耐盐及雄性不育等方面取得较好的进展,优化以农杆菌介导法为主的基因转化体系,明确子叶、下胚轴等外植体及基因型在甘蓝基因转化中的作用,创造一些具有利用前景的新材料[13-16]。为探索过量表达硝酸还原酶基因对甘蓝硝酸盐积累的影响,本研究将硝酸还原酶基因转入甘蓝且得到超量表达,获得低硝酸盐质量分数的育种材料,为其他蔬菜的品质改良提供新思路。
1材料与方法
1.1试验材料
1.1.1植物材料甘蓝品种‘中甘11号’由甘肃省农业科学院飞天种业股份公司提供。试验在甘肃省农业科学院生物技术实验室进行。
1.1.2菌株和载体供试根癌农杆菌菌株为LBA4404。植物重组质粒表达载体pBCSL16由中国农业大学植物生理生化国家重点实验室肖兴国博士提供,质粒中目标基因NR与选择基因nptⅡ相连,由 CaMV35s启动子驱动(图1)。
1.1.3培养基MS培养基为基本培养基,固体YEP培养基为培养农杆菌所用培养基,液体MS培养基为菌液悬浮培养基。甘蓝遗传转化培养基及其配方见表1。
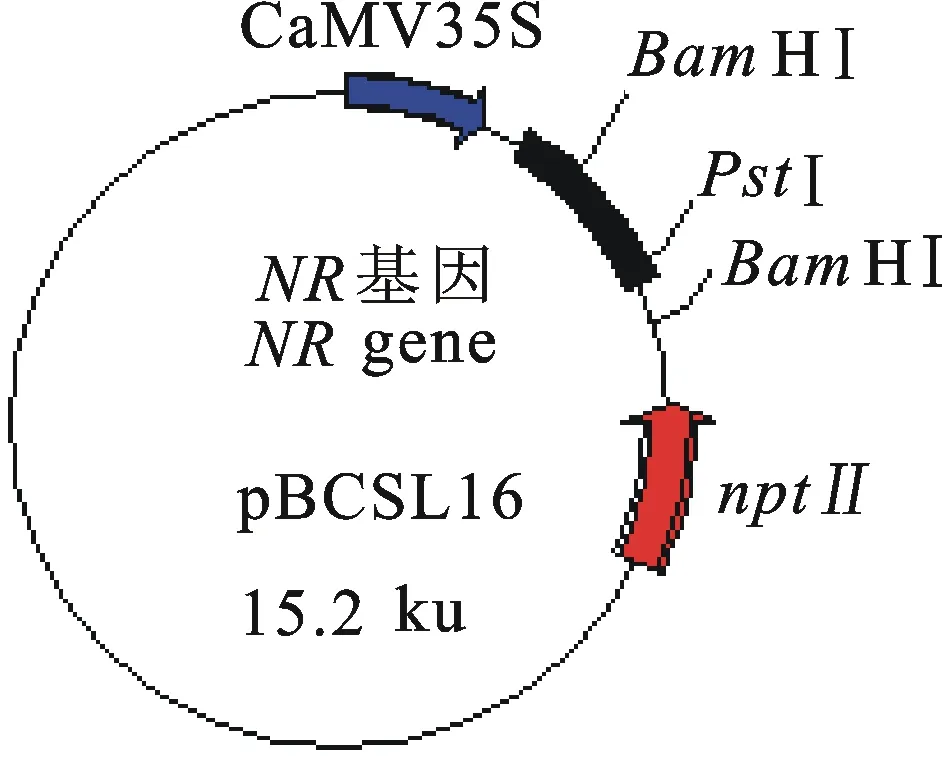
图1 植物表达载体pBCSL16结构
1.2试验方法
1.2.1外植体准备将预冷处理的‘中甘11’号种子,用自来水冲洗30 min,40 ℃水浸泡30 min,滤去水分;用φ=75%乙醇处理1 min,再用1 g/L HgCl2消毒8 min,无菌水清洗6次;接种到播种培养基上发芽。取7 d龄苗的下胚轴接种于预培养培养基,25 ℃暗处预培养2 d,用于转化试验。
1.2.2侵染菌液制备挑取含有NR质粒的农杆菌LBA4404单菌落,接种于5 mL液体YEB培养基(含50 mg/L卡那霉素和100 mg/L链霉素),28℃、250r/min振荡培养过夜;将培养好的菌液按1%的接种量接种至YEB培养基(含50 mg/L卡那霉素和100 mg/L链霉素),28 ℃继续培养24 h,直到OD600约为1.0左右,将菌液悬浮液在8 000 r/min离心8 min收集菌体,用无菌的1/2 MS培养基重新悬浮菌体沉淀,并按照悬浮液和1/2 MS培养基按一定比例稀释,使获得的侵染菌液OD600值约为0.6。

表1 甘蓝遗传转化培养基
1.2.3遗传转化取出在预培养培养基上暗培养2 d的下胚轴,浸入用1/2 MS稀释、OD600值为 0.6的工程菌液,浸染10 min,期间一直轻微摇动,使农杆菌与外植体充分接触;用滤纸吸去外植体表面过多的菌液,接种于置有一层无菌滤纸的MS培养基,每皿接种10~15个外植体,25 ℃黑暗共培养2 d。清洗外植体,转入加有500 mg/L羧苄青霉素的分化培养基,25 ℃、16 h/8 h光周期下培养,诱导抗性愈伤组织产生。采用延迟筛选法筛选抗性芽,即在得到绿色分化芽时转入加有卡那霉素的延迟选择培养基,且卡那霉素质量浓度由5 mg/L逐渐增加到20 mg/L。经卡那霉素筛选至抗性芽长1 cm左右,将保持绿色的抗性芽转入生根培养基中长成完整绿色植株。未用农杆菌侵染的对照外植体用同样方法进行培养。对筛选得到的生根绿苗进行编号,通过茎段进行扩繁,扩大株系群体。将经分子鉴定、生根健壮的转化苗开瓶练苗7 d,冲洗干净根部的培养基,移入V(蛭石)∶V(土)=1∶1的花盆,开始用塑料薄膜覆盖花盆,并及时浇水、通风,后期管理同温室培养常规管理。按获得的抗性植株占总外植体的百分率统计转化率。
1.2.4PCR分子检测分别取经抗生素筛选的T0遗传转化再生植株叶片和对照植株叶片各2 g,用CTAB法[17]提取甘蓝基因组DNA。根据nptⅡ基因序列设计引物,预期扩增片段大小为676 bp。上、下游引物序列分别为:5′-CGTAAAGCACGAGGAAGC-3′和5′-AATGAACTCCAGGACGAGG-3′,均由生工生物工程(上海)股份有限公司合成。PCR扩增体系:10×PCR Buffer 2.5 μL,25 mmol/L dNTP 2.0 μL,25 mmol/L MgCl22.0 μL,20 μmol/L两端引物各1.0 μL,TaqDNA 聚合酶1 U,基因组DNA 模板200 ng,加双蒸水至25 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性45 s,68 ℃复性1 min,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。取样10.0 μL经20 g/L琼脂糖凝胶电泳检测扩增效果。
1.2.5Southern blot杂交分析以提取的转化植株基因组DNA为样品,以质粒pBCSL16经BamHⅠ酶切 DNA为正对照,以非转化植株基因组DNA为负对照,DNA经内切酶BamHⅠ消化,8 g/L琼脂糖电泳检测酶切结果准确后,采用毛细管转移法转至硝酸纤维素膜,准备分子杂交。质粒用BamHⅠ酶切,回收约3.7 kb的硝酸还原酶基因片段作模板,用地高辛标记该片段作为杂交探针,进行Southern blot杂交。探针标记、杂交及检测试剂盒为DIG High Prime DNA Labeling and Detection Starter KitⅠ,购自罗氏诊断产品(上海)有限公司,具体步骤按照试剂盒操作说明执行。
1.2.6转基因株系硝酸盐质量分数测定转基因和对照植株在温室生长约 2个月后,取其叶片采样。每个株系测定4株,以未转化植株为对照,测定方法采用GB/T 15401-1994。
2结果与分析
2.1甘蓝转化体系的建立及转化植株的获得
在对影响转化效果的关键因素进行优化后,初步建立一套适宜‘中甘11号’的遗传转化体系,即将7 d苗龄的下胚轴,在预培养基中培养2 d后作为外植体,在OD600约 0.6的农杆菌工程菌液中浸染10 min,再在pH为5.8、不加抗生素的分化培养基中共培养2 d;经愈伤组织诱导分化、继代培养与抗生素延迟筛选、生根生长等过程,获得抗性工程植株13株,遗传转化频率为10.9%。
2.2转化植株的 PCR检测与Southern blot杂交
以质粒pBCSL16为阳性对照,未转化基因植株为阴性对照,对13株抗性苗中生长健壮的4株进行 PCR分析。4株转基因植株均得到 1条676 bp的片段,与预期片段大小相符(图2)。
将 PCR检测为阳性的 4株转基因植株进行Southern blot杂交分析,4株植株均获得明显的杂交信号,而非转化对照基因组中未出现任何杂交信号,进而证实NR基因已整合至甘蓝基因组(图3)。
1. Marker;2. 阳性对照Positive control;3. 阴性对照Negative control;4~7. 转化植株G2、G4、G6、G21Transgenic plants: G2,G4,G6 and G21
图2甘蓝转化植株的PCR 鉴定
Fig.2PCR amplification of transgenic plants of cabbage

1. Marker;2. 阴性对照Negative control;3. 阳性对照Positive control;4~7. 转化植株G2、G4、G6、G21Transgenic plants: G2,G4,G6 and G21
图3甘蓝转化植株的 Southern blot杂交
Fig.3Southern blot hybridization of
transgenic cabbage plants
2.3甘蓝转基因植株硝酸盐质量分数
对转基因甘蓝植株叶片硝酸盐质量分数进行测定,结果显示,甘蓝转基因植株体内硝酸盐质量分数均显著低于未转基因对照株,降低13.9%~23.0%,其中,株系G2和G21降低幅度最大,接近和达到23.0%(图4)。说明,利用基因工程技术降低蔬菜植株硝酸盐质量分数的方法可行。

图4 转基因甘蓝植株硝酸盐质量分数
3结论与讨论
因为氮肥用量增加及连作,蔬菜中累积硝态氮的增加程度远大于生长量的增加量[8],这是蔬菜中硝酸盐质量分数较高的起因。提高氮素肥料利用率、降低硝酸盐积累量、提高硝酸还原酶活性是降低蔬菜中硝酸盐质量分数的有效途径,本研究初步证明,与甘蓝未转基因对照株比较,转基因植株体内的硝酸盐质量分数降低13.9%~23.0%,差异十分明显,说明:通过基因的过量表达可以实现降低蔬菜中硝酸盐含量的目标。
建立高效的遗传转化体系是实现转基因遗传操作的基础。有研究显示,建立较好的种子表面消毒技术,平均发芽率可达到75%以上[18]。以无菌苗子叶、下胚轴为外植体,从基因型、苗龄、培养基(生长调节剂、AgNO3质量浓度等)等因素研究甘蓝转化体系,发现用下胚轴作外植体效果明显优于子叶。王肖红等[19]、李春雨等[16]、何绍敏等[20]等以甘蓝下胚轴为外植体成功获得耐盐、不育和抑制自交不亲和的转化体。
在甘蓝类蔬菜上,多数试验采用10~25 mg/L卡那霉素作为筛选压[21]。预备试验发现,较低质量浓度(5 mg/L)的卡那霉素可抑制下胚轴再生,当卡那霉素质量浓度高于20 mg/L可致甘蓝不定芽白化死亡,说明甘蓝对卡那霉素非常敏感,为达到既不影响再生又确保筛选的目的,采取抗生素延迟筛选的办法效果较好。即在分化初期的培养基中(第1周)不加卡那霉素,仅加入羧苄青霉素,抑制农杆菌;待外植体膨大产生愈伤后,继代筛选培养过程中加入卡那霉素,选择压力由5 mg/L逐渐增加到20 mg/L进行抗性筛选。加入卡那霉素后外植体的分化速度减缓,部分外植体开始白化或褐化死亡,每隔15 d进行继代培养,随着选择次数的增加逐渐降低羧苄青霉素质量浓度至200 mg/L,直至分化出绿苗。
在农杆菌介导的芸苔属蔬菜遗传转化方法中,转化效率受基因型和外植体影响较明显。甘蓝转基因的难度较大,品种间也存在较大差异[22]。
本研究仅建立甘蓝品种‘中甘11号’的遗传转化体系,而且不是纯系自交系,限制获得材料的应用;由于外源基因的插入位点具有随机性,目标基因在后代中的遗传稳定性和表达还有待于深入研究。
Reference:
[1]BOINK A,SPEIJERS G.Health effects of nitrates and nitrites,a review[J].ActaHorticulture,2001,563:29-36.
[2]WHITE J W J,Relative significance of dietary source of nitrate and nitrite [J].JournalofAgriculturalandFoodChemistry,1975,23(5):886-891.
[3]刘杏认,任建强,甄兰.蔬菜硝酸盐累积及其影响因素的研究[J].土壤通报,2003,34(4):356-360.
LIU X R,REN J Q,ZHEN L.Advance in the study of nitrate accumulation in vegetables and influence factors [J].ChineseJournalofSoilScience, 2003,34(4):356-360(in Chinese with English abstract).
[4]NATO A,FLIPO V,HOARA U J,etal.Are two localization sites of nitrate reductase responsible for the differential expression in tobacco cells during the growth cycle? [M]//Chapter Progress in Plant Cellular and Molecular Biology,Volume 9 of the Series Current Plant Science and Biotechnology in Agriculture.Dordrecht:Kluwer Academic Publisher,1990:349-354.
[5]OLDAY F C,BARKER A V,MAYNARD D N.A physiological basis for different patterns of nitrate accumulation in two spinach cultivars [J].JournaloftheAmericanSocietyforHorticulturalScience,1976,101(3):217-219.
[6]CURTIS I S,POWER J B,LAAT A M M,etal.Expression of a chimeric nitrate reductase gene in transgenic lettuce reduces nitrate in leaves [J].PlantCellReports,1999,18(11):889-896.
[7]杨佑福.甘肃高原夏菜生产特点[J].农业科技与信息,2015(12):14-15.
YANG Y F.Characteristics of plateau summer vegetable production in Gansu province [J].AgriculturalTechnologyandInformation,2015(12):14-15(in Chinese).
[8]SANTAMARIA P.Nitrate in vegetables:toxicity,content,intake and EC regulation [J].JournaloftheScienceofFoodandAgriculture,2006,86(1):10-17.
[9]沈明珠,翟宝杰,东惠茹,等.蔬菜硝酸盐累积的研究I.不同蔬菜硝酸盐和亚硝酸盐含量评价[J].园艺学报,1982,9(4):41-48.
SHEN M ZH,ZHAI B J,DONG H R,etal.Studies on nitrate accumulation in vegetable cropI.Evaluation of nitrate and nitrite in different vegetables [J].ActaHorticulturaeSinica,1982,9(4):41-48(in Chinese with English abstract).
[10]ARAEB B A,蔡元定.植物积累硝酸盐的农业生态因素[J].土壤学进展,1992,20(2):20-24.
ARAEB B A,CAI Y D.Agro-ecological factors of nitrate accumulation in plant [J].ProgressinSoilScience,1992,20(2):20-24(in Chinese).
[11]刘永刚,陈利军,武志杰.蔬菜中硝酸盐的积累机制及其调控措施[J].土壤通报,2006,37(3):612-616.
LIU Y G,CHEN L J,WU ZH J.Accumulation mechanisms of nitrate in vegetables and their regulation[J].ChineseJournalofSoilScience,2006,37(3):612-616(in Chinese with English abstract).
[12]都韶婷,章永松,林咸永,等.蔬菜积累的硝酸盐及其对人体健康的影响[J].中国农业科学,2007,40(9):2007-2014.
DU SH T,ZHANG Y S,LIN X Y,etal.Accumulation of nitrate in vegetables and its possible implications to human health[J].ScientiaAgriculturaSinica,2007,40(9):2007-2014(in Chinese with English abstract).
[13]杨丽梅,方智远,刘玉梅,等.“十一五”我国甘蓝遗传育种研究进展[J].中国蔬菜,2011(2):1-10.
YANG L M,FANG ZH Y,LIU Y M,etal.Advances of research on cabbage genetics and breeding during ‘The Eleventh Five-year Plan’ in China[J].ChinaVegetables,2011(2):1-10(in Chinese with English abstract).
[14]刘东明,杨丽梅,方智远,等.甘蓝类蔬菜作物分子育种研究进展[J].中国农业科技导报,2015,17(1):15-22.
LIU D M,YANG L M,FANG ZH Y,etal.Progress ofBrassicacrops molecular breeding[J].JournalofAgriculturalScienceandTechnology,2015,17(1):15-22(in Chinese with English abstract).
[15]王丽,仪登霞,杨丽梅,等.转Bt基因早熟春甘蓝抗虫材料的获得[J].中国蔬菜,2014(10):12-17.
WANG L,YI D X,YANG L M,etal.Obtaining of insect-resistant material withBtin early spring cabbage[J].ChinaVegetables,2014(10):12-17(in Chinese with English abstract).
[16]李春雨,何绍敏,兰彩耘,等.BcA9-Barnase转基因雄性不育甘蓝的获得[J].西南大学学报(自然科学版),2015,37(7):52-58.
LI CH Y,HE SH M,LAN C Y,etal.Transgenic male sterile cabbage plants induced by BcA9-Barnase transformation[J].JournalofSouthwestUniversity(NaturalScienceEdition),2015,37(7):52-58(in Chinese with English abstract).
[17]萨姆布鲁克 J,弗里奇 E F,曼尼阿蒂斯 T.分子克隆实验指南[M].第2版.金冬雁,黎孟枫,译.北京:科学出版社,1992:954-960.
SAMBROOKE J,FRISTSCH E F,MANIATIS T.Molecular Cloning:A Laboratory Manual[M].2nd ed.JIN D Y,LI M F,Trans.Beijing:Science Press,1992:954-960(in Chinese).
[18]朱艳,张正英,陈玉梁.几种影响甘蓝再生分化体系的因素[J].植物生理学通讯,2004,40(4):452.
ZHU Y,ZHANG ZH Y,CHEN Y L.Factors affecting regeneration and differentiation of cabbage [J].PlantPhysiologyCommunications,2004,40(4):452(in Chinese with English abstract).
[19]王肖红,曾爱松,高兵,等.StP5CS基因转化结球甘蓝的研究[J].西北植物学报,2013,33(5):885-891.
WANG X H,ZENG A S,GAO B,etal.Resistance to salt in cabbage(BrassicaoleraceaL.var.capitataL.) transformed with StP5CS gene[J].ActaBotanicaBoreali-OccidentaliaSinica,2013,33(5):885-891(in Chinese with English abstract).
[20]何绍敏,李春雨,兰彩耘,等.转MLPK反义基因对甘蓝自交不亲和性的影响[J].园艺学报,2015,42(2):252-262.
HE SH M,LI CH Y,LAN C Y,etal.Effect of antisense RNA of theMLPKgene on self-incompatibility in cabbage[J].ActaHorticulturaeSinica,2015,42(2):252-262(in Chinese with English abstract).
[21]秦耀国,雷建军,曹必好,等.甘蓝类蔬菜遗传转化研究进展[J].中国蔬菜,2004(4):61-63.
QIN Y G,LEI J J,CAO B H,etal.The research progress about genetic transformation of brassica vegetables [J].ChineseVegetables,2004(4):61-63(in Chinese).
[22]李贤,姚泉洪,彭日荷,等.Bt转基因抗虫甘蓝的研制[J].上海农业学报,2008,24(3):16-20.
LI X,YAO Q H.PENG R H,etal.Study onBttransgenic cabbage with insect resistance [J].ActaAgriculturaeShanghai,2008,24(3):16-20(in Chinese with English abstract).
Effect of Overexpression of Nitrate Reductase Gene on Nitrate Accumulation in Cabbage
ZHANG Zhengying1and CHEN Yuliang2
(1. Gansu Academy of Agricultural Sciences,Lanzhou730070,China;2.Institute of Biotechnology,Gansu Academy of Agricultural Sciences,Lanzhou730070,China)
To explore the effects of overexpression of nitrate reductase gene on cabbage(BrassicaoleraceaL. var.capitataL.) nitrate accumulation,the nitrate reductase gene from tobacco was transfer into genome of cabbage cultivar ‘Zhonggan No.11’ viaAgrobacteriumtumefaciensand 13 transgenic plants with kanamycin risistance were obtained.PCR and Southern blot showed that nitrate reductase gene was successfully integrated into the genome of cabbage. Determination of leaf nitrate content showed that nitrate content were significantly lower,with the decline range of 13.9%-23.0%,in four transgenic lines than the donor line. The results indicated that it is feasible to create cabbage breeding materials characterized low nitrate by means of excessively expressing the restructured nitrate reductase genes.
Cabbage;Agrobacterium-mediated gene transfer; Nitrate reductase gene; Nitrate mass fraction
2016-02-23
2016-04-20
The National Natural Science Foundation of China(No.31460350); the Operating Sci-tech Project of Gansu province(No.QS022-C31-048).
ZHANG Zhengying,male,associate research fellow.Research area:genetics and breeding in crops.E-mail:kegc8@sina.com
(责任编辑:郭柏寿Responsible editor:GUO Baishou)
2016-02-23修回日期:2016-04-20
国家自然科学基金(31460350);甘肃省科学事业费(QS022-C31-048)。
张正英,男,副研究员,研究方向为作物遗传育种。E-mail:kegc8@sina.com
S335.3
A
1004-1389(2016)07-1024-05
网络出版日期:2016-06-30
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160630.1624.018.html
