阿托伐他汀对颅脑外伤后小胶质细胞激活的影响
2016-07-14郁龚杰孙东东曾勇高伟伟陈思亲张建宁
郁龚杰,孙东东,曾勇,高伟伟,陈思亲,张建宁
阿托伐他汀对颅脑外伤后小胶质细胞激活的影响
郁龚杰1,孙东东1,曾勇1,高伟伟1,陈思亲2,张建宁1
摘要:目的观察阿托伐他汀对颅脑损伤(TBI)后小胶质细胞激活的影响。方法将60只C57/BL6小鼠随机分为假手术组、生理盐水组和阿托伐他汀组,各20只。生理盐水组和阿托伐他汀组采用液压打击法制作TBI模型。假手术组不进行液压打击。阿托伐他汀组打击后1 h给予阿托伐他汀(每天1 mg/kg)灌胃,连续7 d。生理盐水组给予等量生理盐水灌胃。采用免疫组化法检测造模后第1、3、7天创伤灶周围小胶质细胞特异性标志物(Iba-1)的数量及第3天基质金属蛋白酶(MMP)-9水平;Western blot检测炎症因子肿瘤坏死因子(TNF)-α水平。结果造模后第1、3、7天,阿托伐他汀组小鼠创伤灶周围Iba-1阳性表达量较生理盐水组均显著降低(80.00±7.44 vs.118.40± 6.65,85.60±10.87 vs.189.00±7.51,69.40±5.54 vs.102.40±10.89,P<0.05)。TBI后第3天,阿托伐他汀组MMP-9阳性表达量与生理盐水组相比也显著下降(86.80±8.40 vs.133.80±8.46,P<0.05);Western blot检测发现阿托伐他汀组与生理盐水组相比TNF-α表达下降(0.64±0.01 vs.0.97±0.02,P<0.05)。结论阿托伐他汀能减少小鼠TBI后小胶质细胞的激活,减少炎症因子的表达,起到抗炎作用。
关键词:颅脑损伤;小神经胶质细胞;基质金属蛋白酶9;肿瘤坏死因子α;阿托伐他汀
颅脑外伤(TBI)是神经外科的常见病和多发病,具有较高的致死率和致残率,是45岁以下青壮年的主要死因[1-2]。小胶质细胞是中枢神经最重要的固有免疫细胞和主要的效应细胞,TBI发生后,脑内的小胶质细胞被激活来清除损伤的细胞和组织。但是小胶质细胞过度激活后识别“自己”的能力减弱,在发挥“清道夫”作用的同时可将正常血脑屏障(BBB)组织一并损伤,其分泌的肿瘤坏死因子(TNF)-α诱导颅内免疫炎症反应,进而促进颅脑继发性损伤的发生[3]。研究表明,阿托伐他汀属于β-羟基-β-甲基戊二酰辅酶A还原酶抑制剂,具有抗氧化和抗炎作用,能减少继发性血管损伤和血栓形成。本研究旨在观察阿托伐他汀对TBI后小鼠创伤灶周围小胶质细胞激活的影响,探讨其在TBI中的作用。
1 材料与方法
1.1主要仪器与试剂液压冲击装置(美国NEWSUN公司,MODEL01-B)、小动物立体定向固定架(天津市神经病学研究所,TJNS-I)、数字存储示波器(美国Tektronix,TDS2012)、小动物呼吸机(TKR-200C型)等。10%水合氯醛(天津医科大学总医院药剂科)、多聚甲醛(武汉博士德公司)、阿托伐他汀(杭州默沙东公司)。小胶质细胞特异性标志物(Iba-1,日本wako公司,0.01 mol/L,一抗稀释液稀释),基质金属蛋白酶-9(MMP-9,0.01 mol/L,一抗稀释液稀释)、TNF-α(美国Abcam公司)、β-肌动蛋白(β-actin,美国CST公司)及相应二抗(山羊抗兔,中山金桥公司)。
1.2实验动物及分组健康成年雄性C57/BL6小鼠60只,清洁级,体质量20~25 g,购自中国军事医学科学研究院,安静、温暖、避强光环境中饲养48 h。按照简单随机抽样法将60只小鼠分为假手术组、生理盐水组和阿托伐他汀组,各20只。
1.3动物模型制作及处理采用McIntosh等[4]的方法制备液压打击TBI模型。选择前囟点后方2 mm,矢状缝右侧2 mm作为圆心,用磨钻磨出一个直径为2 mm的骨孔。保证硬膜完好。小鼠液压打击压力为1.620 8×105~1.823 4×105Pa,冲击时程约为20 ms。假手术组小鼠仅行头皮切开和磨开骨孔,不进行液压打击。阿托伐他汀组在液压打击后1 h至第7天给予1 mg/(kg·d)阿托伐他汀灌胃,生理盐水组同时给予等量生理盐水灌胃。
1.4免疫组织化学法检测脑组织中Iba-1和MMP-9的表达情况造模后各组随机抽取5只小鼠,采用10%水合氯醛腹腔注射麻醉后,4%多聚甲醛心室灌注,开颅取脑,再用4%多聚甲醛磷酸缓冲液固定24 h,然后常规脱水,石蜡包埋,以创伤灶为中心制作切片,连续5张,厚5 μm。将切好的散片脱蜡;切片入枸橼酸盐缓冲液微波加热进行抗原修复30 min;切片置入3%H2O2中抑制内源性过氧化物酶10 min,蒸馏水洗5 min;切片入3%牛血清白蛋白(BSA)室温下封闭1 h;后直接以兔抗小鼠Iba-1单抗1∶500,兔抗小鼠MMP-9单抗1∶200,4℃孵育过夜;磷酸盐缓冲液(PBS)洗3次,每次5 min;切片入1∶200生物素标记的二抗(5%BSA稀释)2 h;PBS洗3次,每次5 min;辣根过氧化物酶(HRP)-生物素偶联的三抗室温孵育1 h;二氨基联苯胺(DAB)显色,显微镜下控制显色时间;苏木素复染;脱水封片。以上所有试剂除一抗外均购自北京中山生物制剂有限公司。各实验组每份标本在光镜下随机采集目标区域5个视野,计算阳性细胞数。所有计量数据由2名非实验人员按照双盲原则进行检测。
1.5Western blot检测TNF-α液压打击后第3天,10%水合氯醛麻醉小鼠取脑,加入1 mL裂解液,组织粉碎,匀浆;离心,取上清液,采用二奎林甲酸(BCA)法测定蛋白浓度并定量;经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)并转膜;5%脱脂奶粉封闭2 h;将膜与1∶1 000稀释的TNF-α、β-actin,抗体4℃孵育过夜,室温下与相应二抗孵育2 h,增强型化学发光试剂(ECL)显示。以β-actin为内参对照,结果以TNF-α/β-actin的吸光度比值表示。
1.6统计学方法应用SPSS 16.0统计软件分析,数据以均数±标准差(x±s)表示,两组样本比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1创伤灶周围小胶质细胞计数结果液压打击后第1、3、7天免疫组织化学显示阿托伐他汀组小鼠创伤灶周围小胶质细胞特异性标志物Iba-1阳性表达量与生理盐水组比较显著减少(P<0.05),见图1。
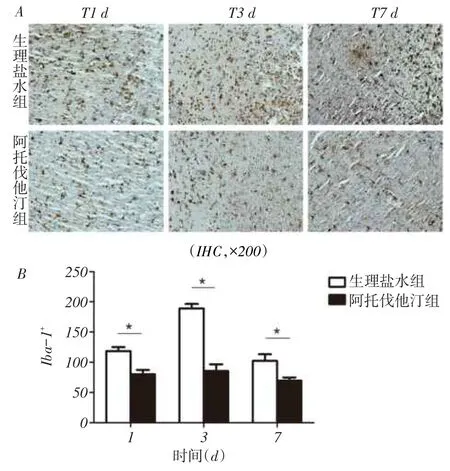
Fig.1 Comparison of the positive cells of Iba-1at different time points between two groups图1 小鼠TBI后创伤灶周围Iba-1阳性表达量比较
2.2MMP-9检测结果外伤后第3天阿托伐他汀组小鼠MMP-9阳性表达量较生理盐水组小鼠显著减少(86.80±8.40 vs.133.80±8.46,t=8.807,P<0.05),见图2。

Fig.2 The MMP-9 expression at the 3rd day after TBI between two groups(IHC,×200)图2 小鼠TBI后第3天创伤灶周围MMP-9的表达量(IHC,×200)
2.3TNF-α检测结果外伤后第3天阿托伐他汀组小鼠TNF-α与生理盐水组相比降低明显(0.64± 0.01 vs.0.97±0.02,t=8.701,P<0.05),见图3。
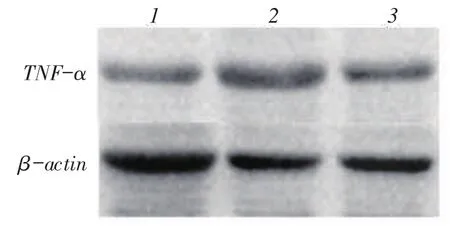
Fig.3 Results of Western blot assay for TNF-α/β-actin at the 3rd day after TBI图3 TBI后第3天Western blot检测TNF-α结果
3 讨论
TBI分为原发性和继发性脑损伤,TBI后的免疫炎症反应所致的BBB继发性损伤是继发性脑损伤发生的关键。原发性脑损伤发生于TBI后的瞬间,治疗干预困难。继发性脑损伤的发生发展过程相对较长,是临床救治的重点[1-2,5]。小胶质细胞在中枢神经系统分布较广,约占胶质细胞的10%~20%。TBI后,小胶质细胞被激活,其分泌的炎症介质TNF-α、白细胞介素(IL)-1等是促进继发性脑损伤发生的关键因素[3]。MMPs是一组同源的以无活性酶原形式分泌的锌依赖性中性蛋白酶,在正常脑组织中发挥重要的作用,比如神经发生、鞘磷脂形成、轴突生长等,而在脑外伤早期的病理发展中有损伤作用[6-7]。小胶质细胞激活后可以促进MMPs表达,对局部多巴胺能神经元膜的结构和功能产生损害,使多巴胺能神经元变性、坏死[8-10]。
他汀类药物作为HMG-CoA抑制剂是最重要的降脂药物之一,广泛用于心脑血管疾病中抗动脉粥样硬化的治疗[11-12]。近年大量研究发现其除降脂作用外,还包括抗炎、免疫调节、抗氧化等,因而在治疗免疫介导的疾病如多发性硬化、器官移植排斥等方面具有令人瞩目的应用前景。本课题组近年来研究已经证实阿托伐他汀对脑外伤模型的小鼠具有抗炎作用[13-14],但对究竟如何起到抗炎作用仍未知。
本研究观察到小鼠TBI后给予阿托伐他汀可以减少创伤灶周围的小胶质细胞激活,降低TNF-α和MMP-9,证实阿托伐他汀对于TBI后小胶质细胞具有抑制激活的作用,从而影响其参与的神经疾病免疫反应,这可能是阿托伐他汀在TBI中抗炎的机制之一。但阿托伐他汀究竟是如何影响小胶质细胞激活,对于小胶质细胞激活极化是否有影响仍待进一步研究。
参考文献
[1]Cope EC,Morris DR,Levenson CW.Improving treatments and outcomes:an emergingrole for zinc in traumatic brain injury[J].Nutr Rev,2012,70(7):410-413.doi:10.1111/j.1753-4887.2012.00486.x.
[2]Thurman DJ,Alverson C,Dunn KA,et al.Traumatic brain injury in the United States:A public health perspective[J].J Head Trauma Rehabil,1999,14(6):602-615.
[3]Loane DJ,Byrnes KR.Role of microglia in neurotrauma[J].Neurotherapeutics,2010,7(4):366-377.doi:10.1016/j.nurt.2010.07.002.
[4]McIntosh TK,Vink R,Noble L,et al.Traumatic brain injury in the rat:characterization of a lateral fluid-percussion model[J].Neuroscience,1989,28(1):233-244.
[5]Blennow K,Hardy J,Zetterberg H.The neuropathology and neurobiology of traumatic brain injury[J].Neuron,2012,76(5):886-899.doi:10.1016/j.neuron.2012.11.021.
[6]Reinhard SM,Razak K,Ethell IM.A delicate balance:role of MMP-9 in brain development and pathophysiology of neurodevelopmental disorders[J].Front Cell Neurosci,2015,9:280.doi:10.3389/fncel.2015.00280.eCollection 2015.
[7]Egashira Y,Zhao H,Hua Y,et al.White Matter Injury After Subarachnoid Hemorrhage:Role of Blood-Brain Barrier Disruption and Matrix Metalloproteinase-9[J].Stroke,2015,46(10):2909-2915.doi:10.1161/STROKEAHA.115.010351.
[8]Mun-Bryce S,Lukes A,Wallace J,et al.Stromelysin-1 and gelatinase A are upregulated before TNF-alpha in LPS-stimulated neuroinflammation[J].Brain Res,2002,933(1):42-49.
[9]Rosenberg GA,Cunningham LA,Wallace J,et al.Immunohistochemistry of matrix metalloproteinases in reperfusion injury to rat brain:activation of MMP-9 linked to stromelysin-1 and microglia in cell cultures[J].Brain Res,2001,893(1/2):104-112.
[10]del Zoppo GJ,Milner R,Mabuchi T,et al.Microglial activation and matrix protease generation duringfocal cerebral ischemia[J].Stroke,2007,38(2 Suppl):646-651.
[11]Zhu FQ,Chen L,Zhu JH.Influence of berberine combining with atorvastatin on serum high-sensitivity C-reactive protein and adipocyte fatty acid-binding protein in patients with acute ischemic stroke[J].Chin J Contemp Neurol Neurosurg,2015,15(1):43-47.[朱飞奇,陈略,朱瑾华.黄连素联合阿托伐他汀对急性缺血性卒中患者血清超敏C-反应蛋白和脂肪细胞型脂肪酸结合蛋白水平的影响[J].中国现代神经疾病杂志,2015,15(1):43-47]. doi:10.3969/j.issn.1672-6731.2015.01.010.
[12]Zheng XD,Li XQ,Zhang JH,et al.Preliminary study on the efficacy and safety of atorvastatin in northern Han patients with acute ischemic cerebrovascular disease[J].Med J Chin PLA,2015,40(7):519-525.[郑雪丹,李晓秋,张景华,等.阿托伐他汀对北方汉族人群急性缺血性脑血管病有效性和安全性的初步研究[J].解放军医学杂志,2015,40(7):519-525].doi:10.11855/j.issn.0577-7402.2015.07.02.
[13]Li T,WangD,Tian Y,et al.Effects of atorvastatin on the inflammation regulation and elimination of subdural hematoma in rats[J].J Neurol Sci,2014,341(1/2):88-96.doi:10.1016/j.jns.2014.04.009.
[14]Jin WP,Wang B,Zhao ZL,et al.Effects of atorvastatin on endothelial progenitor cells and neural function in rats with traumatic brain injury[J].Tianjin Med J,2013,41(5):465-467.[金卫篷,王彬,赵子龙,等.阿托伐他汀对颅脑损伤大鼠内皮祖细胞和神经功能的影响[J].天津医药,2013,41(5):465-467].
(2015-11-01收稿2015-11-30修回)
(本文编辑魏杰)
Effects of atorvastatin on the microglia activation after traumatic brain injury
YU Gongjie1,SUN Dongdong1,ZENG Yong1,GAO Weiwei1,CHEN Siqin2,ZHANG Jianning1
1 Department of Neurosurgery,Tianjin Medical University General Hospital,Tianjin Neurological Institute,Tianjin 300052,China;2 Research Center of Basic Medical Sciences,Tianjin Medical University Corresponding AuthorE-mail:jianningzhang@hotmail.com
Abstract:ObjectiveTo observe the effects of atorvastatin on the microglia activation after traumatic brain injury (TBI).MethodsSixty adult male C57/BL6 mice were randomly divided into sham group,atorvastatin group and saline group,20 mice for each group.The atorvastatin group and saline group were given hydraulic combat to establish TBI mouse model.The shame group underwent the same surgical procedure without being exposed to percussion injury.The atorvastatin group was treated with atorvastatin(orally,1 mg/kg)1 h after TBI and for 7 consecutive days.The saline group was given saline orally.The expression of microglia(Iba-1+)at the 1st,3rd,and 7th day after TBI and matrix metalloproteinase-9(MMP-9)around the lesion at the 3rd day after TBI were detected by immunohistochemical staining.Tumor necrosis factor(TNF)-α was detected by Western blot assay at the 3rd day after TBI.ResultsThe positive expression of Iba-1+microgliawas significantly decreased in atorvastatin group than that of saline group at the 1st,3rd,and 7th day after TBI(80.00±7.44 vs.118.40± 6.65,85.60±10.87 vs.189.00±7.51,69.40±5.54 vs.102.40±10.89,P<0.05).The positive expression of MMP-9 was significantly decreased in atorvastatin group compared with that of saline group at the 3rd day after TBI(86.80±8.40 vs.133.80± 8.46,P<0.05).Results of Western blot assay showed that the positive expression of TNF-α was significantly decreased in astorvastatin group than that of saline group at the 3rd day after TBI(0.64±0.01 vs.0.97±0.02,P<0.05).ConclusionAtorvastatin can reduce inflammation factor by influencingthe microgliaactivation after TBI in mice.
Key words:craniocerebral trauma;microglia;matrix metalloproteinase 9;tumor necrosis factor-alpha;Atorvastatin
中图分类号:R651.1+5
文献标志码:A
DOI:10.11958/20150279
基金项目:国家自然科学基金面上项目(81271361);国家自然科学基金重点项目(81330029)
作者单位:1天津医科大学总医院神经外科,天津市神经病学研究所(邮编300052);2天津医科大学基础医学研究中心转化肿瘤实验室
作者简介:郁龚杰(1989),男,硕士在读,主要从事颅脑外伤的研究
通讯作者E-mail:jianningzhang@hotmail.com
