继代次数对吉粳88愈伤组织生理生化指标及细胞形态的影响
2016-07-10都晓龙孙春玉张美萍王义
都晓龙 孙春玉 张美萍 王义

摘要[目的]研究继代次数对吉粳88愈伤组织生理生化指标及细胞形态的影响。[方法]以继代次数为单因素变量,测定吉粳88愈伤组织中可溶性蛋白含量、过氧化物酶活性、可溶性糖含量以及丙二醛含量,并通过临时装片观察细胞形态。[结果]随着继代次数的增加,愈伤组织的分化率和再生率呈下降趋势;可溶性蛋白含量基本保持在2.92 mg/gFW左右,无明显变化。MDA含量呈先增加后减少的趋势。POD活性和可溶性糖含量与愈伤分化率极显著相关。细胞形态观察发现,随着继代次数增加愈伤组织逐渐由胚性愈伤转化为非胚性愈伤。[结论]在悬浮培养体系建立时,以D4、D5、D6 3代为宜,为吉粳88再生体系的建立和优化指明了方向。
关键词 吉粳88;继代次数;生理生化指标;细胞形态;再生
中图分类号 S188 文献标识码 A 文章编号 0517-6611(2016)05-155-04
Abstract[Objective]The aim was to study effects of transgenerational times on Jijing88 callus physiobiochemistry indexes and the cell morphology.[Method]With transgenerational times as single factor variables, the callus of Jijing88 was researched through observing cell morphology with four physiobiochemistry indexes including peroxidase (POD) activity, soluble protein content, soluble sugar content and malondialdehyde (MDA) content.[Result]With the increase of transgenerational times, the results showed a sharp decline in callus differentiation rate and regenerative rate; soluble protein level maintained at about 2.92 mg/gFW. The malondialdehyde (MDA) content showed a trend of rise first then fall. Peroxidase (pod) activity and soluble sugar content was significantly correlated with callus differentiation rate. Cell morphology was observed that cells change from embryonic callus into non embryonic callus with transgenerational times increase gradually.[Conclusion]When the suspension culture system is established, three generations of D4, D5, D6 are appropriate, which will provide the direction for establishment and optimization of Jijing88 regeneration system.
Key words Jijing88; Transgenerational times; Physiobiochemistry indexes; Cell morphology; Regeneration
吉粳88为吉林省广泛栽培品种[1],其米质优良,外观品质好且食味佳,具有茎秆粗壮、抗倒伏、根系发达和耐冷性强等优良农艺性状。优化该品种的再生体系,明确其再生机制,对于优化种质资源、开发新型高产超级稻具有重要意义。研究发现,随着继代次数的增加大多数植物愈伤组织的分化率呈下降趋势[2],在水稻继代过程中该现象尤其明显。很多植物材料随着继代次数的增加繁殖能力逐渐衰退,增殖系数和生根率下降,如梨 S系矮化砧[3]、 叶毛枣[4]、 杉木[5]、 棉花[6]和球根海棠[7]等。崔德才等[8]研究表明,继代20次的培养材料(含愈伤组织),其再生能力下降70%~80%。不同植株之间保持分化潜力的时间不同,且差异很大。王慧中等[9]研究表明,籼稻愈伤组织的分化率在5次继代后由初始的63.4%下降至18.6%。
在某些特定条件下,愈伤组织需要保持长期继代且保证愈伤组织胚性不丧失。迄今为止虽然已有大量研究表明继代与再生之间存在某些关联,但并未完全明确其影响机制。这对长期继代保持愈伤组织胚性研究以及优化再生体系的方向形成了阻碍。笔者以继代次数为单因素变量,分析了继代次数对吉粳88愈伤组织生理生化指标及细胞形态的影响,并弄清各个生理生化指标与水稻再生之间的关系,探寻改善水稻再生体系的方向和方法。
1 材料与方法
1.1 材料
供试材料为吉粳88水稻种子在N6培养基、2,4D 2 mg/L、26 ℃暗培养条件下诱导的愈伤组织,以14 d为一个周期进行继代,诱导代标记为D1,继代一次标记为D2,依次类推。
1.2 方法
1.2.1 生理生化指标测定。
①可溶性蛋白。用牛血清蛋白配成含蛋白质0.1 mg/mL的标准蛋白溶液,用以测定标准曲线。取各代愈伤组织样品0.5 g,采用考马斯亮蓝G250染色法,在595 nm下比色。重复3次,取平均值[10]。
②过氧化物酶(POD)活性。称取5 g各代愈伤组织样品,采用愈创木酚法在470 nm处比色测定POD活性。重复3次,取平均值[11-12]。
③可溶性糖含量。配制含葡萄糖0.1 mg/mL的标准葡萄糖溶液,用以测定标准曲线。取0.3 g各代愈伤组织样品,采用蒽酮法,在620 nm下测定吸光度。重复3次,取平均值[9-10]。
④丙二醛(MDA)含量。称取各代愈伤组织样品1 g,采用硫代巴比妥酸(TBA)法,测定532、600、450 nm处的吸光度。重复3次,取平均值[13-14]。
1.2.2 细胞形态观察。
取各代愈伤组织一小块,在载玻片上捣碎,固绿染色制成临时装片观察细胞结构[15]。
1.2.3 各代愈伤组织再生统计。
以MS为基本培养基,激素浓度为1 mg/L 6BA、1 mg/L KT和0.2 mg/L NAA。采用滤纸干燥法对愈伤组织进行干燥处理48 h,在22 ℃连续光照条件下培养30 d后统计分化率和再生率,重复3次,取平均值[16]。
2 结果与分析
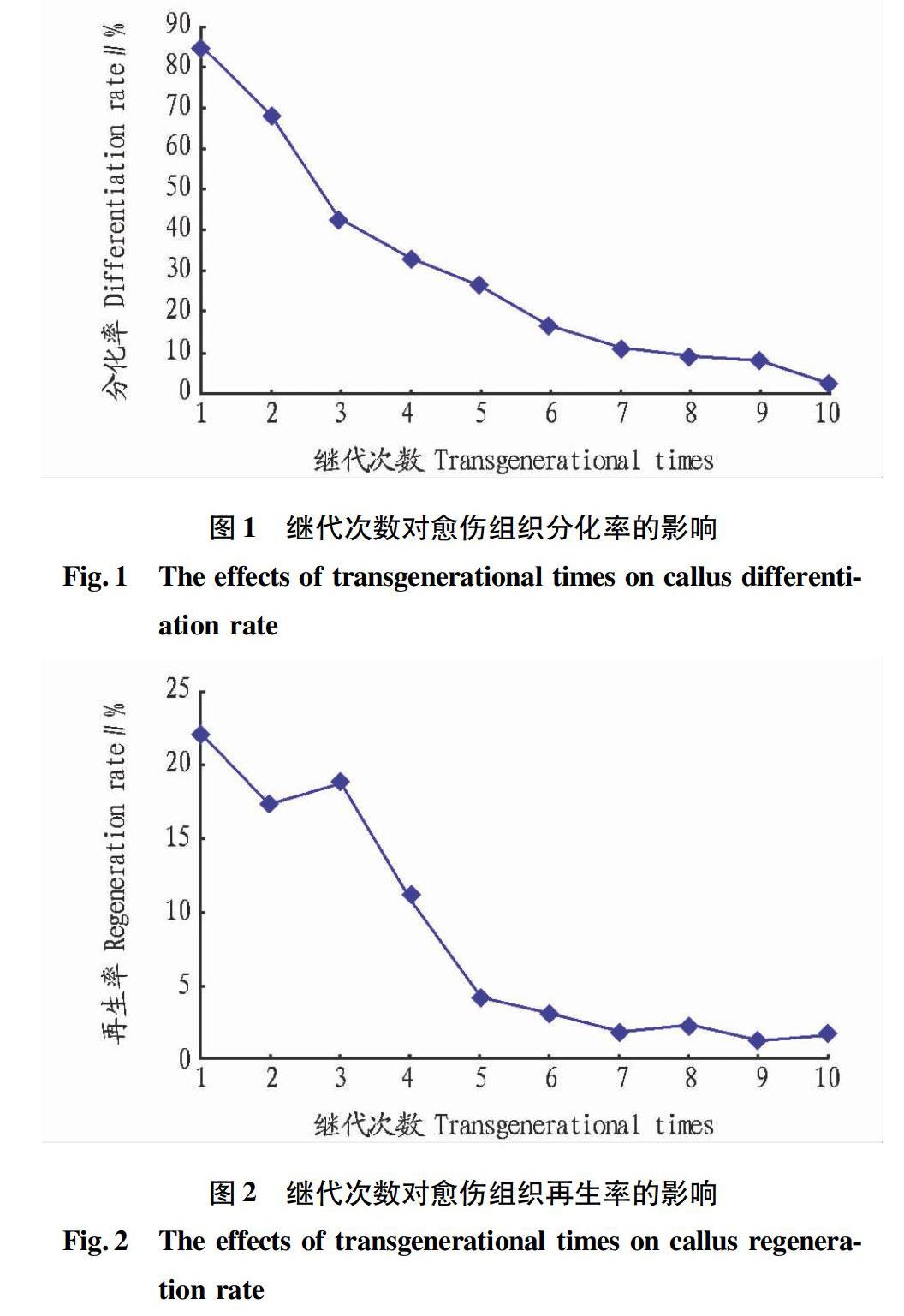
2.1 继代次数对愈伤组织再生能力的影响 由图1和2可知,随着水稻愈伤组织继代次数的增加,愈伤组织的分化率和再生率均呈明显下降趋势。分化率由D1代的85.3%下降到D10代的2.6%;再生率D1代最大(为22.30%),随着继代次数的增加,D9代再生率最低(为1.25%)。由此可知,未继代前(D1代)的水稻愈伤组织为最适再生水稻植株材料。
2.2 继代次数对愈伤组织可溶性蛋白含量的影响
由图3可知,继代次数对水稻愈伤组织可溶性蛋白含量几乎无影响,其含量保持在2.92 mg/gFW左右。但未继代前愈伤组织(D1)可溶性蛋白含量高于其他代,结合随着继代次数增加胚性下降的现象,推测可能有分化再生相关关键基因表达下调的现象发生。
2.3 继代次数对愈伤组织POD活性的影响
由图4可知,POD活性随着继代次数增加呈先增加后减少的趋势,D1代POD活性最低为166.96 U/(g·min),D5代POD活性最高为173.94 U/(g·min)。由此可知,愈伤组织随着继代次数增加有逐渐老化的趋势。
2.4 继代次数对愈伤组织可溶性糖含量的影响
由图5可知,随着水稻愈伤组织继代次数的增加,愈伤组织中可溶性糖含量呈减少趋势,由D1代10.24 mg/gFW减少到D10代5.97 mg/gFW,愈伤组织中可溶性糖含量减少41.7%。与随着继代次数增加水稻愈伤组织胚性降低的现象呈正相关。说明愈伤组织中可溶性糖含量是影响愈伤组织分化再生的关键因素。
2.5 继代次数对愈伤组织MDA含量的影响
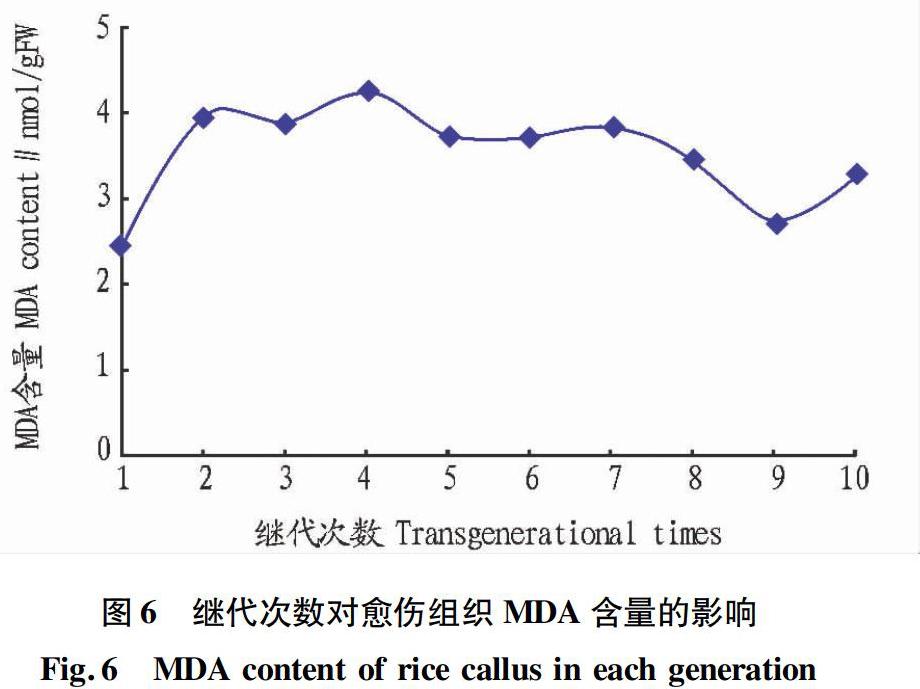
由图6可知,随着水稻愈伤组织继代次数的增加,MDA含量呈先增加后减少的趋势,D1代最低为2.42 nmol/gFW,表示此时组织细胞老化程度最低。D4代愈伤组织MDA含量最高为4.24 nmol/gFW,表明此时膜损伤最为严重、老化程度最高。
2.6 继代次数对愈伤组织细胞形态的影响
由图7可知,随着继代次数的增加,愈伤组织细胞形态结构发生明显变化。D1代愈伤组织细胞结构紧密,细胞较小,大多为圆形,内容物丰富,液泡较小,排列较整齐。D3代细胞结构开始变得疏松,较易形成小的细胞团。D5代细胞组织变得极为疏松,较易形成大量单细胞悬浮液和小细胞团,细胞开始发生变形,出现畸形细胞。D7代愈伤组织出现大量畸形细胞,胚性几乎丧失。D10代细胞几乎为畸形细胞和巨大细胞。由此可知,随着继代次数的增加,愈伤组织逐渐变得结构疏松,细胞相对巨大,内含一大液泡,几乎无细胞器,畸形细胞明显增加。这表明愈伤组织中的细胞逐渐由胚性愈伤组织转化为非胚性愈伤组织。
2.7 相关性分析
相关性分析表明,POD活性与愈伤组织分化率呈负相关关系,达0.005极显著水平。可溶性糖含量与分化率呈正相关,达0.001极显著水平。说明这2个因素在水稻愈伤分化过程中起着至关重要的作用,在再生体系建立过程中优化这2个条件对于建立高效的愈伤组织再生体系可以得到较好的预期效果。
3 结论与讨论
研究发现,愈伤组织中可溶性蛋白含量对植物体胚发生
途径具有重要影响[17-20],胚性愈伤组织的分化和发育是一个极其复杂的过程,它受到基因的调控,是基因顺序表达的结果[21]。但在该试验中,继代次数对愈伤组织中可溶性蛋白含量几乎无影响,基本保持在2.92 mg/gFW左右,但未继代前愈伤组织可溶性蛋白含量明显高于其他代,表明随着继代次数增加,愈伤组织中一些基因表达下调。而其蛋白含量相似可能是由于同处于未分化状态细胞内基因表达差异不明显。
该研究表明水稻愈伤组织中POD活性随着继代次数增加呈先增加后减少的趋势,表明在该过程中,组织内部过氧化物积累增加,细胞老化程度相应上升。
该试验中,可溶性糖含量随着继代次数增加持续下降,与随着继代次数增加胚性逐渐丧失现象呈正相关且达极显著水平。可以判断可溶性糖是水稻分化再生的关键因素之一。已有研究证实,以麦芽糖和乳糖为碳源,培养35个月的粳稻愈伤组织绿苗率仅达2%~4%,而蔗糖对照则无再生能力[22]。水稻胚乳中的淀粉在萌发过程中主要水解产物为麦芽糖,在生长过程中主要利用的是蔗糖,由于麦芽糖的消耗和蔗糖的大量加入,导致愈伤组织内部可溶性糖组成发生改变,这也可能是水稻愈伤组织形成初期分化再生率较高,而后期逐渐失去胚性的原因。
该研究表明,随着继代次数的增加,愈伤组织细胞中MDA含量呈先增加后减少的趋势,表明愈伤组织细胞在继代过程中发生了一定程度的老化和膜脂结构的损坏。在其他试验过程中应尽量挑选MDA含量较低的愈伤组织,提高细胞活性和抗逆性。
临时装片是组织学和发育生物学研究中观察细胞形态结构的试验方法之一,该试验中使用水装片法观察细胞形态结构,利用固绿染液对吉粳88水装片进行染色后,在显微镜下观察。结果表明,随着继代次数的增加,愈伤组织形态结构发生了明显变化。其表现为组织结构愈发松散,内容物变少,畸形细胞大量增加,液泡化逐渐加剧。这证明随着培养时间的增加,愈伤组织变异加剧,逐渐由胚性愈伤向非胚性愈伤转化。这也是愈伤组织胚性丧失的表现。
该研究从生理生化及细胞形态两方面研究了继代次数对吉粳88愈伤组织的影响,探究影响水稻愈伤组织分化再生的因素以及筛选适合继代次数的愈伤组织。表明可溶性糖和POD活性是影响水稻体胚发生途径的关键因素,但无法确定影响该途径的可溶性糖类型,以及控制调节该过程的基因,这些问题有待进一步研究。
参考文献
[1]张三元,张俊国,赵劲松,等.水稻吉粳88号品种简介[J].吉林农业,2005(5):26-28.
[2]LAI K L,LIU L F.International congress of plant tissue and cell culture[C].Univ Minnesota Minneapolis,Minn USA Abstrcts,1986:186.
[3]及华,张海新,赵玉芬,等.梨S系矮化砧组培苗增殖系数和质量的影响因子[J].河北农业科学,2004,8(2):40-44.
[4]续九如,李春立,孙建设.毛叶枣组培快繁技术研究[J].北京林业大学学报,2003,25(3):28-32.
[5]苏秀城.杉木无性系不同继代代数组培苗差异研究[J].福建林学院学报,2000,20(4):353-356.
[6]薛美凤,郭余龙,李名扬,等.长期继代对棉花胚性愈伤组织体胚发生能力及再生植株变异的影响[J].西南农业学报,2002,15(4):19-21.
[7]刘福平,林清洪,章宁.球根海棠继代愈伤组织分化潜力丧失研究(简报)[J].亚热带植物科学,2003,32(4):64.
[8]崔德才,徐培文.植物组织培养与工厂化育苗[M].北京:化学工业出版社,2003:71.
[9]王慧中,周晓云,赵培洁,等.影响籼稻愈伤组织分化频率的几个因素[J].浙江工业大学学报,2000(3):240-242.
[10]张龙翔,张庭芳,李令媛.生化实验方法和技术[M].北京:高等教育出版社,1997.
[11]MALIK V B T,AHLUWALIA P.Studies on effect of monosodium glutamate(MSG)on various fractions of lipids and certain carbohydrate met abolic enzymes in liver and blood of adult male mice[J].Toxicology letters,1994,74(1):69-77.
[12]岳鹏程.过用抗菌药物与中医伤津伤阳现象[J].中国民族民间医药,2009,18(9):26.
[13]李合生.现代植物生理学[M].北京:高等教育出版社,2000.
[14]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:232.
[15]赵荧,唐军民.形态学实验技术[M].北京:大学医学出版社,2008:9-114.
[16]李楠,柳青,蒋世翠,等.超级稻吉粳88再生体系的建立[J].作物杂志,2010(2):71-75.
[17]李茜,张存旭,秦萍.白皮松胚性和非胚性愈伤组织生理生化特性研究[J].西北农林科技大学学报(自然科学版),2008,36(8):151-160.
[18]崔凯荣,王晓哲,陈雄,等.小麦体细胞胚发生中DNA、RNA和蛋白质的合成动态[J].核农学报,1997,11(4):209-214.
[19]杨和平,程井辰,周吉源,等.石刁柏体细胞胚胎发生过程中蛋白质及同工酶变化的研究[J].实验生物学报,1992,25(1):16-22.
[20]FUJIMIRA T,KOMMIE A,MATSIOMO H.Aspects of DNA,RNA and protein synthesis during somatic embryogenesis in the carrot cell suspension culture[J].Plant Physiol,1980,49:255-260.
[21]杨和平,程井辰,周吉源,等.石刁柏体细胞胚胎发生过程中蛋白质及同工酶变化的研究[J].实验生物学报,1992,25(1):16-22.
[22]ASANO Y,ITO Y,OHARA M,et al.Improved regeneration response of creeping bentgrass and japonica rice by maltose and lactose[J].Plant cell,tissue and organ culture,1994,39(1):101-103.
