外源性硫化氢对三硝基苯磺酸诱导的大鼠肠壁纤维化的影响
2016-07-10伏桂香陈尼维赵祥运范慧宁
伏桂香, 陈尼维, 赵祥运, 范慧宁
(上海交通大学附属第六人民医院消化内科,上海 200233)
外源性硫化氢对三硝基苯磺酸诱导的大鼠肠壁纤维化的影响
伏桂香, 陈尼维, 赵祥运, 范慧宁
(上海交通大学附属第六人民医院消化内科,上海 200233)
目的 探讨外源性硫化氢对三硝基苯磺酸(trinitrobenzene-sulfonic acid, TNBS)诱导的大鼠慢性结肠炎肠壁纤维化的影响。方法 健康雌性SD大鼠60只,随机分为乙醇对照组、模型组、低剂量硫氢化钠(NaHS)组、高剂量NaHS组(15只/组),后三组建立TNBS诱导的慢性结肠炎肠壁纤维化模型。实验第3周开始,低剂量NaHS组、高剂量NaHS组分别给予腹腔注射H2S供体NaHS[14.4μmol/(kg·d)或36.0μmol/(kg·d)],对照组和模型组予同等体积的生理盐水腹腔注射,实验期间观察各组大鼠每日的一般情况,第35天处死全部大鼠,采用去蛋白法测血清中的H2S含量,分离结肠行大体形态学评分、组织学评分、计算胶原面积百分比,RT-PCR法测定胱硫醚-β-合酶(CBS)mRNA,ELISA法测COLIα2、COLⅢ、TGF-β1、TNF-α。结果 NaHS组H2S含量、CBSmRNA高于模型组,高剂量NaHS组高于低剂量NaHS组;NaHS组大体形态学评分、组织学评分、胶原面积百分比、COLIα2、COLⅢ、TGF-β1、TNF-α低于模型组,高剂量NaHS组低于低剂量NaHS组,差异均有统计学意义(P<0.05)。结论 在TNBS诱导的大鼠慢性结肠炎肠壁纤维化模型中,外源性硫化氢可以使结肠组织CBSmRNA表达增加,同时具有抗炎、抑制肠壁纤维化的作用,且与剂量呈正相关。
硫化氢; 慢性结肠炎; 肠壁纤维化; 大鼠
近年来,研究发现硫化氢(H2S)参与了体内多种生理和病理生理过程,是继NO和CO之后的第三种气态信号分子,广泛存在于神经、心血管、泌尿、呼吸、消化等系统。H2S易溶于水,在体内主要以HS-形式存在,可以通过单纯扩散的方式穿过细胞膜。H2S具有抗炎、抗纤维化的作用,在肝、肾、肺的组织纤维化中起重要作用,可以预防、缓解组织纤维化的发生。炎症性肠病近年来的发病率有明显上升趋势,肠壁纤维化是其常见并发症,易导致肠腔狭窄、肠梗阻或瘘,影响肠道功能。本研究通过多次TNBS灌肠诱导大鼠慢性结肠炎肠壁纤维化模型,反复腹腔注射不同剂量的H2S供体NaHS进行干预,探讨外源性H2S在肠壁纤维化中的影响。
1 材料与方法
1.1 实验动物
健康雌性SD大鼠60只,7~8周龄,体质量(200±20)g,由上海交通大学附属第六人民医院实验动物中心提供,饲养于SPF级环境中,适应性饲养3d,自由取食和饮水,明暗交替12h∶12h。随机分为乙醇对照组、模型组、低剂量NaHS组、高剂量NaHS组,每组15只。
1.2 主要试剂
NaHS、TNBS、醋酸锌、对苯二胺盐酸盐、三氯化铁、三氯乙酸、氢硫酸、反转录试剂盒、PCR试剂盒购自美国Sigma公司,COLIα2、COLⅢ、TGF-β1、TNF-αELISA试剂盒购自杭州优尔生物科技有限公司,SYBR Green qPCR SuperMix购自美国Invitrogen公司,PCR引物由上海贵基医药科技有限公司设计、合成。引物序列如下。CBS上游引物: 5′-GCCATTGACCTGCTAAACTT-3′,下游引物: 5′-GCTACTCGGACATAGAGGAT-3′;β-actin上游引物: 5′-AGGGAAATCGTGCGTGACAT-3′,下游引物: 5′-GAACCGCTCATTGCCGATAG-3′。
1.3 方法
1.3.1 动物造模和干预 禁食不禁饮24h后,腹腔注射戊巴比妥钠麻醉,模型组和NaHS组分别于实验周期的第1、8、15、22、29天将直径2mm的硅胶管从肛门插入大鼠肠道约8cm,分别给予10、15、20、25、30mg TNBS+50%乙醇混合液1ml灌肠,乙醇对照组给予同体积50%乙醇灌肠,将大鼠倒置1min。NaHS组于第15天开始分别给予腹腔注射NaHS溶液,剂量分别为: 14.4μmol/kg、36.0μmol/kg,每日1次[1],乙醇对照组和模型组予同等体积的生理盐水腹腔注射。实验动物于第35天全部处死。
1.3.2 结肠炎症及纤维化评估 观察各组大鼠每日的活动、进食、大便形状、体质量的变化。分离全结肠,参照Butzner等[2]的方法行大体形态学评分。取距肛门3cm处结肠组织,10%甲醛溶液固定,常规石蜡包埋,连续切片,H-E染色[3]。进行组织学评分,并行Masson染色,数字成像,随机选取5个互不重叠的视野,利用图像分析软件计算蓝染区占整个切片总面积的百分比,取其平均值。
1.3.3 结肠COLIα2、COLⅢ、TGF-β1、TNF-α含量的测定 取病变结肠组织制备组织匀浆,4℃,离心半径16cm 14000r/min,离心15min,收集上清液,参照ELISA试剂盒说明书进行操作,根据标准曲线分别计算COLIα2、COLⅢ、TGF-β1、TNF-α含量。
1.3.4 结肠CBSmRNA表达的测定 制备病变结肠组织匀浆,提取总mRNA,反转录合成cDNA,行Real-Time PCR。反转录反应体系: RNA样本1μg,H2O 12μl,Oligo dT 0.5μl,反转录引物0.5μl,dNTPs 2.0μl,RNase抑制剂0.5μl,5×反转录缓冲液4μl,反转录酶MMLV 0.5μl,总体积20μl;反应条件: 30℃ 10min,42℃ 60min,85℃ 10min,灭活MMLV。RT-PCR反应体系: cDNA(1∶20)5.0μl,上游引物0.5μl,下游引物0.5μl,2×SYBR Green qPCR Super mix 10μl,dH2O 4.0μl,总体积20μl;反应条件: 50℃ 2min;95℃ 2min;95℃ 15s,60℃ 32s,40个循环。
1.3.5 血浆H2S含量的测定 处死大鼠前于心脏穿刺采血0.5~1ml注入含肝素抗凝的密封真空采血管中,静置2h,离心半径16cm,3000r/min,低温离心10min,分离血浆,采用去蛋白法测定H2S含量。在试管中加入醋酸锌0.5ml(10g/L),0.1ml血浆标本,振荡均匀,加入0.5ml对苯二铵盐酸盐(20mmol/L)以及0.4ml三氯化铁(30mmol/L),在室温下放置约20min,再加入1ml三氯乙酸(100g/L),去离子水定容至2.5ml,充分混匀,离心半径16cm,12000r/min,离心5min,吸取上清液,使用分光光度计在670nm处测定吸光度值(D670)。根据H2S标准曲线计算出H2S水平。
1.4 统计学处理
2 结 果
2.1 结肠炎症程度
模型组、NaHS组大鼠在第1次TNBS造模当天即出现稀便,且便中有时带血丝,少动,好睡,精神不佳,食量明显减少,体质量减轻,且症状会一直持续到第2次给药前。第2次给药后,症状会有所加重,但恢复比第1次给药快。与前2次比较,第3、4、5次灌肠症状较轻,恢复较快。乙醇对照组大鼠也出现上述症状,但较之症状轻,恢复快。灌肠后第2~ 3天症状最为严重,以后逐渐缓解。乙醇对照组、模型组、低剂量NaHS组、高剂量NaHS组各死亡2、5、3、3只大鼠。
实验第35天处死全部大鼠,分离全结肠。模型组大鼠盲肠明显膨大,直肠充血、易断、厚薄不均,可见明显的血块,且与周围组织粘连。NaHS组比模型组病变轻,但同样存在易断、粘连、充血等。乙醇对照组以上现象不明显。行大体形态学评分,模型组显著高于乙醇对照组、NaHS组,高剂量NaHS组低于低剂量NaHS组,差异均有统计学意义(P<0.05),见表1。
2.2 组织病理学评分和胶原面积评估
光学显微镜下,模型组结肠组织全层可见炎症细胞浸润,纤维结缔组织增生明显。NaHS组组织病理评分显著低于模型组,高剂量NaHS组明显低于低剂量组。模型组、NaHS组行Masson染色可见黏膜层、黏膜下层、肌层均有胶原蛋白沉积,黏膜下层尤为明显。模型组胶原沉积最为严重,肠壁全层均见累及。分析显示,模型组胶原面积显著高于其余各组,高剂量NaHS组低于低剂量NaHS组,差异均有统计学意义(P<0.05),见表1、图1。
表1 各组大体形态学评分、组织学评分和胶原面积百分比的比较
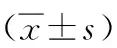
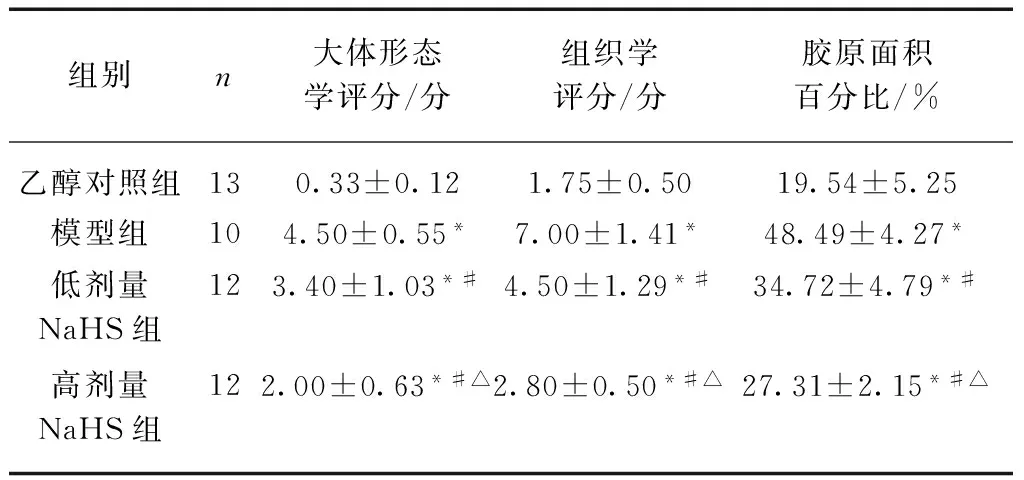
组别n大体形态学评分/分组织学评分/分胶原面积百分比/%乙醇对照组130.33±0.121.75±0.5019.54±5.25模型组104.50±0.55*7.00±1.41*48.49±4.27*低剂量NaHS组123.40±1.03*#4.50±1.29*#34.72±4.79*#高剂量NaHS组122.00±0.63*#△2.80±0.50*#△27.31±2.15*#△
与对照组比,*P<0.05;与模型组比,#P<0.05;与低剂量NaHS组比,△P<0.05
2.3 结肠组织COLIα2、COLⅢ、TGF-β1、TNF-α含量
模型组、NaHS组COLIα2、COLⅢ、TGF-β1、TNF-α含量显著高于对照组,NaHS组显著低于模型组,高剂量NaHS组低于低剂量NaHS组,各组间差异均有统计学意义(P<0.05),见表2。
2.4 结肠CBSmRNA表达和血浆H2S含量
模型组结肠组织CBSmRNA表达水平及血浆H2S含量显著低于对照组、NaHS组,高剂量NaHS组高于低剂量NaHS组,差别均有统计学意义(P<0.05),见表3。
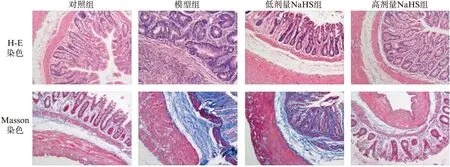
图1 各组大鼠结肠组织H-E染色及Masson染色图片Fig.1 Colonic pathological section of different groups(×100)
表2 组织COLIα2、COLⅢ、TGF-β1、TNF-α含量
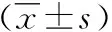
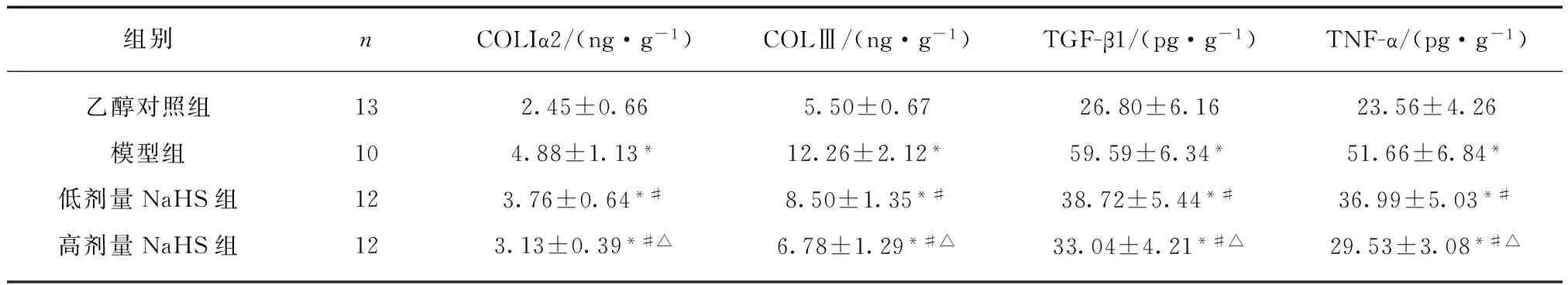
组别nCOLIα2/(ng·g-1)COLⅢ/(ng·g-1)TGF-β1/(pg·g-1)TNF-α/(pg·g-1)乙醇对照组132.45±0.665.50±0.6726.80±6.1623.56±4.26模型组104.88±1.13*12.26±2.12*59.59±6.34*51.66±6.84*低剂量NaHS组123.76±0.64*#8.50±1.35*#38.72±5.44*#36.99±5.03*#高剂量NaHS组123.13±0.39*#△6.78±1.29*#△33.04±4.21*#△29.53±3.08*#△
与对照组比,*P<0.05;与模型组比,#P<0.05;与低剂量NaHS组比,△P<0.05
表3 结肠CBSmRNA表达和血浆H2S含量
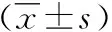

组别nCBSmRNAH2S含量/(μmol·L-1)乙醇对照组1383.49±0.1636.58±6.45模型组1017.45±0.04*10.19±0.29*低剂量NaHS组1227.86±0.07*#15.53±0.68*#高剂量NaHS组1248.52±0.05*#△20.74±2.76*#△
与对照组比,*P<0.05;与模型组比,#P<0.05;与低剂量NaHS组比,△P<0.05
3 讨 论
H2S是近年来发现的一种气态信号分子,在人类和动物体内的循环系统、神经系统、消化系统等发挥着重要的生理及病理作用。在哺乳动物体内,H2S主要有两种来源: 一种是酶依赖途径,即依赖5′- 磷酸吡哆醛的胱硫醚-β-合成酶(CBS)、胱硫 醚-γ-裂解酶(CSE)及非依赖5′-磷酸吡哆醛的3-巯基丙酮酸硫转移酶(3-MST)途径,另一种是由肠道的脱硫细菌产生,前者是内源性H2S的主要来源,后者则是肠腔H2S的主要来源。H2S的氧化代谢主要在肝脏和结肠上皮细胞线粒体内进行,这一过程需要消耗O2,少部分通过排气的方式排出体外。胃肠道黏膜主要以CSE、CBS为主,CSE主要分布于胃、十二指肠、空肠,CBS主要分布于回肠、结肠[4],H2S既可以通过抗炎、促进HCO-3分泌、增加血流发挥黏膜保护作用,又可以通过钾离子通道、钙离子通道等调节胃肠道的蠕动。既往的研究证实内源性H2S与溃疡性结肠炎、急性胰腺炎、肝纤维化等存在相关性,具有抗炎、抗纤维化的作用[5-6]。肠壁纤维化是炎症性肠病的常见并发症,易导致肠腔狭窄,甚至肠梗阻及瘘,需手术干预且复发率较高。本研究结果显示,模型组及NaHS组在症状持续时间、严重程度上均较乙醇对照组严重;模型组的大体形态学评分、组织病理学评分、胶原面积百分比、COLIα2、COLⅢ、TGF-β1、TNF-α含量显著高于乙醇对照组、NaHS组,高剂量NaHS组低于低剂量NaHS组;模型组CBSmRNA表达水平、H2S含量较乙醇对照组、NaHS组显著降低,高剂量NaHS组高于低剂量NaHS组(P<0.05)。可以推断,在TNBS诱导的大鼠肠壁纤维化模型中,外源性H2S可以通过影响TGF-β、TNF-α炎性因子的表达,参与胶原蛋白的合成与降解,发挥其抗炎、抗纤维化的作用,明显改善肠壁纤维化的发生发展。
肠壁纤维化是由于细胞外基质(ECM)的合成与降解失衡,胶原蛋白过度沉积所致。ECM的合成与降解是由基质金属蛋白酶(MMPs)和基质金属蛋白酶抑制剂(TIMPs)共同调控。IL-10、IL-13、IGF-I、TGF-β等炎性因子通过调控细胞内的MMPs和TIMPs的表达影响ECM的产生与降解[7-10]。另外,氧化应激[11]、遗传因素[12]、肠道微生物[13]等也通过各种途径影响ECM的降解,参与肠壁纤维化的发生发展。Schwer等[14]对胰腺星状细胞(PSC)体外培养发现,H2S可以抑制血红素加氧酶-1(HO-1)介导的细胞外信号调节激酶1/2(ERK1/2)表达,抑制PSC的增殖和迁移,从而影响ECM的合成。吴林等[1]发现外源性H2S可以通过减少胶原蛋白的合成,下调凋亡调节蛋白Bcl-2及Bax的表达,延缓甚至逆转肝纤维化的发生。外源性H2S在肝纤维化、肺纤维化、肾间质纤维化模型中具有抗炎、抗纤维化的作用,本研究同样发现外源性H2S在肠壁纤维化中的抗炎、抗纤维化作用,其作用机制可能与调控TGF-β1、TNF-α等炎性因子的表达,直接或间接影响ECM的合成及降解有关。但是外源性H2S在人类慢性结肠炎肠壁纤维化中是否具有保护作用仍需进一步研究证实。
[1] 吴林,郑永平,李秀芬,等.外源性硫化氢对大鼠肝纤维化胶原合成和凋亡调节蛋白Bcl-2及Bax表达的影响[J].中华临床医师杂志: 电子版,2014,8(17): 56-60.
[2] Butzner JD, Parmar R,Bell CJ, et al. Butyrate enema therapy stimulates mucosal repair in experimental colitis in the rat[J] Gut, 1996,38: 68-573.
[3] 王皓,欧阳钦,胡仁伟.三硝基苯磺酸结肠炎动物模型的建立[J].胃肠病学,2001,6(1): 7-10.
[4] Martin GR, McKnight GW, Dicay MS, et al. Hydrogen sulphide synthesis in the rat mouse gastrointestinal tract[J]. Dig Liver Dis, 2010,42: 103-109.
[5] 赵祥运,陈尼维,陈维雄,等.硫化氢与小鼠恶唑酮结肠炎肠黏膜损伤的相关性[J].胃肠病学,2013,18(3): 149-153.
[6] Fan HN, Chen NW, Shen WL, et al. Endogenous hydrogen sulfide is associated with angiotensin II type 1 receptor in a rat model of carbon tetrachloride-induced hepatic fibrosis[J]. Mol Med Rep, 2015,12(3): 3351-3358.
[7] Di Sabatino A, Jackson CL, Pickard KM, et al. Transforming growth factor beta signalling and matrix metalloproteinases in the mucosa overlying Crohn’s disease strictures[J]. Gut, 2009,58(6): 777-789.
[8] Yuan C, Chen WX, Zhu JS, et al. IL-10 treatment is associated with prohibitin expression in the Crohn’s disease intestinal fibrosis mouse model[J]. Mediators Inflamm, 2013,2013: 617145.
[9] Bailey JR, Bland PW, Tarlton JF, et al. IL-13 promotes collagen accumulation in Crohn’s disease fibrosis by down-regulation of fibroblast MMP synthesis: a role for innate lymphoid cells?[J]. PloS One, 2012,7(12): 1-13.
[10] Di Sabatino A, Jackson CL, Pickard KM, et al. Transforming growth factor beta signalling and matrix metalloproteinases in the mucosa overlying Crohn’s disease strictures[J]. Gut, 2009,58(6): 777-789.
[11] Kruidenier L, Kuiper I, Lamers CB, et al. Intestinal oxidative damage in inflammatory bowel disease: semi-quantification, localization, and association with mucosal antioxidants[J]. J Pthol, 2003,201(1): 28-36.
[12] McLarren KW, Cole AE, Weisser SB, et al. SHIP-deficient mice develop spontaneous intestinal inflamma-tion and arginase-dependent fibrosis[J]. Am J Pathol, 2011,179(1): 180-188.
[13] Small CL, Reid-Yu SA, McPhee JB, et al. Persistent infection with Crohn’s disease-associated adherent-invasive Escherichia coli leads to chronic inflammation and intestinal fibrosis[J]. Nat Commun, 2013,4: 1957.
[14] Schwer CI , Stoll P, Goebel U, et al. Effects of hydrogen sulfide on rat pancreatic stellate cells[J]. Pancreas, 2012,41(1): 74-83.
Effect of exogenous hydrogen sulphide on intestinal fibrosis induced by trinitrobenzene-sulfonic acid in rats
FUGui-xiang,CHENNi-wei,ZHAOXiang-yun,FANHui-ning
(Dept.of Gastroenterology, Sixth People’s Hospital, Shanghai Jiaotong University, Shanghai 200233, China)
Objective To investigate the effect of exogenous hydrogen sulphide on chronic colitis and intestinal fibrosis induced by trinitrobenzene-sulfonic acid(TNBS)in rats. Methods Sixty healthy femal Sprague-Dawley rats were randomly divided into 4 groups: alcohol-control group, model group, low-dose NaHS and hige-dose NaHS group. Intestinal fibrosis were induced by TNBS in model group, low-dose and hige-dose NaHS groups. At the beginning of the third week, rats in NaHS groups were injected intraperitoneally once a day with NaHS(14.4μmol/kg and 36.0μmol/kg,respectively)starting from the 3rd week, an equal volume of normal saline was injected in the alcohol-control and model groups. All rats were sacrificed at the end of the 5th week. Serum H2S level was measured; colons samples were collected for pathological examination and measurement of collagen area, the expression of CBS mRNA was determined by RT-PCR, COLIα2, COLⅢ, TGF-β1, TNF-α were detected by ELISA. Results The macroscopic and microscopic scores, collagen area, the level of COLIα2、 COLⅢ、TGF-β1、TNF-α were higher in model group than in NaHS groups, while these in high-dose NaHS group were significantly lower than in low-dose NaHS group(P<0.05). The level of serum H2S and CBS mRNA were significantly higher in NaHS groups than those in model group(P<0.05), and these parameters were higher in hige-dose NaHS group than those in low-dose NaHS group(P<0.05). Conclusion Results indicate that exogenous hydrogen sulphide has anti-inflammatory and anti-fibrotic effects in a dose-dependent manner in rats with chronic colitis and intestinal fibrosis induced by TNBS.
hydrogen sulphide; chronic colitis; intestinal fibrosis; rat
10.16118/j.1008-0392.2016.04.002
2016-03-28
伏桂香(1989—),女,硕士研究生.E-mail: 6546345@163.com
陈尼维.E-mail: chenniwei@163.com
R 516.1
A
1008-0392(2016)04-0007-05
