外周动脉疾病基因多态性的研究进展
2016-07-10赵苗苗综述审校
赵苗苗, 张 杰 综述, 李 觉 审校
(同济大学心肺血管中心,上海 200092)
·综 述·
外周动脉疾病基因多态性的研究进展
赵苗苗, 张 杰 综述, 李 觉 审校
(同济大学心肺血管中心,上海 200092)
外周动脉疾病(peripheral artery disease, PAD)是基因与环境因素相互作用的结果。基因多态性可以增加或减少个体对疾病的易感性。踝臂指数(ankle brachial index, ABI)即足背或胫后动脉收缩压与肱动脉收缩压之比,临床上常用于筛选PAD。本研究关注近五年来发现的可能与PAD及ABI有关的易感基因。计算机检索PubMed、中国知网、中国生物文献数据库及万方数据库,收集有关基因多态性与PAD及ABI关系的研究,评价纳入研究质量并提取有效数据。本研究对2009年以后(包括2009年)发表的有关基因多态性与PAD及ABI关系的文章进行综述。
外周动脉疾病; 踝臂指数; 基因多态性
随着人们生活水平的提高,社会人口老龄化进程的加快,心血管疾病已经成为影响国民生命健康的第一位疾病。外周动脉疾病(peripheral artery disease, PAD)是除心脑动脉以外的动脉血管疾病。PAD是冠心病的等危症,患者不仅易出现行走能力受损,冠心病、脑卒中等疾病的死亡风险也显著增加[1-2]。踝臂指数(ankle brachial index, ABI)即足背或胫后动脉收缩压与肱动脉收缩压之比,临床上常用于筛选PAD,因其操作简单、无创伤被广泛用于预测外周动脉粥样硬化性疾病。2013年发表在Lancet的调查结果表明,仅10年间,全球范围内PAD患者增加了23.5%PAD不仅是影响高收入国家的疾病,全球每个地区的PAD压力都在逐年增加[3]。PAD已经成为21世纪的全球性问题。
除高龄、吸烟、高血压、糖尿病、高血脂这些较为公认的危险因素外[4-5],遗传因素对PAD的发生也起着重要作用。有家族研究表明,在调节传统的动脉粥样硬化危险因素后,遗传性约占PAD易感性的21%[6-7]。近年来,国内外学者对基因多态性与PAD及ABI的关系展开研究。
Zintzaras等[8]全面检索2008年12月31日前发表的所有与PAD有关的易感基因,并对44个基因多态性进行meta分析。染色体的9p21区域已在多项全基因组关联研究(GWAS)中被证实与心血管疾病相关联。Murabito等[9]对21个全基因组关联研究进行meta分析,以探寻染色体9p21区域中与PAD的发生和ABI值有关的基因多态性。近年来,有关亚甲基四氢叶酸还原酶(MTHFR)的基因多态性与心血管疾病关系的研究引起了人们的广泛兴趣。Khandanpour等[10]对9篇文献进行meta分析,结果显示MTHFR基因C677T多态性与PAD的发生有关。Wassel等[11]的研究结果表明,在欧美人群中,候选基因SYTL3(rs2171209)及TCF7L2(rs290481)对ABI值产生影响。在上述研究后,尚无相关文献对2009年以后有关基因多态性与PAD及ABI关系的报道进行综述。本研究全面检索2009年以后(包括2009年)已发表的有关基因多态性与PAD及ABI关系的文献,对Zintzaras等[8]在2009年发表的全基因组的meta分析进行更新,在其研究的基础上,分析、总结可能与PAD及ABI有关的易感基因。
检索数据库包括PubMed、中国知网、中国生物文献数据库及万方数据库。检索时间从2009年1月到2014年5月。纳入标准: 2008年12月31日之后公开发表的探讨基因多态性与PAD或ABI相关性的研究,且与PAD相关易感基因的研究为病例对照研究,病例组为单纯PAD患者,对照组为非PAD患者,病例组和对照组基因型分布符合哈迪-温伯格平衡检验(Hardy-Weinberg equilibrium, HWE)。排除标准: 研究内容非基因多态性与PAD或ABI相关性的研究;基因型无法获取的研究。
1 近5年相关研究
按照纳入及排除标准入选的12项研究中,4项研究在亚洲人群中展开,4项研究在欧洲人群中展开。所有病例对照研究中,病例组的最大平均年龄为69,最小平均年龄为59.3;对照组的最大平均年龄为67,最小平均年龄为47.4。病例组的最大样本量为1751,最小样本量为153;对照组的最大样本量为2015,最小样本量为100。12项研究共涉及51种基因和49种基因多态性。
2 PAD及ABI相关基因多态性效应
纳入研究中PAD及ABI相关基因多态性效应见表1。
Shaker等[12]一项在埃及人中的研究结果表明,PAD患者与对照组相比E-selection基因S128R多态性AC基因型频率分布有统计学差异(P<0.05),ICAM-1基因K469E多态性EE基因型频率分布有统计学差异(P<0.05)。近年来,全基因组关联研究(GWAS)结果显示多种心血管疾病易感基因位于染色体9p21上,且关系最为密切的SNPs主要集中在染色体9p21.3区域,多项流行病学研究证实了上述结论。该区域内存在细胞周期素依赖激酶抑制剂(CDKN)基因,分为两型,即CDKN2A和CDKN2B,基因全长8.5kb,编码含有148个氨基酸的蛋白质,是细胞周期素依赖激酶4(CDK4)的抑制因子。同时该区域内还存在一个长约58kb没有包含任何注释基因的区域。该长约58kb的区域与ANRIL大型反义非编码RNA有部分重叠,同时ANRIL与CDKN2B基因也有部分重叠。Tragante等[13]在荷兰人中的一项大样本研究结果显示,CDKN2A和CDKN2B基因rs4977574多态性G风险等位基因增加了PAD发生的可能性(OR1.29,95%CI1.16~1.44,P<0.001)。Downing等[14]在美国人中的一项研究结果表明,调节年龄、性别、种族后,染色体9p21.3区域rs10757269的等位基因G增大了PAD发生的风险(OR1.75,95%CI1.27~2.40,P=0.001)。调节年龄、性别、种族、吸烟、体质指数、糖尿病、高血压、血脂情况及高血压用药后,这种关系仍然存在(OR1.91,95%CI1.35~2.71,P<0.001)。Tsai等[15]研究表明染色体9p21区域ANRIL基因多态性rs2383207和rs1333049与ABI值有关;rs2383207的G等位基因和rs1333049的C等位基因是ABI低值的危险基因。上述研究均证实了位于染色体9p21上的多种基因多态性与PAD的发生有关。Tsai等[16]关于台湾人群BRAP基因多态性与ABI值的研究将ABI值分为低(<1.08)、中(1.08-1.14)、高(≥1.14)三个水平。结果表明各基因型间,随着G等位基因数量的增加,ABI值逐渐减小。且调节年龄、性别、体质指数、吸烟水平、血脂情况、糖尿病后,ABI水平越低,rs11066001多态性GG基因型的频率越高(低/中:OR2.87,95%CI1.24-7.27,P=0.018;低/高:OR2.92,95%CI1.27~7.27,P=0.015)。Xie等[17]研究结果表明携带SAA1基因rs12218多态性CC基因型的中国汉族人群与其他基因型(CT、TT)相比具有较低的ABI值,说明CC基因型可以增加PAD发生的可能性。
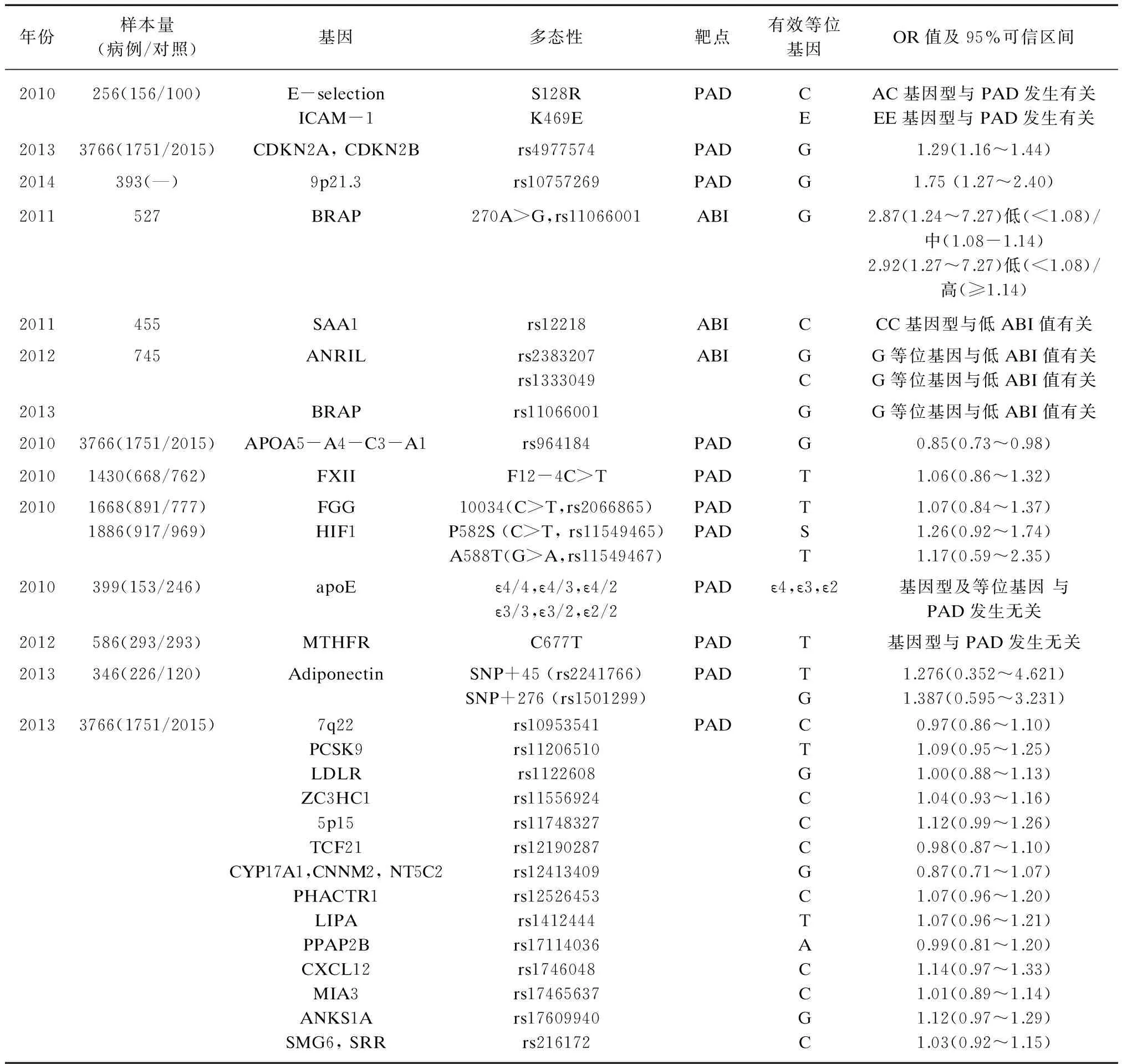
表1 12项研究涉及的基因及其多态性

(续表1)
Tragante等[13]在荷兰人中的研究结果显示APOA5-A4-C3-A1基因rs964184多态性G等位基因对PAD具有保护作用(OR0.85,95%CI0.73~0.98,P=0.02)。有研究表明APOA5-A4-C3-A1基因rs964184多态性与血浆TG水平升高有关[18-20],但国内外关于此基因多态性与心血管疾病关系的研究较少。van de Woestijne等[21]研究结果表明对于有血管病史的人群,APOA5-A4-C3-A1基因rs964184多态性与血管事件二次复发无关。APOA5-A4-C3-A1基因rs964184多态性G等位基因对PAD保护作用的机制有待于进一步研究。
亚甲基四氢叶酸还原酶(MTHFR)是催化5,10-亚甲基四氢叶酸还原酶转变为5-甲基甲氢叶酸的酶,它是同型半胱氨酸代谢过程中的关键酶。MTHFR基因C677T是一种常见的遗传多态性,这种多态性与该酶及血浆同型半胱氨酸水平密切相关,纯合子TT型和杂合子CT型与同型半胱氨酸浓度升高有关,且与亚甲基四氢叶酸还原酶的活性降低有关。同型半胱氨酸是近年来学术界所关注的一个重要心血管疾病危险因素。Khandanpour等[10]对9篇文献进行meta分析,结果显示MTHFR基因C677T多态性纯合子TT基因型可以增加PAD的患病风险(OR1.36,95%CI1.09~1.68)。本研究中纳入的Zsori等[22]的文献并没有得到上述结论。这可能由于基因多态性种族差异明显,在基因-环境交互作用模式中,不同的地域或种族之间可能不同。
3 结 语
综上所述,目前发现的PAD易感基因不仅为PAD病因研究提供新的理论基础,也为PAD的预防与治疗提供新的药物靶点,具有潜在的应用价值。今后还需在不同种族中开展大规模研究深入筛查和验证新的PAD易感位点,为新的药物靶点和风险预警提供科学依据。本研究也存在一些局限性。本文全面检索了2009年以后(包括2009年)已发表的有关基因多态性与PAD及ABI关系的文章,由于文章数量有限,只做了定性的总结、描述。其次各研究在统计分析过程中调节的协变量不同,其结论有待于进一步研究加以证实。
[1] Sigvant B, Henriksson M, Lundin F, et al. Asymptomatic peripheral arterial disease: is pharmaco-logical prevention of cardiovascular risk cost—effective[J]. Eur J Cardiovasc Prey Rehabil, 2011,18: 254-261.
[2] Hussein AA, Uno K, Wolski K, et al. Peripheral arterial disease and progression of coronary athemsel-erosis[J]. J Am Coll Cardiol, 2011,57: 1220-1225.
[3] Fowkes FG, Rudan D, Rudan I, et al. Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis[J]. The Lancet, 2013,382(9901)1329-1340.
[4] Bahadori B, Uitz E, Dehchamani D, et al. The fibrinogen gamma 10034C>T polymorphism is not associated with Peripheral Arterial Disease[J]. Thromb Res, 2010,126(4): 350-352.
[5] Joosten MM, Pai JK, Bertoia ML, et al. Associations between conventional cardiovascular risk factors and risk of peripheral artery disease in men[J]. JAMA, 2012,308(16): 1660-1667.
[6] Kullo I J, Turner S T, Kardia S L, Mosley T H Jr, Boerwinkle E, Andrade M, et al. A genomewide linkage scan for ankle-brachial index in African Am and non-Hispanic white subjects participating in the GENOA study[J]. Atherosclerosis, 2006,187: 433-438.
[7] Murabito JM, Guo CY, Fox CS, et al. Heritability of the ankle-brachial index: the Framingham Offspring study[J]. Am J Epidemiol, 2006,164: 963-968.
[8] Zintzaras E, Zdoukopoulos N. A field synopsis and meta-analysis of genetic association studies in peripheral arterial disease: The CUMAGAS-PAD database[J]. Am J Epidemiol, 2009,170: 1-11.
[9] Murabito JM, White CC, Kavousi M, et al. Association between chromosome 9p21 variants and the ankle-brachial index identified by a meta-analysis of 21 genome-wide association studies[J]. Circ Cardiovasc Genet, 2012,5: 100-112.
[10] Khandanpour N, Willis G, Meyer FJ, et al. Peripheral arterial disease and methylenetetrahydrofolate reductase (MTHFR) C677T mutations: A case-control study and meta-analysis[J]. J Vasc Surg, 2009,49(3): 711-718.
[11] Wassel CL, Lamina C, Nambi V, et al. Genetic determinants of the ankle-brachial index: a meta-analysis of a cardiovascular candidate gene 50K SNP panel in the candidate gene association resource(CARe) consortium[J]. Atherosclerosis, 2012,222(1): 138-147.
[12] Shaker O, Zahra A, Sayed A, et al. Role of ICAM-1 and E-selectin gene polymorphisms in pathogenesis of PAOD in Egyptian patient[J]. Vasc Health Risk Manag, 2010,6: 9-15.
[13] Tragante V, Doevendans P A, Nathoe H M, et al. The impact of susceptibility loci for coronary artery disease on other vascular domains and recurrence risk[J]. Eur Heart J, 2013,34(37): 2896-2904.
[14] Downing KP, Nead KT, Kojima Y, et al. The combination of 9p21.3 genotype and biomarker profile improves a peripheral artery disease risk prediction model[J]. Vasc Med, 2014,19(1): 3-8.
[15] Tsai PC, Liao YC, Lin TH, et al. Additive effect of ANRIL and BRAP polymorphisms on ankle-brachial index in a Taiwanese population[J]. Cir J, 2012,76(2): 446-452.
[16] Tsai PC, Lin TH, Hsu PC, et al. Polymorphisms of 270 A>G in BRAP is associated with lower ankle-brachial index in a Taiwanese Population[J]. J Atheroscler Tbromb, 2011,18(5): 413-420.
[17] Xie X, Ma YT, Yang YN, et al. Polymorphisms in the SAA1 gene are associated with ankle-to-brachial index in Han Chinese healthy subjects[J]. Blood Press, 2011,20(4): 232-238.
[18] Teslovich TM, Musunuru K, Smith AV, et al. Biological,clinical and population relevance of 95 loci for blood lipids[J]. Nature, 2010,466(7307): 707-713.
[19] Kathiresan S, Willer CJ, Peloso GM, et al. Common variants at 30 loci contribute to polygenic dyslipidemia[J]. Nat Genet , 2009,41(1): 56-65.
[20] Willer CJ, Sanna S, Jackson AU, et al. Newly identified loci that influence lipid concentrations and risk of coronary artery disease[J]. Nat Genet , 2008,40(2): 161-169.
[21] van de Woestijne AP, van der Graaf Y, de Bakker PI, et al. Rs964184(APOA5-A4-C3-A1) is related to elevated plasma triglyceride levels, but not to an increased risk for vascular events in patients with clinically manifest vascular disease[J]. PLoS One, 2014,9(6): e101082.
[22] Zsori K S, Csiki Z, Katona E, et al.Vitamin B12 level in peripheral arterial disease[J]. J Thromb Thrombolysis, 2013,36(1): 77-83.
Development of gene polymorphisms of peripheral arterial disease
ZHAOMiao-miao,ZHANGJie,LIJue
(Heart, Lung and Blood Vessel Center, Tongji University, Shanghai 200092, China)
Peripheral artery disease(PAD) is the result of interaction between genetic and environmental factors. Gene polymorphisms can increase or decrease the susceptibility to diseases. Ankle brachial index(ABI), which is the ratio of systolic blood pressure of dorsal or posterior tibial artery to brachial artery, is commonly used in the selection of PAD. This study focused on the susceptibility genes found in the past five years, which may be related to PAD and ABI. Several major databases(PubMed, CNKI, CBM and Wan Fang) from 2009 were searched for eligible studies. The qualities of the studies were assessed and the effective data were extracted. This review will generalize the gene polymorphisms of PAD and ABI found.
peripheral arterial disease; ankle brachial index; gene polymorphisms
10.16118/j.1008-0392.2016.02.029
2015-03-13
国家自然科学基金(81102203)
赵苗苗(1989—),女,硕士研究生.E-mail: mmz_1989@163.com
李 觉.E-mail: Jueli@tongji.edu.cn
R 54
A
1008-0392(2016)02-0128-05
