大麻素1型受体过表达对实验性自身免疫性脑脊髓炎小鼠的免疫调节
2016-07-10楼之茵赵忠新
程 洁, 楼之茵, 李 琳, 赵忠新
(1. 上海交通大学医学院附属新华医院神经内科,上海 200092; 2. 第二军医大学附属长征医院神经内科,上海 200003)
·基础研究·
大麻素1型受体过表达对实验性自身免疫性脑脊髓炎小鼠的免疫调节
程 洁1, 楼之茵1, 李 琳1, 赵忠新2
(1. 上海交通大学医学院附属新华医院神经内科,上海 200092; 2. 第二军医大学附属长征医院神经内科,上海 200003)
目的 探讨大麻素1型受体(cannabinoid 1 receptor, CB1R)过表达对实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)小鼠细胞免疫调节的影响。方法 选用C57B/L6小鼠制备EAE小鼠模型,采用质粒转染技术制备CB1R过表达组。观察假手术组和CB1R过表达组小鼠的神经功能缺损症状和体质量变化;用ELISA法检测EAE小鼠脊髓、脾脏中细胞因子INF-γ、IL-6、IL-10、IL-17、IL-1β、TNF-α浓度的变化。结果 与相同时间点的假手术组相比,CB1R过表达组出现神经功能缺损的时间及症状严重程度和体质量减轻程度显著降低(P<0.05)。假手术组和CB1R过表达组中,细胞因子在中枢神经系统和外周免疫组织的分布不相同。与假手术组相比,CB1R过表达组EAE小鼠脊髓组织中IL-10的浓度显著升高(P<0.01),而INF-γ、IL-6、IL-17、IL-1β、TNF-α的浓度显著降低(P<0.05)。结论 CB1R过表达对EAE小鼠中枢神经系统炎性损伤的保护作用,可能通过上调抑炎因子,下调促炎因子的表达实现。
大麻素1型受体; 实验性自身免疫性脑脊髓炎; CB1R过表达; 细胞因子
多发性硬化(multiple sclerosis, MS)是中枢神经系统(central nervous system, CNS)炎性脱髓鞘自身免疫性疾病,其发病机制尚不完全清楚,但普遍认为与免疫调节功能异常密切相关。实验性自身免疫性脑脊髓炎(experimental autoimmune encephal-omyelitis, EAE)是研究多发性硬化的经典动物模型。通过对EAE的大量研究,发现在EAE病情演变中,由细胞因子(cytokines, CK)构成的免疫调节网络起着重要而复杂的作用[1]。
内源性大麻素系统(endocannabinoid system, ECS)包括内源性大麻素,调节大麻素合成、转运与失活的相关蛋白,酶类和大麻素受体(cannabinoid receptor, CBR)。ECS具有广泛的生理作用,目前认为,它可能通过抑制神经兴奋性毒性和参与免疫炎性反应维持CNS微环境稳定,进而发挥神经保护作用。研究证实,MS中存在ECS功能失调[2]。所以,大麻素受体(cannabinoid receptor, CBR)在MS发生发展中的调节作用成为新的研究热点和难点。
大麻素受体包括大麻素1型受体(CB1R)和大麻素2型受体(CB2R),均属G蛋白偶联受体,目前研究较多且得到共识的是CB1R。本研究通过质粒转染技术诱导CB1R高表达观察EAE小鼠中枢神经系统中细胞因子的变化,探讨CB1R在EAE发生发展中可能的保护机制。
1 材料与方法
1.1 实验动物及试剂
健康雌性C57B/L6小鼠24只,8~10周龄,体质量22~25g,购自上海斯莱克实验动物有限公司。
MOG35-55肽段购自北京联科生物公司。完全弗氏佐剂(CFA)购自美国Sigma公司。结核菌素(TB)购自美国BD Difco公司。百日咳毒素(PTX)购自美国Enzo Life Sciences公司。ELISA检测盒购自美国Peprotech公司。
1.2 MOG35-55抗原混悬液制备
MOG35-55肽段3mg,溶于1ml PBS中(3mg/ml);3mg结核菌素溶于1ml完全弗氏佐剂(4mg/ml);采用针管混合器将等体积的两种溶液体充分混合,制成油包水样乳白色混悬液,以静置后无分层为合格。
1.3 构建由MOG35-55诱导的EAE小鼠模型
C57B/L6小鼠背部脊柱两侧四点皮下注射MOG35-55抗原混悬液(200μl/只),同时尾静脉注射PTX 200ng/100μl,48h后再次尾静脉注射PTX 200ng/100μl加强免疫。所有小鼠置相同的饲养环境,自由饮食,自然作息。每日记录小鼠体质量,评估临床症状。
1.4 EAE小鼠症状评估及分组
从免疫当天进行小鼠临床症状评分,直至免疫后第28天。采用国际评分标准如下。0分: 无症状;1分: 垂尾;2分: 行路不稳、后肢力弱、翻正反射迟钝;3分: 后肢麻痹和(或)前肢力弱;4分: 前肢麻痹;5分: 四肢瘫;6分: 濒临死亡或死亡。
EAE小鼠24只,随机分成EAE假手术组(12只)和EAECB1R过表达组(12只)。EAE假手术组于L4~5间隙注射15μl溶剂为对照,CB1R过表达组于L4~5间隙注射经预实验筛选的含CB1R过表达基因序列的干扰载体,过表达NM号(NM_007726.3),载体pLOV.CMV.eGFP.2A.EF1a.PuroR。引物序列Primer(+): 5′-AACC-CCGGTCCGATGGCTAGCATGCATGAAGTCGATC-TTAGACGGCC-3′,同源重组序列目的基因5′端配对序列;Primer(-): CGTCATCCTTGTAGTCG-CTAGCCAGAGCCTCGGCAGACGTGTC同源重组序列目的基因3′端配对序列。
1.5 酶联免疫吸附试验(ELISA)检测细胞因子
注射后第28天分别取假手术组和过表达组EAE小鼠的脊髓和脾脏,称取80mg组织,冰浴条件下提取组织胞浆蛋白。在37℃细胞培养箱中孵育48h后,取上清液,用ELISA法检测INF-γ、IL-6、IL-10、IL-17、IL-1β、TNF-α的浓度。
随着经济发展、人口增加和资源的过度开发,我国水资源供给和需求出现严重的失衡,计划体制下的水资源管理体制对此无能无力,政府因此尝试用市场化方法来解决我国面临的水资源难题。随着新水法的颁布,我国水资源市场配置的改革进程明显提速。2004年水利部下发《水利部关于内蒙古宁夏黄河干流水权转换试点工作的指导意见》,2005年颁布并实施了《水利部关于水权转让的若干意见》《关于印发水权制度建设框架的通知》,2006年国务院颁布实施《取水许可和水资源费征收管理条例》,2008年水利部颁布《水量分配暂行办法》和《取水许可办法》。这些法律和法规的颁布,标志着我国正式启动水权市场建设。
1.6 统计学处理
使用GraphPad Prism 5.0软件进行统计分析。计量资料用F检验进行样本方差齐性检验,样本符合正态分布且方差齐性时,两组均数比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 假手术组和过表达组EAE小鼠神经功能缺损评分的动态变化
免疫后每日评估EAE小鼠的神经功能缺损,测量EAE小鼠体质量。假手术组最早出现神经功能缺损为第10天,而CB1R过表达组出现神经功能缺损为第14天,显著晚于EAE假手术组(P<0.05)。CB1R过表达组神经功能缺损评分显著低于EAE假手术组(P<0.05),见图1A。与假手术组相比,CB1R过表达组EAE小鼠体质量减轻程度显著好于假手术组(P<0.05),见图1B。
2.2 假手术组与CB1R过表达组EAE小鼠不同组织中细胞因子的表达
ELISA结果显示: 无论是假手术组还是CB1R过表达组,细胞因子INF-γ、IL-6、IL-10、IL-17、TNF-α在中枢神经系统中的表达显著高于外周免疫组织(P<0.01),而IL-1β在外周免疫组织中的表达显著高于中枢神经系统(P<0.01),见表1。
2.3 CB1R过表达对不同组织中细胞因子的调节
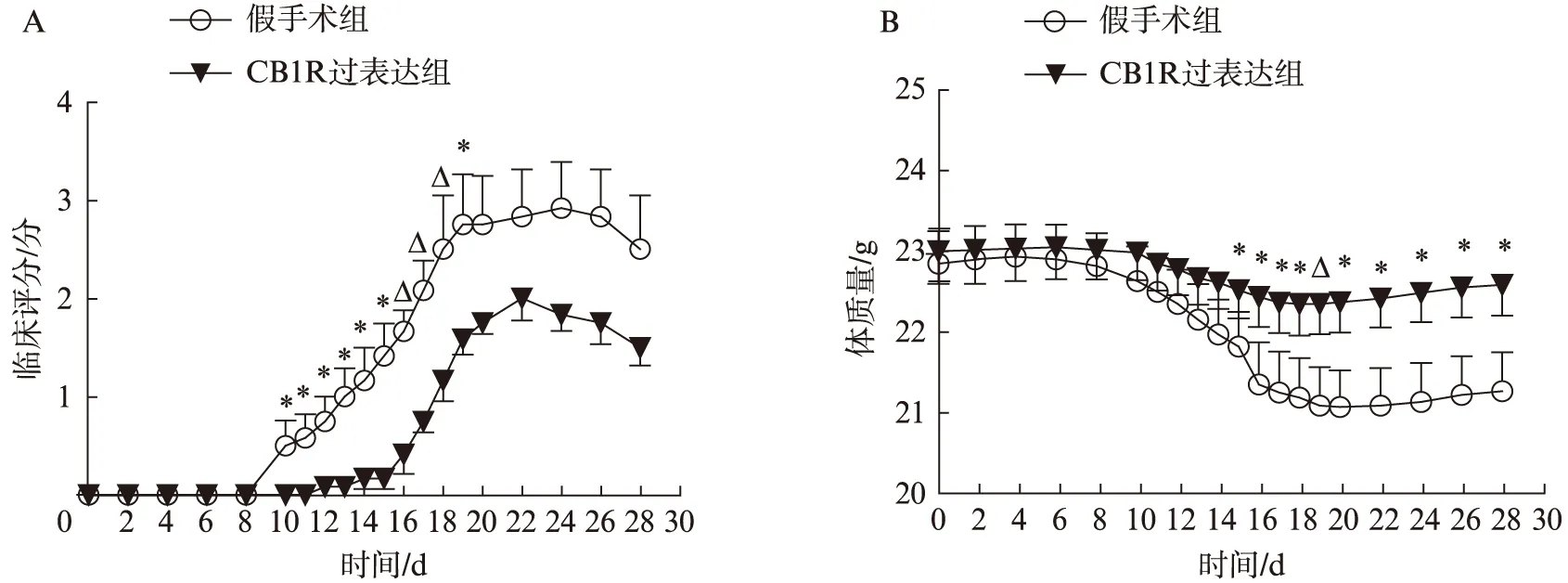
图1 不同时间点EAE假手术组和CB1R过表达组小鼠神经功能缺损及体质量的变化Fig.1 Clinical score and body weight at different time point between EAE sham group and CB1R over-expressing groupA; 临床评分;B; 体质量;与CB1R过表达组相比,*P<0.05,△P<0.01
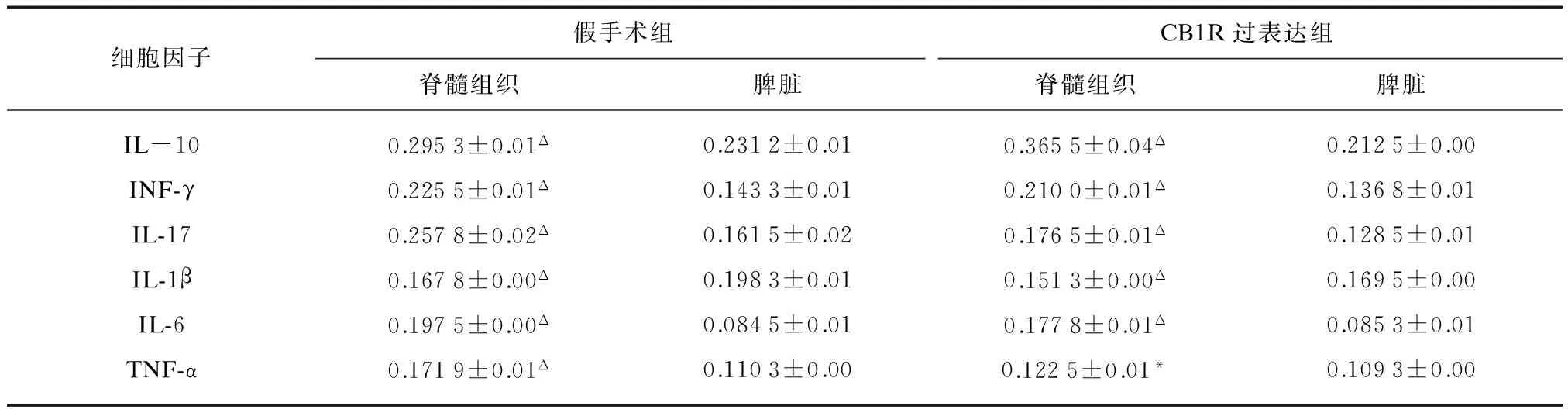
表1 假手术组与CB1R过表达组脊髓组织与脾脏中细胞因子的表达
与脾脏细胞因子相比,*P<0.05,ΔP<0.01
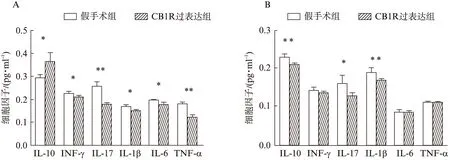
图2 CB1R过表达对脊髓、脾脏组织中IL-10、INF-γ、IL-17、IL-1β、IL-6、TNF-α浓度调节Fig.2 Regulation to INF-γ, IL-6, IL-10, IL-17, IL-1β and TNF-α in spinal cord and spleen of CB1R over-expressing groupA; 脊髓组织,B: 脾脏;*P<0.05,**P<0.01
3 讨 论
大多数研究认为,EAE/MS主要是T细胞介导的自身免疫性疾病,特异性抗原诱导CD4+T细胞发生免疫应答所致。根据所分泌的细胞因子不同,T细胞主要分化成Th0、Th1、Th2细胞和Th3细胞四个亚型。其中Th1细胞所分泌的代表性因子包括INF-γ、TNF-α、IL-1β、IL-12等,参与诱导麻痹和炎症反应,主要促使EAE的发生、发展和加重;而Th2细胞所分泌代表性因子包括IL-10、IL-4、IL-13、TGF-β等,主要可使EAE/MS抑制或逆转[3]。Th1/Th2细胞反应失衡是EAE/MS发病的重要机制[4]。近年来,发现一种分泌IL-17的新的Th亚群(Th17),被认为是可能参与组织炎症和免疫反应的主要细胞亚型[3]。
IL-17生物学活性的特征是具有强大的致炎性。它能促进机体局部产生趋化因子,如IL-8、MCP-1(单核细胞趋化蛋白-1)、Gro-α(生长调节因子-α),因此有助于单核细胞和中性粒细胞的迅速增多;能刺激产生IL-6和PGE-2,增强局部炎症[5]。Brucklacher-Waldert等[5]发现,IL-17mRNA表达在MS患者血和脑脊液中病毒升高。Dardalhon等[6]发现,在EAE的CNS中,早期以Th17细胞浸润为主,而晚期却以Thl细胞浸润为主。Th17细胞的产生快于Thl细胞,启动急性炎症的形成,而Thl在其后的炎症维持中发挥作用[7]。INF-γ是对MS有影响的促炎因子,可反映MS的活动性并检测药物疗效[8]。研究[9]证明,IL-10水平升高在MS的免疫病理过程中起到重要的保护作用。
本研究发现,脊髓组织中IL-10、IL-17、TNF-α、INF-γ和IL-6的浓度无论在假手术组还是CB1R过表达组都显著高于脾脏中。而IL-1β浓度反之,无论在假手术组还是CB1R过表达组脾脏中显著高于脊髓。由此推测,CB1R参与EAE的发生发展主要通过中枢神经系统免疫微环境发挥作用。
随着研究的深入,目前发现大麻素受体系统在众多神经系统疾病中起着重要的神经保护和免疫调节的作用[10-11]。楼之茵等[12]的研究发现,给予CB1R抑制剂(SR141716A、SR1),EAE小鼠脊髓IL-17、IL-1β、IL-6、TNF-α的浓度显著升高,而IL-10则显著降低,与之对应的是SR1诱导的EAE小鼠起病时间提前以及早期神经功能缺损症状加重。
本研究发现,CB1R过表达组EAE小鼠脊髓中抑炎因子IL-10的浓度明显升高而促炎因子INF-γ、IL-17、IL-1β、IL-6、TNF-α的浓度显著降低。与之相对应,CB1R过表达组EAE小鼠临床症状发作时间显著延迟,神经功能缺损程度也显著减轻,同时CB1R过表达组EAE小鼠的体质量减轻程度也好于假手术组。我们推测,中枢神经系统CB1R过表达可能通过激活抑炎因子IL-10、抑制促炎因子IL-17等起到神经保护作用。
MS/EAE的免疫机制复杂,CB1R过表达能减轻EAE小鼠的神经功能缺损程度,提示CB1R对小鼠中枢神经系统炎性损伤有保护作用,这种作用可能通过上调抑炎因子,下调促炎因子的表达实现。
[1] Imitola J,Chitnis T,Khoury SJ. Cytokines in multiple sclerosis: from bench to bedside[J]. Pharmacol Ther,2005,106(2): 163-177.
[2] Centonze D, Bari M, Rossi S, et al. The endocannabinoid system is dysregulated in multiple sclerosis and in experimental autoimmune encephalo-myelitis[J]. Brain, 2007,130: 2543-2553.
[3] 侯娟.多发性硬化免疫机制研究新进展[J].国际免疫学杂志,2009,32(6): 468-471.
[4] 侯杰忠,孙永胜.细胞因子在实验性自身免疫性脑脊髓炎耐受中的作用[J].国际免疫学杂志,2006,29(3): 160-164.
[5] Brueklacher-Waldert V, Stueruer K, KolsterM, et al. Phenotypical and functional characterization of T helper 17 cells in multiple sclerosis[J].Brain, 2009,132(12): 3329-3341.
[6] Dardalhon V, Konr T, Kuehroo VK, et al. Role of Thl and Thl7 cells in prgan—specific autoimmunity[J].Autoimmun, 2008,31(3): 252-256.
[7] 林琳,杨丹,付锦.Thl细胞和Thl7细胞在多发性硬化和实验性变态反应性脑脊髓炎发生中的作用[J].国际免疫学杂志,2012,35(1): 5-8.
[8] 徐雁.多发性硬化的生物学标记物[J].中国神经免疫学和神经病学杂志,2013,20(2): 82-84.
[9] 周建光,杨梅.IL-10与自身免疫性疾病关系的研究进展[J].医学综述,2012,18(17): 2743-2745.
[10] Fowler CJ, Rojo ML, Rodriguez-Gaztelumendi A. Modulation of the endocannabinoid system: neuropro-tection or neurotoxicity?[J].Exp Neurol,2010,224(1): 37-47.
[11] Rossi S, Bernardi G, Centonze D. The endocannab-inoid system in the inflammatory and neurodegenerative processes of multiple sclerosis and of amyotrophic lateral sclerosis[J]. Exp Neurol, 2010,224(1): 92-102.
[12] 楼之茵,程洁,李琳,等.大麻素1型受体在实验性自身免疫性脑脊髓炎小鼠中的动态表达及其作用[J].中山大学学报: 医学科学版,2014,35(6): 814-822.
Effect of cannabinoid 1 receptor over-expression on immunomodulation in mice with experimental autoimmune encephalomyelitis
CHENGJie1,LOUZhi-yin1,LILin1,ZHAOZhong-xin2
(1. Dept. of Neurology, Xinhua Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200092, China;2. Dept. of Neurology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China)
Objective To investigate the effect of cannabinoid 1 receptor (CB1R) over-expression on immunomodulation in mice with experimental autoimmune encephalomyelitis (EAE). Methods EAE was induced in C57B/L6 mice, CB1R over-expression was prepared by plasmid transfection. The change of neurological deficit and the body weight were compared between sham group and over-expression group. Serum cytokines INF-γ, IL-6, IL-10, IL-17, IL-1β and TNF-α were measured by ELISA. Results The onset time of neurologic impairment, the severity of symptoms and weight loss were significantly lower in CB1R over-expression group than sham group (P<0.05). The cytokine profile was different between central nervous system and peripheral immune tissue in both groups. Compared with sham group, the level of IL-10 in spinal cord was significantly higher (P<0.01) and INF-γ, IL-6, IL-17, IL-1β and TNF-α were significantly lower (P<0.05). Conclusion CB1R can protect central nervous system from inflammatory injury in EAE mice by up-regulation of inhibiting inflammatory cytokines and down-regulation of proinflammatory cytokines.
cannabinoid 1 receptor; experimental autoimmune encephalomyelitis; CB1R over-exp-ression; cytokines
10.16118/j.1008-0392.2016.02.001
2015-12-06
国家自然科学青年基金(81200921)
程 洁(1973—),女,主治医师,硕士.E-mail: jjchengjj@sina.com
赵忠新.E-mail: zhaozx@medmail.com.cn
R 744.3
A
1008-0392(2016)02-0001-04
