吲哚胺2,3双加氧酶对人绒毛膜癌JEG-3细胞增殖及迁移能力的影响
2016-07-10宗姗姗罗成凤李春青
宗姗姗, 赵 鑫, 罗成凤, 李春青, 王 凯, 周 倩
(同济大学附属第一妇婴保健院妇产科,上海 200040)
·基础研究·
吲哚胺2,3双加氧酶对人绒毛膜癌JEG-3细胞增殖及迁移能力的影响
宗姗姗, 赵 鑫, 罗成凤, 李春青, 王 凯, 周 倩
(同济大学附属第一妇婴保健院妇产科,上海 200040)
目的 观察吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase, IDO)对人绒毛膜癌JEG-3细胞体外增殖、迁移能力的影响。方法 通过IDO抑制剂(1-L-MT)及短发夹RNA基因干扰抑制IDO表达,利用MTS增殖实验、Transwell迁移试验检测对细胞增殖和迁移能力的影响。结果 基因敲减能明显降低IDO表达水平。1-L-MT和基因敲减的JEG-3细胞与对照组相比,细胞的增殖和迁移能力明显下降。结论 抑制IDO能够降低绒癌细胞系JEG-3细胞的增殖和迁移能力。
绒毛膜肿瘤; 吲哚胺2,3双加氧酶; JEG-3; 细胞增殖; 细胞迁移
吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase, IDO)是一种含亚铁血红素的酶,广泛分布于人体多种组织和细胞内,是肝脏外唯一可以催化色氨酸分子中吲哚环裂解沿犬尿氨酸途径代谢的限速酶,具有多种免疫调节作用。近年来研究表明IDO在多种肿瘤组织中表达增高[1-3],不仅调节免疫细胞,而且能够促进肿瘤细胞本身的生长,促进肿瘤转移[4-5]。IDO抑制剂1-L-MT作为癌症潜在治疗靶点,已进入临床前期研究[6-7]。绒毛膜癌作为一种高度恶性的肿瘤,对妇女的生命健康存在严重威胁[8]。本研究利用药物及基因敲减技术抑制IDO基因在JEG-3细胞中的表达,观察对细胞增殖和迁移能力的影响,为绒毛膜癌诊治方案的完善提供新的思路和方法。
1 材料与方法
1.1 仪器与设备
人绒毛膜癌JEG-3细胞由同济大学附属第一妇婴保健院转化中心实验室提供。DMEM培养基及胎牛血清购买自美国Gibco公司;shRNA试剂盒购买自上海中乔新舟生物科技有限公司;反转录和PCR试剂盒购买自美国TaKaRa公司;IDO抗体购自美国Millipore公司;GAPDH抗体购买自上海康成生物有限公司;MTS增殖检测试剂购自北京Promega公司;迁移荧光染料Calcein-AM购自美国Invitrogen公司。
1.2 方法
1.2.1 JEG-3细胞培养 JEG-3细胞培养液α-MEM,加入10%FBS和1%青霉素/链霉素;将细胞置于37℃、5%CO2的细胞培养箱中培养,每2~3d换液。选指数生长期的细胞进行实验。
1.2.2 细胞转染 消化计数生长良好的JEG-3细胞,铺于6孔板,每孔5万个细胞,加入病毒混合液,用Polybrene促转染,操作步骤按说明书进行。转染12h,加入嘌呤霉素筛选,选出稳定转染株进行后续实验。
1.2.3 荧光定量PCR检测IDO的mRNA表达 收集对数生长期各组细胞,用TRIzol提取总RNA,用TaKaRa反转录试剂盒逆转录,天根Real-Time PCR试剂盒进行扩增。引物序列如下。IDO上游引物: 5′-GGCTTCTTCCTCGTCTCTCTATTG-3′;IDO下游引物: 5′-TGACGCTCTACTGCACT-GGATAC-3′;GAPDH上游引物: 5′-ACTCCACGA-CGTACTCAGCG-3′; GAPDH下游引物: 5′-GGTCGGACTCAACGGATTTG-3′。 Real-Time反应条件: 预变性95℃ 30 s, PCR反应(95℃ 5 s,60℃ 20 s)40个循环。按相对定量ΔΔCT法,每次实验样品设三复孔,计算平均CT值。ΔCT(IDO, 样品1)=平均CT(IDO, 样品1)-平均CT(GAPDH, 样品1)。设定正常早孕组20例样品ΔCT平均值为基值,所有40例的ΔCT与之相减,得ΔΔCT。当各组织PCR 扩增效率一致时,采用公式: fold change=2(-ΔΔCT)。应用Studentt-test 进行统计分析。根据溶解曲线分析模板是否纯净单一,如果溶解曲线图中表现为单一峰,说明引物特异性高,无非特异性荧光,对模板的定量准确。
1.2.4 Western印迹法检测IDO蛋白表达 取对数生长期的各组细胞,预冷的蛋白裂解液提取蛋白质。BCA法检测蛋白浓度,以每孔30μg上样。SDS-PAGE凝胶垂直电泳,转至PVDF膜,5%BSA室温封闭1h,加入抗人IDO一抗(1∶500),4℃孵育12~16h。山羊抗鼠IgG二抗(1∶2 000)室温下孵育1h,ECL显影,在FluorChem E上显色曝光,AlphaView SA系统上测定蛋白条带的灰度值。GAPDH蛋白为内参。计算目的蛋白与GAPDH条带灰度值的比值。
1.2.5 细胞增殖实验 取生长良好的各组细胞,调整浓度为2万/ml,铺入96孔板,每孔100μl,设6个复孔。加入不同浓度的IDO抑制剂1-L-MT(0、0.25、0.5、1.0、2.0、4.0mmol/L),在培养箱中培养48h。每孔加入20μl的MTS,注意避光,轻轻晃动细胞培养板,使其混匀,细胞培养箱中避光孵育1h。在酶标仪中测量每孔490nm的吸光值(D490);根据标准曲线,计算出各孔的对应细胞数。实验重复3次。
1.2.6 细胞迁移实验 取生长良好的各组细胞,重悬于含2%FBS的培养基中,调整浓度为17万/ml,Transwell板上室每孔铺上述细胞悬液300μl,下室每孔加含10%FBS的培养基800μl,重复2个复孔。加或不加不同浓度的IDO抑制剂1-L-MT,在培养箱中培养16h。下室每孔加入荧光染色剂Calcein-AM 1μl,培养箱孵育30min。荧光显微镜下拍摄照片,并计数。实验重复3次。
1.3 统计学处理

2 结 果
2.1 基因干扰抑制IDO表达
基因干扰效果检测 Real-Time PCR及Western印迹法检测显示,相比于对照组,IDO特异性shRNA 基因干扰的JEG-3细胞IDO的mRNA表达水平下降65%,IDO蛋白表达水平下降53%,差异有统计学意义(P<0.01,P<0.05),见图1。

图1 Western印迹法检测基因干扰后IDO蛋白表达Fig.1 IDO protein expression in shRNA-transfected JEG-3 cells and control shown by Western blotting
2.2 1-L-MT和shRNA干扰IDO表达抑制JEG-3细胞增殖能力
当不同浓度的1-L-MT加入JEG-3细胞培养基处理48h后,细胞的增殖受到一定程度的抑制。当1-L-MT 的浓度为0.5mmol/L及以下时,对JEG-3细胞的增殖能力没有明显抑制。当1-L-MT 的浓度大于1mmol/L时,JEG-3细胞的增殖能力受到明显抑制,随着在培养基中1-L-MT的浓度增高,抑制效应越加明显,即有一个剂量依赖的趋势,见图2。通过将shRNA转染入JEG-3细胞进一步证实IDO对绒癌细胞增殖能力的影响,与对照组相比,干扰组增殖能力明显降低。
2.3 1-L-MT和shRNA干扰IDO表达抑制JEG-3细胞迁移能力
不同浓度的1-L-MT 加入JEG-3培养基处理48h后,用Transwell系统培养16h,检测JEG-3细胞的迁移情况,与对照组相比,JEG-3细胞的迁移功能都受到一定程度的抑制,并且2mmol/L时抑制作用明显强于1mmol/L。通过将shRNA转染入JEG-3细胞进一步证实IDO对绒癌细胞迁移能力的影响,与对照组相比,干扰组迁移能力降低43%,见图3、4。
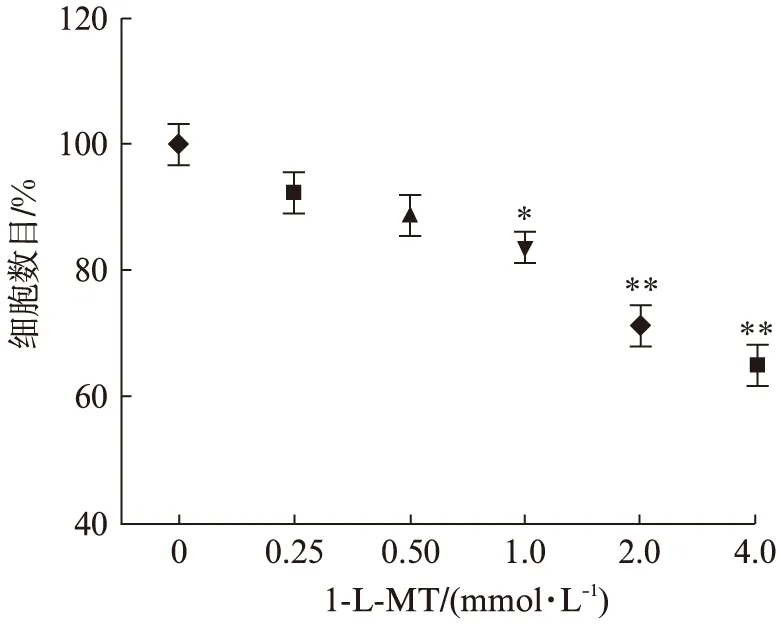
图2 1-L-MT和IDO基因干扰抑制JEG-3细胞增殖能力Fig.2 Cell proliferation in 1-L-MT-treated and shRNA-transfected JEG-3 cells and controls与不加1-L-MT组相比,*P<0.05,**P<0.01
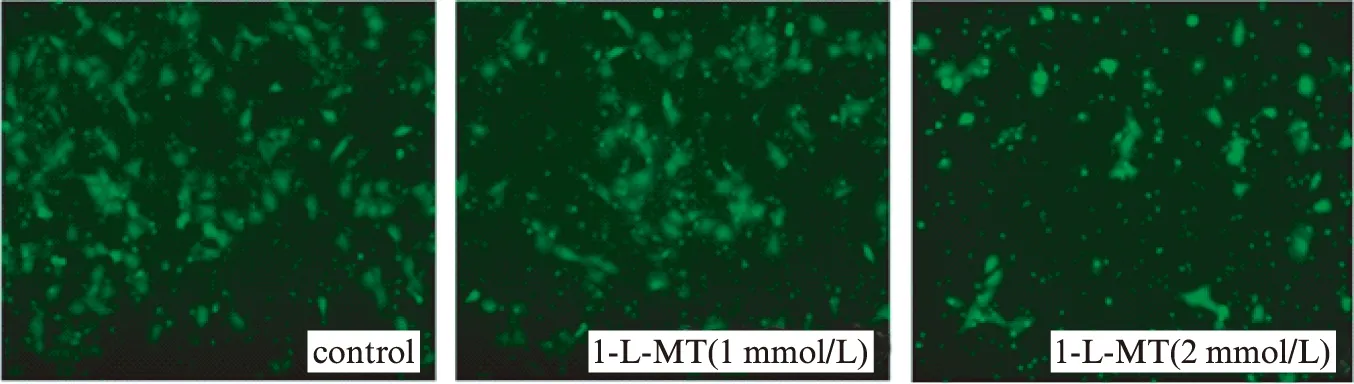
图3 1-L-MT抑制JEG-3细胞迁移能力Fig.3 Cell migration in 1-L-MT-treated JEG-3 cells and control
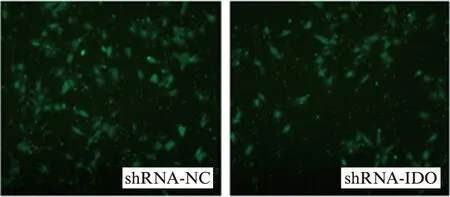
图4 shRNA干扰IDO表达抑制JEG-3细胞迁移能力Fig.4 Cell migration in shRNA-transfected JEG-3 cells and controls
3 讨 论
绒毛膜癌是高度恶性的滋养细胞肿瘤,严重威胁育龄期妇女生命。目前临床多药联合化疗方案使多数患者病情得到缓解,然而耐药病例仍有一部分比例,因此需要不断探索新的治疗方法。正常情况下,滋养层细胞对子宫内膜的侵袭受到严格而精准的调控,体内多种细胞因子均能够调控绒毛膜癌细胞的恶性侵袭[9]。IDO作为一种免疫调节分子被广泛研究,而近年来研究发现,IDO不仅具有调节免疫的作用,还对多种肿瘤细胞的生长具有促进作[4-5,10]。将IDO-cDNA转入鼠源性卵巢癌细胞系OV2944-HM-1中后,种植于免疫完全小鼠体内,肿瘤腹膜转移显著增多[11]。而IDO缺陷小鼠肺肿瘤转移的机会则明显减少。
近年来多篇报道发现,IDO对于多种肿瘤细胞本身的生长具有重要作用,IDO表达高的肺癌患者预后较差,表达IDO的细胞比不表达IDO的细胞有更强的增殖和转移能力[12-14],而在绒毛膜癌细胞中,IDO是否能够调节其功能,目前还未见报道。
本研究应用IDO特异性抑制剂1-L-MT处理JEG-3细胞后,检测其增殖和迁移功能,发现其增殖和迁移能力都明显降低。为了进一步证实IDO对绒癌细胞系JEG-3细胞的调节作用,对绒癌细胞系JEG-3细胞进行了IDO基因敲减,发现相比于对照组,IDO基因敲减组的绒癌细胞增殖和迁移能力明显受到抑制。说明IDO对于绒癌细胞系JEG-3细胞的增殖和迁移能力具有调控作用,有可能为绒癌的治疗提供新的靶点。
[1] Jia Y, Wang H, Wang Y, et al. Low expression of Bin1, along with high expression of IDO in tumor tissue and draining lymph nodes, are predictors of poor prognosis for esophageal squamous cell cancer patients[J]. Int J Cancer, 2015,137(5): 1095-1106.
[2] Llosa NJ, Cruise M, Tam A et al. The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints[J]. Cancer Discov, 2015,5(1): 43-51.
[3] Xiao Y, Freeman GJ. The microsatellite instable subset of colorectal cancer is a particularly good candidate for checkpoint blockade immunotherapy[J]. Cancer Discov, 2015,5(1): 16-18.
[4] Chen JY, Li CF, Kuo CC, et al. Cancer/stroma interplay via cyclooxygenase-2 and indoleamine 2,3-dioxygenase promotes breast cancer progression[J]. Breast Cancer Res, 2014,16(4): 410.
[5] Litzenburger UM, Opitz CA, Sahm F, et al. Constitutive IDO expression in human cancer is sustained by an autocrine signaling loop involving IL-6, STAT3 and the AHR[J]. Oncotarget, 2014,5(4): 1038-1051.
[6] Bauer TM, Jiga LP, Chuang JJ, et al. Studying the immunosuppressive role of indoleamine 2,3-dioxy-genase: tryptophan metabolites suppress rat allogeneic T-cell responsesinvitroandinvivo[J]. Transpl Int, 2005,18(1): 95-100.
[7] Yoshida N, Ino K, Ishida Y, et al. Overexpression of indoleamine 2,3-dioxygenase in human endometrial carcinoma cells induces rapid tumor growth in a mouse xenograft model[J]. Clin Cancer Res, 2008,14(22): 7251-7259.
[8] 刘萍,李怀芳.滋养细胞疾病9例误诊分析[J].同济大学学报: 医学版,2011,32(3): 88-91.
[9] Craven CM, Chedwick LR, Ward K. Placental basal plate formation is associated with fibrin deposition in decidual veins at sites of trophoblast cell invasion[J]. Am J Obstet Gynecol, 2002,186(2): 291-296.
[10] Ferns DM, Kema IP, Buist MR, et al. Indoleamine-2,3-dioxygenase (IDO) metabolic activity is detrimental for cervical cancer patient survival[J]. Oncoimm-unology, 2015,4(2): e981457.
[11] Tanizaki Y, Kobayashi A, Toujima S, et al. Indolea-mine 2,3-dioxygenase promotes peritoneal metastasis of ovarian cancer by inducing an immuno-suppressive environment[J]. Cancer Sci, 2014, 105(8): 966-973.
[12] Ligam P, Manuelpillai U, Wallace EM, et al. Localisation of indoleamine 2,3-dioxygenase and kynurenine hydroxylase in the human placenta and decidua: Implications for role of the kynurenine pathway in pregnancy[J]. Placenta, 2005,26(6): 498- 504.
[13] Muller AJ, DuHadaway JB, Jaller D, et al. Immunotherapeutic suppression of indoleamine 2,3-dioxygenase and tumor growth with ethyl pyruvate[J]. Cancer Res, 2010,70(5): 1845-1853.
[14] Platten M, Wick W, Van den Eynde BJ. Tryptophan catabolism in cancer: beyond IDO and tryptophan depletion[J]. Cancer Res, 2012,72(21): 5435-5440.
Effect of indoleamine 2,3-dioxygenase on proliferation and migration in JEG-3 cells
ZONGShan-shan,ZHAOXin,LUOCheng-feng,LIChun-qing,WANGKai,ZHOUQian
(Dept. of Obstetrics and Gynecology, First Maternity and Infant Hospital, Tongji University, Shanghai 200040, China)
Objective To investigate the effect of indoleamine 2,3-dioxygenase (IDO) on proliferation and migration of human choriocarcinama JEG-3 cells. Methods JEG-3 cell function was studied by IDO inhibitor(1-L-MT) or shRNA. The proliferation and migration of JEG-3 cells were determined by MTT assay and Transwell system, respectively. Results shRNA knockdown significantly decreased IDO expression. 1-L-MT and shRNA knockdown of IDO decreased the proliferation and migration of JEG-3 cells. Conclusion The inhibitory of IDO can suppress the proliferation and migration of trophoblast cellsinvitro.
choriocarcinama; IDO; JEG-3; proliferation; migration
10.16118/j.1008-0392.2016.02.007
2015-11-29
国家自然科学基金(81270703);上海市科学技术委员会项目(14140900203)
宗姗姗(1989—),女,住院医师,硕士研究生.E-mail: zongshan39@163.com
周 倩.E-mail: shzhouqian@126.com
R 737.33
A
1008-0392(2016)02-0031-04
