shRNA-CXCR7联合TRAIL对人肝癌SMMC-7721细胞裸鼠皮下移植瘤生长的影响
2016-07-10王刚程雪张祥林董福仁
王刚,程雪,张祥林,董福仁
(1.辽宁医学院附属第一医院 放射线科,辽宁 锦州 121001;2.辽宁医学院附属第一医院 神经内科,辽宁 锦州 121001)
shRNA-CXCR7联合TRAIL对人肝癌SMMC-7721细胞裸鼠皮下移植瘤生长的影响
王刚1,程雪2Δ,张祥林1,董福仁1
(1.辽宁医学院附属第一医院 放射线科,辽宁 锦州 121001;2.辽宁医学院附属第一医院 神经内科,辽宁 锦州 121001)
目的 探讨重组腺病毒介导的细胞表面趋化因子受体7(C-X-C chemokine receptor type 7,CXCR7)基因沉默联合肿瘤坏死因子相关凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)对人肝癌SMMC-7721细胞裸鼠皮下移植瘤生长的影响。方法 建立肝癌SMMC-7721细胞裸鼠皮下移植瘤模型,2周后,当裸鼠肿瘤体积达到50~100 mm3后,将20只造模成功的裸鼠随机分为4组并标记(n=5),分别接受瘤内注射治疗:空白组、TRAIL组、shRNA-CXCR7组和TRAIL+shRNA-CXCR7组。对各组荷瘤鼠用卡尺在体测量瘤体长短径后进行瘤体内注射,1次/7 d。并绘制裸鼠移植瘤生长曲线。第5次注射治疗后1周处死全部裸鼠,小心剥离肿瘤并进行瘤体重量称量。免疫组化和Western blot检测各组移植瘤组织中血管内皮细胞生长因子(vascular endothelial cell growth factor,VEGF)的表达。结果 治疗开始到第7天,TRAIL组、shRNA-CXCR7组和TRAIL+shRNA-CXCR7组均较空白组肿瘤生长缓慢(P<0.05);从第14天到35天,TRAIL组移植瘤体积增长迅速与空白组间差异无统计学意义,而shRNA-CXCR7组和TRAIL+shRNA-CXCR7组裸鼠移植瘤体积增长缓慢;35 d实验结束时,与其他各组相比TRAIL+shRNA-CXCR7组肿瘤体积增幅最小 (P<0.05)。第35天时,shRNA-CXCR7组和TRAIL+shRNA-CXCR7组肿瘤平均瘤重明显小于空白组和TRAIL组,其中TRAIL+shRNA-CXCR7组瘤体质量最轻(P<0.05)。免疫组化结果及Western blot结果显示:TRAIL组、shRNA-CXCR7组和TRAIL+shRNA-CXCR7组3组VEGF阳性表达均低于空白组,其中以TRAIL+shRNA-CXCR7组表达最低(P<0.05)。结论 下调CXCR7的表达联合TRAIL可通过调节VEGF的表达来抑制肝癌SMMC-7721裸鼠皮下移植瘤的生长进展。
肝癌;CXCR7;TRAIL;VEGF;裸鼠
原发性肝癌是恶性程度极高的肿瘤之一,其发病率和致死率分别位居全球恶性肿瘤排名的第6位和第2位[1]。而我国是肝癌发病率最高的国家之一,每年约有50%新发肝癌病例发生在中国[2]。近年来研究表明[3-4],从分子水平抑制肿瘤的发生发展,调节肿瘤微环境,靶向作用于重要的信号通路可以逆转、延迟或阻止致癌过程形成、防止复发和转移,为肝癌基因治疗奠定了理论基础并提供了新途径。肿瘤坏死因子相关凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)是近年来继Fas、TNF后发现的TNF超家族的又一成员[5],TRAIL可选择性地诱导多种肿瘤细胞凋亡,而对正常组织及细胞无凋亡诱导及毒性作用[6],表现出良好的抗肿瘤活性。但几乎所有的肝癌细胞系均对TRAIL表现出不同程度的耐受性,这在很大程度上限制了TRAIL在临床肝癌治疗中的广泛应用[7]。细胞表面趋化因子受体7(C-X-C chemokine receptor type 7,CXCR7)作为一种新的趋化因子受体,其对肿瘤的影响是多方面的。已有研究发现[8-10],CXCR7在乳腺癌、结肠癌、膀胱癌、前列腺癌等增殖、血管形成、侵袭和转移中发挥重要调节作用。本研究前期已成功构建靶向CXCR7基因的shRNA腺病毒表达载体,并已证实该载体对CXCR7基因的沉默效果。接下来将进一步通过体内实验在体研究shRNA-CXCR7联合TRAIL对人肝癌SMMC-7721细胞裸鼠皮下移植瘤生长的影响,为肝癌的基因治疗提供理论依据和新途径。
1 材料与方法
1.1 材料
1.1.1 细胞株和实验动物:细胞株:人肝癌SMMC-7721细胞株购于中国科学院上海研究所细胞库。
实验动物:6周龄体质量18~20g BALB/c雌性裸鼠20只,购自北京维通利华实验动物技术有限公司。
1.1.2 主要试剂:
① 细胞培养主要试剂:RPMI-1640培养基和胰酶(0.25%)均购自美国Gibco公司;PBS购自武汉博士德生物工程有限公司;胎牛血清(10%)购自杭州四季青生物工程材料有限公司;
② 瘤内注射治疗试剂:shRNA-CXCR7重组腺病毒表达载体由辽宁医学院附属第一医院生物样本库构建完成;重组可溶性TRAIL购自美国PeproTech公司;
③ Western blot主要试剂:兔抗人VEGF多克隆抗体购自英国Abcam公司;兔抗人β-actin 多克隆抗体购自美国Santa Cruz公司;辣根过氧化物酶标记的羊抗兔IgG购自北京中杉金桥生物技术有限公司;预染蛋白marker购自美国Fermenta公司;PVDF膜购自美国 Millipore公司;N,N′-亚甲双丙烯酰胺(Bis)、Tris碱、丙烯酰胺(Acr)、过硫酸铵(AP)、十二烷基硫酸钠溶液、TEMED购自美国 Promega 公司;青霉素和链霉素购自江苏碧云天生物技术公司;ECL化学发光试剂盒购自美国 Amersham Biosciences 公司;
④ 免疫组织化学主要试剂:SP-9000免疫组化、DAB显色试剂盒、3-氨丙基三乙氧基硅烷、多聚赖氨酸及抗原修复液均购自北京中杉金桥生物技术有限公司;兔抗人VEGF多克隆抗体购自英国Abcam公司。
1.2 实验方法
1.2.1 肝癌SMMC-7721细胞裸鼠皮下移植瘤模型的建立:调整肝癌SMMC-7721细胞浓度1×107/mL,选取裸鼠右前肢皮下为接种部位进行消毒,用1 mL注射器斜行前行一段距离进入右前肢皮下,将200 μL单细胞悬液缓慢注入接种部位。
1.2.2 动物分组及治疗:2周后,当裸鼠肿瘤体积达到50~100 mm3后,将20只造模成功的裸鼠随机随机分为4组并标记(n=5),分别接受瘤内注射治疗:空白组(50 μL PBS)、TRAIL组(50 μL,100 ng/mL TRAIL)、shRNA-CXCR7(50 μL 3.85×108pfu/mL shRNA-CXCR7)组和TRAIL+shRNA-CXCR7组。
一手固定裸鼠,使移植瘤充分暴露,消毒移植瘤部位皮肤(75%酒精),持微量进样器于裸鼠移植瘤瘤内行多点注射。
对各组荷瘤鼠用卡尺在体测量瘤体长短径后进行瘤体内注射,1次/7 d。瘤体体积计算公式为:length×width2/2。第5次注射治疗后1周处死全部裸鼠,小心剥离肿瘤并进行瘤体质量称量。
1.2.3 免疫组化检测VEGF的表达:每例肿瘤标本切取1 cm×1 cm×0.3 cm后经10%福尔马林液固定,常规石蜡包埋切片。37 ℃过夜,干燥。将纯甲醇 99 mL,30%H2O21 mL 充分混匀,然后放置切片于混合液中30 min。PBS洗涤切片;处理后的切片先用蒸馏水洗一次5 min,再用PBS洗3次,每次5 min。用山羊非免疫正常血清孵育切片;使用1:1000兔抗人VEGF多克隆抗体孵育切片60 min。PBS洗涤切片3次,每次5 min。使用山羊抗兔的二抗(稀释倍数1:200)室温下保湿盒内孵育60 min。用PBS洗涤切片3次,每次5 min,滴加SP试剂,PBS洗涤切片3次,每次5 min。DAB显色:使用事先配好的DAB显色液,在显色前加入30% H2O2。将洗涤后的切片浸入显色液中10 min,闭光下反应,并在显微镜下观察颜色至棕色后,自来水洗涤切片,终止显色;用苏木素做核复染; 切片脱水、透明,树胶封片。每张切片镜下取5 个高倍镜视野(×400)进行观察,胞浆内棕褐色染色为VEGF阳性表达。
1.2.4 Western blot检测VEGF蛋白的表达:提取各组肿瘤标本200 mg后,提取总蛋白,测定蛋白浓度,蛋白质变性上样,10%SDS-PAGE胶上电泳,转印架上铺“三明治”, 100 V,2 h转膜,丽春红染色,脱脂奶粉封闭液封闭1 h,将 PVDF 膜放入稀释好的一抗中(稀释度为1:250),4 ℃过夜,次日取出PVDF膜泡在TBST中摇床清洗(5 min/次×3次),放入已稀释好的二抗(1:2000),室温,摇床2 h,ECL显影。应用Image J软件进行灰度值分析。

2 结果
2.1 shRNA-CXCR7和/或TRAIL对肝癌裸鼠移植瘤生长的影响
2.1.1 移植瘤体积变化:当肿瘤细胞裸鼠皮下接种1周时,出现可测量的实体肿瘤,2周时瘤体体积达到50~100 mm3,20只裸鼠皮下移植瘤成瘤造模过程中未出现死亡,造模成功率为100%。随机将20只裸鼠分为4组,每组5只。
空白组、TRAIL组、shRNA-CXCR7组和TRAIL+shRNA-CXCR7组肿瘤平均体积(每组5只)分别为:(89.07±8.98)、(90.17±11.63)、(92.95±7.89)和(89.59±13.43) mm3,各组间治疗前肿瘤体积差异无统计学意义(F=0.130,P<0.05)。
各组分别在治疗开始的第7、14、21、28和35 d进行裸鼠瘤体体积在体测量,剔除空白组死亡的1只裸鼠数据(接受治疗后的第3天死亡)绘制移植瘤生长曲线。结果发现:治疗开始到第7天,TRAIL组(173.90±30.55)、shRNA-CXCR7组(180.14±31.17)和TRAIL+shRNA-CXCR7组(143.21±14.39)均较空白组(216.41±21.79)肿瘤生长缓慢(F=6.08,P<0.05);从第14天一直到最后,TRAIL组移植瘤体积增长迅速与空白组间差异无统计学意义[14 d:(414.09±72.46)mm3vs (458.60±83.79)mm3,21 d:(715.95±142.58)mm3vs (723.72±136.63)mm3,28 d:(1053.77±188.32)mm3vs (1129.74±217.72)mm3,35 d:(1480.86±229.27)mm3vs (1560.69±201.97)mm3;均P<0.05],而shRNA-CXCR7组和TRAIL+shRNA-CXCR7组裸鼠移植瘤体积增长缓慢;35 d实验结束时,与空白组、TRAIL组、shRNA-CXCR7组[(1560.69±201.97)mm3、(1480.86±229.27)mm3、(1156.84±193.97)mm3]相比,TRAIL+shRNA-CXCR7组[(716.30±181.63)mm3]肿瘤体积增幅最小(F=17.00,P<0.05)。见图1。该结果表明,TRAIL和/或shRNA-CXCR7都可以在不同程度上抑制肿瘤的生长,但随着时间的延长,TRAIL抑制肿瘤增长的作用明显减弱。
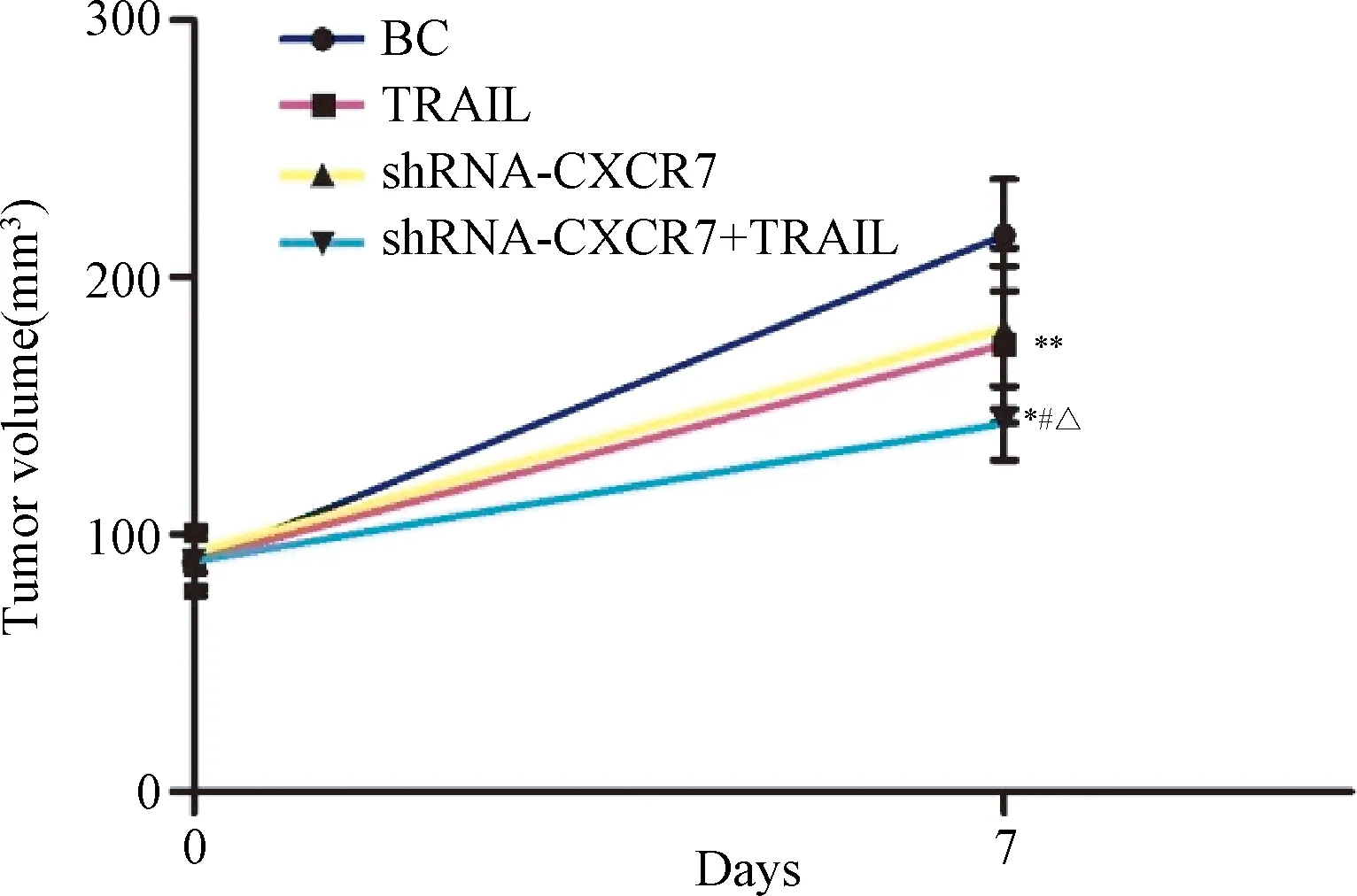

图1 肝癌SMMC-7721细胞裸鼠移植瘤生长曲线 (空白组n=4;其余3组n=5)治疗后7天和35天,*P<0.05,与空白组比较;#P<0.05, 与TRAIL组比较;△P<0.05,与shRNA-CXCR7组比较Fig.1 Growth curves of transplantation tumor of SMMC-7721 cell line in nude mice7 days and 35 days post-treatment,*P<0.05,compared with blank group:#P<0.05,compared with TRAIL group;△P<0.05, compared with shRNA-CXCR7 group
2.1.2 移植瘤体质量变化:所有裸鼠于成瘤后第35天全部处死,完整剥离移植瘤并进行称重。空白组(n=4)、TRAIL组(n=5)、shRNA-CXCR7组(n=5)和TRAIL+shRNA-CXCR7组(n=5)4组肿瘤瘤重分别为:(1.113±0.175)、(1.057±0.166)、(0.773±0.078)和(0.535±0.077)g。shRNA-CXCR7组、TRAIL+shRNA-CXCR7组肿瘤瘤重明显小于空白组和TRAIL组(F=20.30,P<0.05),其中TRAIL+shRNA-CXCR7组瘤体质量最轻(P<0.05)。
2.2 shRNA-CXCR7和/或TRAIL对肝癌裸鼠移植瘤瘤体内血管生成的影响
2.2.1 肝癌SMMC-7721裸鼠移植瘤免疫组化结果:VEGF阳性染色主要位于肿瘤细胞胞浆内棕黄色染色,在移植瘤组织中呈片状、弥漫性分布。空白组VEGF阳性表达较多,TRAIL组、shRNA-CXCR7组和TRAIL+shRNA-CXCR7组VEGF阳性表达均较少,以TRAIL+shRNA-CXCR7组表达最少。见图2。

图2 免疫组织化学检测肝癌SMMC-7721细胞裸鼠移植瘤VEGF的表达(×400)Fig.2 Expression of VEGF in transplantation tumor of SMMC-7721 cell line of nude mice by immunohistochemistry(×400)
2.2.2 肝癌SMMC-7721裸鼠移植瘤Western blot结果:TRAIL+shRNA-CXCR7组(5485.01±1354.08)较空白组(31335.01±2465.30)、TRAIL组(20900.86±2010.07)及shRNA-CXCR7组(17311.46±2676.14)更显著降低VEGF蛋白的表达(F=109.30,P<0.05)。其中空白组4只,其余组均5只。见图3。

图3 Western blot检测肝癌SMMC-7721细胞裸鼠移植瘤VEGF的表达Fig.3 Expression of VEGF in transplantation tumor of SMMC-7721 cell line of nude mice by Western blot
3 讨论
为了在体研究shRNA-CXCR7联合TRAIL对肝癌生物学行为的影响,本课题组首先建立了人肝癌SMMC-7721 细胞裸鼠皮下移植瘤模型。所选用的无胸腺的先天性T细胞免疫缺陷、缺乏免疫排斥反应的BALB/c 裸鼠20只,将细胞浓度为1×107/mL的肝癌SMMC-7721细胞悬液以200 μL/只接种于裸鼠右前肢皮下,2周后,裸鼠移植瘤模型造模成功率达到 100%(20/20),移植瘤形状多为圆形或椭圆形,包膜完整,与周边组织分界清楚,瘤体活动性良好。建立人肝癌SMMC-7721细胞裸鼠移植瘤模型技术的掌握和模型的成功构建,为后续研究肝癌生物治疗奠定了坚实的基础。
接下来随机将造模成功的20只裸鼠分为4组,分别在接受第一次注射治疗后的第7、14、21、28和35 d对裸鼠移植瘤体积进行在体测量,并绘制裸鼠移植瘤生长曲线,通过连续观察,本研究发现,治疗开始到第7天,TRAIL组、shRNA-CXCR7组和TRAIL+shRNA-CXCR7组均较空白组肿瘤生长缓慢(P<0.05);而从第14天一直到最后,TRAIL组移植瘤体积增长迅速,说明TRAIL的重复作用及随着时间的延长,可使裸鼠移植瘤对TRAIL产生耐受。这与文献报道[11]的肝癌细胞系对TRAIL诱导的凋亡具有耐受性,且TRAIL重复作用会导致肝癌细胞对TRAIL产生获得性抗性的研究结果相一致。但将TRAIL与shRNA-CXCR7联合应用时,其对肝癌SMMC-7721裸鼠移植瘤生长的抑制作用明显增强。通过体内实验证实了下调CXCR7的表达联合TRAIL可协同增强抑制裸鼠移植瘤的生长,增强了肝癌SMMC-7721裸鼠移植瘤对TRAIL的敏感性。
肿瘤的生长发展和侵袭转移离不开肿瘤血管生成,抑制血管生成能有效地控制肿瘤的进展,已逐渐成为一种肿瘤靶向治疗的主要手段[12]。促进血管生成因子与抑制血管生成因子失衡,是促进肿瘤新生血管发生与肿瘤生长的关键因素[13]。有研究表明[14],肿瘤生长需要血管提供营养,没有血管供血肿瘤不会长大,它只能生长至最大体积2~3 mm3。VEGF作为一种关键的、功能强大的肿瘤血管生成刺激因子发挥着中枢性的调控作用,参与多种生物学效应,与肝癌的发生发展密切相关[15]。因此,本研究运用免疫组化和Western blot等方法检测移植瘤组织中VEGF的表达,结果发现,当TRAIL与shRNA-CXCR7联合应用时,该组移植瘤中VEGF表达明显减少(P<0.05)。说明下调CXCR7联合TRAIL可以明显降低VEGF的表达,减少肝癌SMMC-7721细胞裸鼠移植瘤的血管生成,抑制移植瘤的生长进展。
[1] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015,136(5):E359-386.
[2]El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J].Gastroenterology,2007,132(7):2557-2576.
[3]Shen YN,Lu JH.Molecular targeted therapy for hepatocellular carcinoma [J].J Clin Hepatol,2015, 31(1):130-134.
[4]Colombo R,Moll J.Target validation to biomarker development:focus on RNA interference[J].Mol Diagn Ther,2008,12(2):63-70.
[5]Wiley SR,Schooley K,Smolak PJ,et al.Identification and characterization of a new member of the TNF family that induces apoptosis[J].Immunity,1995,3(6):673-682.
[6]Fayyaz S,Yaylim I,Turan S,et al.Hepatocellular carcinoma:targeting of oncogenic signaling networks in TRAIL resistant cancer cells[J].Mol Biol Rep,2014,19(37):689-695.
[7]Wang G,Zhan Y,Wang H,et al.ABT-263 sensitizes TRAIL-resistant hepatocarcinoma cells by downregulating the Bcl-2 family of anti-apoptotic protein[J].Cancer Chemother Pharmacol, 2012, 69(3):799-805.
[8]Yu Y,Li H,Xue B,Jiang X,et al.SDF-1/CXCR7 Axis Enhances Ovarian Cancer Cell Invasion by MMP-9 Expression Through p38 MAPK Pathway[J].DNA Cell Biol,2014,33(8):543-549.
[9]Burns JM,Summers BC,Wang Y,et al.A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival,cell adhesion,and tumor development[J].J Exp Med,2006,203(9):2201-2213.
[10]Wang J,Shiozawa Y,Wang J,et al.The role of CXCR7/RDC1as a chemokine receptor for CXCL12/SDF-1 in prostate cancer[J].J BiolChem,2008,283(7):4283-4294.
[11]张磊磊,王坚.肿瘤坏死因子相关凋亡诱导配体抗肿瘤作用研究进展[J].中华实用诊断与治疗杂志,2013,27(7):629-631.
[12]Doan C,Le L,Hoang S,et al.Simultaneous silencing of VEGF and KSP by siRNA cocktail inhibits proliferation and induces apoptosis of hepatocellular carcinoma Hep3B cells[J].Biol Res,2014,47(1):70-74.
[13]Llovet JM.Focal gains of VEGFA:candidate predictors of sorafenib response in hepatocellular carcinoma [J].Cancer Cell,2014,25(5):560-562.
[14]邹文萍,唐国强,李光明.VEGF及其受体的生物学特性[J].四川生理科学杂志, 2012,34(3):123-126.
[15]Liu Z,Dai H,Jia G,et al.Insufficient radiofrequency ablation promotes human hepatoma SMMC7721 cell proliferation by stimulating vascular endothelial growth factor over-expression[J].Oncol Lett,2015, 9(4):1893-1896.
(编校:王俨俨)
Effect of shRNA-CXCR7 combined with TRAIL on subcutaneous transplantation tumor of SMMC-7721 cell line in nude mice
WANG Gang1, CHENG Xue2Δ, ZHANG Xiang-lin1, DONG Fu-ren1
(1. Department of Radiology, The First Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, China; 2. Department of Neurology, The First Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo investigate the effect of C-X-C chemokine receptor type 7 (CXCR7) gene silencing combined with TNF related apoptosis inducing ligand (TRAIL) on the growth of human hepatocellular carcinoma SMMC-7721 cells in nude mice.MethodsThe subcutaneous transplanted tumor model of hepatoma cell line SMMC-7721 in nude mice was established. After two weeks, the 20 successful nude mice models were randomly divided into four groups (n=5) and marked when the tumor volume of nude mice reached 50-100 mm3:blank group, TRAIL group, shRNA-CXCR7 group and TRAIL+shRNA-CXCR7 group that
intratumoral injection therapy respectively. The tumor sizeinvivoby calipers was measured every 7 days and the growth curve of transplanted tumor in nude mice was drawed. All nude mice were killed after the fifth injection treatment and weighted the tumor of each group. The expression of vascular endothelial cell growth factor (VEGF) in transplanted tumor tissues was detected by immunohistochemistry and Western blot.ResultsCompared with the blank group, the tumor of the TRAIL group, shRNA-CXCR7 group and TRAIL+shRNA-CXCR7 group growed slowly on 7thday (P< 0.05). From the 14thday until the 35thday, the tumor volume of the TRAIL group growed rapidly, there was no statistical significance between TRAIL group and blank group, while the tumor volume of shRNA-CXCR7 group and TRAIL+shRNA-CXCR7 group still growed slowly. At the end(on the 35thday), the tumor volume of TRAIL+shRNA-CXCR7 group increase minimum, and there were statistical significance compared with other groups(P< 0.05). The average tumor weight of shRNA-CXCR7 group and TRAIL+shRNA-CXCR7 group were significantly smaller than those of blank group and TRAIL group, and the weight of TRAIL+shRNA-CXCR7 group was the lightest(P<0.05). Immunohistochemistry and Western blot results: the positive expression of VEGF in TRAIL group, shRNA-CXCR7 group and TRAIL+shRNA-CXCR7 group were lower than that in blank group, and the TRAIL+shRNA-CXCR7 expression minimum(P<0.05).ConclusionDown-regulation of CXCR7 combined with TRAIL could significantly inhibit the growth of subcutaneous transplantation tumor of SMMC-7721 cell line in nude mice through regulating the expression of VEGF.
hepatocellular carcinoma; CXCR7; TRAIL; VEGF; nude mice
辽宁省自然科学基金(2015020335);辽宁医学院校长基金(XZJJ20130231)
王刚,男,博士,主治医师,研究方向:肿瘤的影像诊断与介入治疗,E-mail:wgcx1437@163.com。
R735.7
A
1005-1678(2016)01-0028-04
