红杜仲不同乙醇浓度提取物对HaCaT细胞抗氧化作用的比较及其抗氧化机制的研究
2016-07-10彭璐金鑫李志群连一江张丹夏智波
彭璐,金鑫,李志群,连一江,张丹,夏智波
(1.厦门大学 医学院,福建 厦门 361102;2.厦门市手性药物重点实验室,福建 厦门 361102; 3.厦门大学附属第一医院 心内科,福建 厦门 361003)
红杜仲不同乙醇浓度提取物对HaCaT细胞抗氧化作用的比较及其抗氧化机制的研究
彭璐1,2,金鑫1,2,李志群1,2,连一江1,2,张丹1,3,夏智波1Δ
(1.厦门大学 医学院,福建 厦门 361102;2.厦门市手性药物重点实验室,福建 厦门 361102; 3.厦门大学附属第一医院 心内科,福建 厦门 361003)
目的 本研究对红杜仲不同乙醇浓度提取物抑制H2O2诱导的HaCaT细胞氧化应激损伤作用进行筛选。方法 以不同浓度乙醇进行回流提取分别获得了30%、50%、70%及95%乙醇提取的四种红杜仲醇提取物(Parabarium micranthum ethanol extract,PEE),利用1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)法测定其体外清除自由基的能力。以人永生化表皮细胞HaCaT为研究对象,通过不同浓度H2O2处理细胞并筛选以200 μmol/L作为建立H2O2诱导的氧化应激损伤模型的最适浓度。设立对照组、H2O2损伤组和红杜仲-H2O2组。通过微板法和比色法测定内源性抗氧化酶活力及细胞存活率,2’,7’-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针检测细胞内氧自由基(reactive oxygen species,ROS)水平,逆转录PCR测定Nrf2 mRNA表达量。结果 不同乙醇浓度提取的PEE在体外均具有清除DPPH自由基的作用,效果最强的70% 乙醇提取的PEE的IC50为7.6 mg/L;在细胞水平上,H2O2诱导使得HaCaT细胞内抗氧化酶SOD及CAT活力降低,50%、70%及95%乙醇提取的PEE能够显著提高细胞内抗氧化酶活力。其中70%乙醇提取的PEE的作用最为显著,抗氧化酶活力的提高表现出剂量依赖性,并且能显著提高细胞存活率、降低细胞内ROS的水平(与氧化应激组比,P<0.05或P<0.01)。同时,70%乙醇提取的PEE能够显著诱导抗氧化相关信号通路基因Nrf2 mRNA的表达。结论 70%乙醇提取的PEE可能通过激活Nrf2抗氧化信号通路,提高抗氧化酶活性,降低ROS水平,从而具有保护HaCaT细胞免受H2O2诱导的氧化损伤作用。
红杜仲;抗氧化机制;HaCaT细胞
红杜仲为夹竹桃科杜仲藤属植物杜仲藤(Parabariummicranthum(A.DC.)Pierre)、红杜仲藤(P.chunnianumTsiang)、毛杜仲藤(P.huaitingiiChunetTsiang)及花皮胶藤属花皮胶藤(EcdysantherautilisHay.etKaw.)的老茎皮和根皮的通称[1]。红杜仲味苦、微辛,具有祛风湿、强筋骨的功能[2],是我国华南地区民间常用的草药之一。研究表明,红杜仲含有黄酮类、酚类、生物碱等有效成分[3-5],这使得其在抗氧化、降血脂等方面具有潜在的应用前景。但是到目前为止,关于红杜仲在细胞水平上的抗氧化活性缺乏深入的研究:一方面是对不同乙醇浓度回流提取工艺下的抗氧化能力差异缺乏有效的比较;另一方面是对红杜仲的抗氧化机制没有深入的研究。本研究将在HaCaT细胞中对红杜仲不同乙醇提取物的抗氧化能力进行筛选,并探讨其抗氧化机制。
1 材料与方法
1.1 材料
1.1.1 提取物制备:红杜仲购自厦门鹭燕医药有限公司。取红杜仲30 g,晾干后,加入480 mL95%乙醇浸泡40 min,85 ℃水浴回流提取2 h,过滤,将滤液置于旋转蒸发仪中减压回收乙醇后得到粗浸膏,将粗浸膏置于零下80 ℃结冰后用冷冻干燥机进行干燥,备用。用同样的方法制备30%乙醇提取物、50%乙醇提取物、70%乙醇提取物。
1.1.2 试剂:MTS购自Promega公司;DCFH-DA和过氧化氢(3%)均购自Sigma-Aldrich公司;SOD和CAT试剂盒购自南京建成生物科技有限公司;BCA试剂盒购自北京普利莱基因技术有限公司;PIPA裂解液购自北京索莱宝科技有限公司;Nrf2和GAPDH引物购自Takara公司;逆转录试剂盒及Dream TaqTMGreen PCR Master Mix(2X)购自Fermentas公司。
1.1.3 仪器:旋转蒸发仪(上海爱朗仪器有限公司);SHB-IIIA循环水式多用真空泵(郑州长城科工贸有限公司);多功能酶标仪 SpectraMax M2(美国Molecular Devices);多功能粉碎机(永康市小宝电器有限公司);冷冻干燥机(北京博医康实验仪器有限公司);Ti-S型倒置荧光显微镜(日本Nikon);Bio-Rad电泳系统(美国Rio-Rad);PCR仪(德国biometre)。
1.2 方法
1.2.1 HaCaT细胞的培养及氧化损伤模型的建立:HaCaT细胞购自美国菌种保藏中心。采用含10%FBS,1%青、链霉素的MEN培养液,于37 ℃,含5%CO2,饱和湿度条件下的细胞培养箱中培养。细胞为单层贴壁生长,根据细胞生长情况换液,以0.25%胰酶消化传代。
取对数生长期细胞接种96孔板,培养24 h后,加入含不同浓度PEE的培养液,对照组只加培养液,之后继续培养24 h。MTS法测定各孔吸光值(A),并按照如下公式计算细胞的存活率,以细胞存活率≥90%作为标准确定红杜仲对细胞的安全浓度。
细胞存活率=A处理/A对照×100%。
取对数生长期细胞接种96孔板,培养24 h后,加入含不同浓度的H2O2(0, 10, 50, 100, 200, 400, 600, 800, 1000 μmol/L),对照组只加培养液,继续培养24 h。MTS法测定各孔的吸光值,计算细胞存活率以筛选H2O2作用于细胞的损伤浓度,建立氧化损伤模型。
1.2.2 DPPH自由基清除活性的检测:DPPH自由基清除活性的检测根据Brand-Williams的方法[6]。不同浓度的PEE与DPPH醇溶液1:1混合,室温暗处孵育30 min后测定样品在517 nm处的吸光值(A)。按如下公式计算。
DPPH清除率=[A对照-(A样品-A调零)]/A对照×100%。
其中A调零为样品与不含DPPH的醇溶液的测定值,每份样品测定4个复孔并取平均值。为了计算样品的IC50,PEE至少选定5个不同浓度进行测定,通过线性拟合进行计算分析。该实验独立重复测定3次。
1.2.3 细胞内SOD、CAT活力及蛋白含量的测定:取对数期细胞接种6孔板,接种密度为2× 105/孔。分组:对照组、H2O2损伤组、红杜仲-H2O2组。24 h后红杜仲-H2O2组给予不同浓度的PEE(2.5、5、10 mL)。继续培养24 h后,H2O2损伤组、红杜仲-H2O2组加入1.2.1选出的H2O2损伤浓度,对照组加入新鲜培养液。继续培养24 h后,PBS洗3次,用细胞刮刀刮下细胞,用RIPA裂解液冰上裂解30 min后,12000 r/min离心10 min,取上清,BCA法测定蛋白含量。按照试剂盒说明分别测定SOD、CAT酶活力。该实验独立重复测定3次,结果以相对于对照组的百分比表示,计算公式:酶活力=A处理/A对照×100%。
1.2.4 MTS法检测细胞存活率:取对数生长期细胞接种96孔板,分组及处理方法同1.2.3,所选择的PEE及其浓度由1.2.2及1.2.3确定。MTS法测定各孔吸光值,计算细胞存活率。该实验独立重复测定3次,结果以相对于对照组的百分比表示。
1.2.5 细胞内ROS水平的检测:前处理同2.3,培养结束后,PBS洗3次,加入25 μmol/L的DCFH-DA孵育30 min后用PBS洗3次。其中一组在荧光显微镜下进行拍照观察;另外一组用细胞刮刀将细胞刮入1% Triton X-100后,BCA法测定蛋白含量,测定样品在488 nm激发光、520 nm发射光下的吸光值,荧光强度表示为吸光值相对于蛋白含量的比值。该实验独立重复测定3次,结果以相对于对照组的百分比表示,英光强度=A各组/蛋白浓度。
1.2.6 逆转录PCR检测HaCaT细胞Nrf2 mRNA表达:前处理同2.3,Trizol提取细胞总RNA,按照逆转录试剂盒说明逆转录为cDNA。以cDNA为模板进行PCR扩增,目的基因Nrf2序列为F:5’-AACCAGTGGATCTGCCAAC-3’;R:5’-GACCGGG-AATATCAGGAACA-3’。内参基因GAPDH序列为F:5’-GGCATG-GCCTTCCGTGTCCC-3’;R:5’-TGCCAGCCCCAGCGTCAAAG-3’。PCR条件为:95 ℃ 3 min,95 ℃ 30 s,退火60 ℃ 30 s,延伸72 ℃ 45 s(共33个循环),72 ℃ 10 min,4 ℃暂停。取PCR产物进行2%琼脂糖凝胶电泳,用凝胶成像系统拍照。用ImageJ软件对条带亮度进行分析,取目的基因灰度值与内参基因灰度值的比值。该实验独立重复测定3次,结果以相对于对照组的百分比表示。
2 结果
2.1 不同乙醇浓度提取的PEE的安全浓度范围及H2O2损伤浓度的确定 在0 mg/L~10 mg/L浓度范围内,30%、50%、70%及95%乙醇提取的PEE作用于HaCaT细胞的存活率≥90%。因此,在该浓度范围内PEE对细胞安全(图1)。HaCaT细胞存活率与H2O2作用浓度呈负相关,当H2O2浓度为200 μmol/L时,细胞存活率降至最低,以此浓度建立氧化损伤模型。
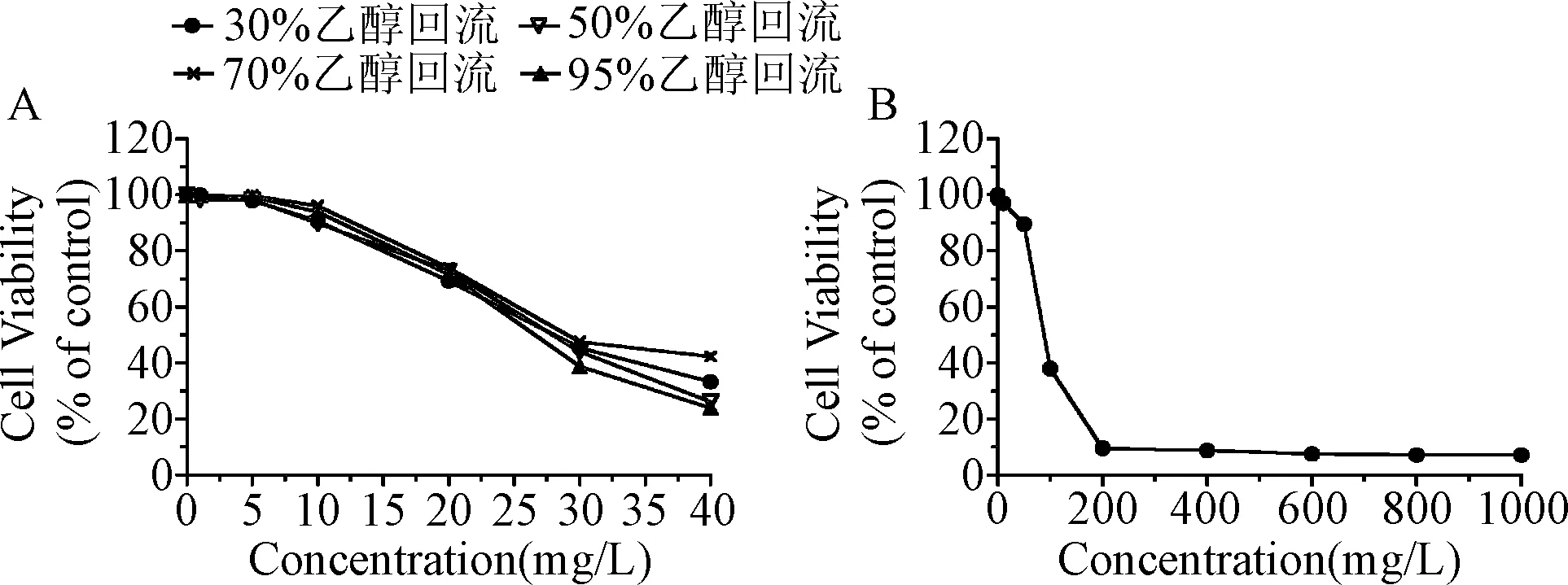
图1 不同乙醇浓度提取的PEE(A)和不同浓度过氧化氢(B)对HaCaT细胞存活率的影响Fig.1 Effect of different ethanol extracts of PEE (A) and different
2.2 不同乙醇浓度提取的PEE的DPPH自由基清除活性 红杜仲30%、50%、70%及95%醇提物的DPPH自由基清除的IC50分别为8.2 mg/L、11.5 mg/L、7.6 mg/L及8.1 mg/L,其中70%醇提取的DPPH清除力最强。该实验独立重复测定3次。
2.3 不同乙醇浓度提取的PEE对细胞内抗氧化酶SOD及CAT活性的影响 结果表明(图2):与对照组相比,H2O2损伤组的细胞内SOD酶活力及CAT酶活力均极显著下降(P<0.01);与H2O2损伤组相比,50%、70%及95%乙醇提取的PEE的加入能够显著提高细胞内SOD酶活力,而红杜仲70%及95%乙醇提取的PPE的加入能够显著提高细胞内CAT酶活力,其中70%乙醇提取的PEE效果最为明显,在2.5 mg/L~10 mg/L范围内均能够极显著提高细胞内SOD酶活力(P<0.01),而在5 mg/L~10 mg/L范围内也能够极显著提高细胞内CAT酶活力(P<0.01),结果均表现出明显的剂量依赖性。由以上结果可知,70%乙醇提取的PEE具有最好的抗氧化效果。

图2 不同乙醇浓度提取的PEE对HaCaT细胞内SOD及CAT活力的影响1:对照组;2:H2O2损伤组;3:2.5 mg/L红杜仲-H2O2组;4:5 mg/L/红杜仲-H2O2组; 5:10 mg/L红杜仲-H2O2组*P<0.01,与对照组比较;#P<0.05,##P<0.01,与H2O2损伤组比较Fig.2 Effect of different ethanol extracts of PEE on the SOD and CAT activities in 1: control group; 2:H2O2 injury group; 3:2.5 mg/L PEE-H2O2 group; 4:5 mg/L PEE-H2O2 group; 5:10 mg/L PEE-H2O2 group*P<0.01,compared with control group post-treatment;#P<0.05,##P<0.01,compared with H2O2 damage group
2.4 红杜仲70%醇提物对细胞存活率的影响 200 μmol/LH2O2处理细胞24 h后引起细胞存活率的极显著下降(P<0.01)。红杜仲70%醇提物可有效防止H2O2对细胞的损伤,与H2O2损伤组相比,2.5、5和10 mg/L的醇提物均能提高细胞的存活率(P<0.05或P<0.01),并且呈浓度依赖的趋势。见表1。
表1 70%乙醇提取的不同浓度的PEE对氧化应激状态下HaCaT细胞的影响
*P<0.05,与对照组比较,compared with control group;#P<0.05,##P<0.01,与H2O2损伤组比较,compared with H2O2injured group
2.5 红杜仲70%醇提物对细胞内ROS水平的影响 200 μmol/L H2O2处理细胞24 h后引起细胞内荧光强度的极显著提高(P<0.01),说明造模引起HaCaT细胞内的ROS水平的升高。红杜仲70%醇提物可显著降低受损HaCaT细胞内的ROS水平(P<0.01),且呈浓度依赖的趋势(见表1)。荧光显微镜下的观察结果与上述结果一致。见图3。

图3 DCFH-DA荧光染色后HaCaT细胞内ROS的变化(×200)Fig.3 Comparison of ROS in HaCaT cells with DCFH-DA fluorescence staining (×200)
2.6 红杜仲70%醇提物对Nrf2 mRNA表达量的影响 由逆转录PCR结果可看出(图4),H2O2的诱导使得细胞内Nrf2 mRNA的表达水平相比对照组极显著下调(P<0.01);与H2O2损伤组相比,2.5、5和10 mg/L的醇提物均能显著提高Nrf2 mRNA的表达量(P<0.05或P<0.01),且呈剂量依赖性。

图4 70%乙醇提取的PEE对氧化应激HaCaT细胞的Nrf2 mRNA表达的影响1:对照组;2:H2O2损伤组;3:2.5 mg/L红杜仲-H2O2组;4:5 mg/L/红杜仲-H2O2组;5:10 mg/L红杜仲-H2O2组**P<0.01,与对照组比较;#P<0.05,##P<0.01,与H2O2损伤组比较Fig.4 Effect of different concentrations of PEEextract by 70% ethanolon Nrf2 mRNA expression of HaCaT cells under oxidative ±s,n=3)1: control group; 2:H2O2 injury group; 3:2.5 mg/L PEE-H2O2 group; 4: 5 mg/L PEE-H2O2 group; 5:10 mg/L PEE-H2O2 group**P<0.01,compared with control grouppost-treatment;#P<0.05,##P<0.01,compared with H2O2 damage group
3 讨论
氧自由基对生命而言必不可少,其在诸如抵抗病原体、调节信号过程及坏死等生理活动中发挥着重要的作用[7]。一旦体内氧自由基的平衡被打破,所造成的氧化损伤会对人体造成极大的危害[8]。皮肤作为连接人体与外界环境的媒介,极易暴露于污染物、紫外等理化损伤中,导致有害的氧自由基的积累并引起氧化损伤[9]。因此利用人表皮细胞作为研究对象进行抗氧化研究对药物抗氧化效果的筛选及机制研究具有重要的参考价值。
为了清除或者降低氧自由基所造成的损伤,细胞进化出了一系列复杂的抗氧化机制,其中就包括了抗氧化酶系统,比如超氧化物歧化酶(SOD)和过氧化氢酶(CAT)。本实验结果表明H2O2导致HaCaT细胞内SOD及CAT酶活力显著降低(P<0.01),提示H2O2导致HaCaT细胞发生氧化应激损伤。而红杜仲不同乙醇浓度提取物对H2O2所致的保护能力存在差异,其中70%乙醇提取物的效果最为明显,不仅SOD及CAT的酶活力得到提高,细胞的存活率也获得显著的提升(同H2O2损伤组比,P<0.05或P<0.01),能够使细胞的氧化应激损伤趋于正常。
在氧化应激损伤下,氧化系统与抗氧化系统失衡导致细胞内的氧自由基积累过多[10]。因此,ROS的生成量可以直接反应细胞内的氧化应激损伤程度。从本实验检测的ROS荧光读值及荧光照片均可看出,H2O2可以使细胞内ROS水平极显著升高(P<0.01),而红杜仲70%乙醇提取物的保护则可使其降低至正常水平(与H2O2损伤组比,P<0.01),进一步表明红杜仲70%乙醇提取物对HaCaT细胞氧化应激损伤具有保护作用。
Nrf2-Keap1-ARE信号通路是调节体内抗氧化系统的重要信号途径之一。Nrf2是亮氨酸拉链家族的调节抗氧化反应的重要转录因子,几乎在所有组织中均有表达,Keap1是其特异性受体[11]。在正常状态下Nrf2与Keap1结合,功能受到抑制;在氧化应激状况下,Nrf2与Keap1解离,通过bZIP与小Maf蛋白形成的异二聚体识别ARE上的基因序列并与之结合从而启动靶基因的转录[12]。本研究发现H2O2可导致细胞Nrf2 mRNA水平的降低(与对照组比,P<0.01),而70%乙醇提取的PEE能够诱导HaCaT细胞内Nrf2 mRNA表达水平的显著上调(与H2O2损伤组比,P<0.01),且呈现出剂量依赖性。推测70%乙醇提取的PEE可能是通过调控HaCaT细胞内Nrf2相关的抗氧化通路,上调相关抗氧化酶的表达与活力以清除细胞内的氧自由基,从而防止HaCaT细胞遭受氧化应激损伤。
综上所述,利用70%乙醇回流提取工艺提取的红杜仲组分具有最好的抗氧化效果,该部分提取物的抗氧化效果可能与Nrf2相关的抗氧化通路的激活有关。而该组分的进一步细分、提纯以及其的抗氧化调控机制还有待进一步探索。
[1] 黄燮才,周珍诚,韦家福.中药红杜仲原植物的鉴定[J].广西植物,1984,4(1):48.
[2]广西壮族自治区卫生厅.广西中药材标准:1990年版[S].广西科学技术出版社,1992:51-52.
[3]韦松,思秀玲,许学健.藤杜仲化学成分初探[J].广西中医学院学报, 2000,117(2):42.
[4]毕和平,韩长日,陈明松.光度法测定杜仲藤中总黄酮[J].理化检验-化学分册,2008,44(5):453-454.
[5]梁丹,李志伟,李明,等.天然生物碱的研究与应用[J].安徽农业科学,2007,35(35):11340-11342.
[6]Brand WW, CuvelierME, BersetC. Use of a free-radical method to evaluate antioxidant activity [J]. LWT-Food Science and Technology, 1995, 28(1): 25-30.
[7]Halliwell B, Gutteridge JMC. Free radicals in biology and medicine[M]. Oxford: Oxford university press, 1999.
[8]Gasperlin M, Gosenca M.Main approaches for delivering antioxidant vitamins through the skin to prevent skin ageing[J]. Expert Opin Drug Deliv, 2011, 8(7): 905-919.
[9]Bickers DR, Oxidative stress in the pathogenesis of skin disease[J]. JInvest Dermatol, 2006, 126(12): 2565-2575.
[10]Kaur S, Singh HP, Batish DR,et al.Artemisia scoparia essential oil inhibited root growth involves reactive oxygen species (ROS)-mediated disruption of oxidative metabolism: in vivo ROS detection and alterations in antioxidant enzymes[J]. BiochemSystEcol, 2012, 44: 390-399.
[11]Nioi P, Mcmahon M, Itoh K, et al. Identification of a novel Nrf2-regulated antioxidant response element (ARE) in the mouse NAD (P) H: quinone oxidoreductase 1 gene: reassessment of the ARE consensus sequence[J]. BiochemJ, 2003, 374: 337-348.
[12]Takagi Y, Kobayashim, Li L, et al. MafT, a new member of the small Maf protein family in zebrafish[J]. Biochembiophys rescommun, 2004, 320(1): 62-69.
(编校:谭玲)
《中国生化药物杂志》-征订函
《中国生化药物杂志》于1976年创刊,一直秉承“基础与临床结合、普及与提高并重”的原则,报道有关生化药物的基础与临床研究最新进展,并以“促进我国生化药物医学的健康发展及深化国际学术合作与交流”为己任。本刊目前为中文核心期刊;被《美国化学文摘》、《中国生物学文摘》、《中国药学文摘》等重要检索系统收录;其主管单位是无锡日报报业集团,主办单位是无锡锡报期刊传媒有限公司;由《中国生化药物杂志》编辑部和北京数字医视文化传媒有限公司出版发行。本刊的国际标准刊号ISSN 1005-1678,国内统一刊号CN 32-1355/R,邮发代号28-233。
征订电话:010-84280076转8711 传真:010-84662099
网址:www.cbcpharm.com
地址:北京市朝阳区芍药居38号楼3层《中国生化药物杂志》编辑部 邮编:100029
Research on the antioxidant capacity ofParabariummicranthumextracted by different ethanol concentrations and its antioxidant mechanism on HaCaT cells
PENG Lu1,2, JIN Xin1,2, LI Zhi-qun1,2, LIAN Yi-jiang1,2, ZHANG Dan1,3, XIA Zhi-bo1Δ
(1.Medical College, Xiamen University, Xiamen 361102, China; 2.Xiamen Municipal Key Laboratory of Chiral Drugs, Xiamen 361102,China; 3. Department of Internal Medicine Cardiology,The First Affiliated Hospital of Xiamen university, Xiamen 361003,China)
ObjectiveThe aim of this research was to screen the antioxidant capacity of Parabarium micranthum extract of various ethanol concentrations against H2O2-induced oxidative stress in HaCaT cells.MethodsParabarium micranthum extracts reflux purified with 30%, 50%, 70% and 95% ethanol (PEE) were objected to screening for their free radical scavenging capacities in vitro by DPPH.Cultured HaCaT human keratinocytes were randomly assigned to control, H2O2and PEE+ H2O2groups.The cultured HaCaT cells were treated with different concentrations of H2O2and 200 μmol/L H2O2was selected to establish H2O2-induced oxidative stress model.For the PEE+ H2O2group, the cells were treated with PEE extracts of various ethanol concentrations before exposure to H2O2.Endogenous antioxidant enzyme activity and cell viability were detected by microplate assay and colorimetric method.Intracellular reactive oxygen species (ROS) were detected by DCFH-DA fluorescent probe.Nrf2 mRNA expression was evaluated by reverse transcription PCR.ResultsAll PEE extracts of various ethanol concentrations showed effective DPPH free radical scavenging capacities of which the 70% ethanol PEE extract exhibited the strongest scavenging activity (IC50=7.6 mg/L).H2O2treatments induced oxidative stress in HaCaT and thus caused a decrease in antioxidant enzyme activities of SOD and CAT.However, the PEE extracts of 50%, 70% and 95% ethanol could observably increase the enzyme activity of SOD and CAT.Among these, the 70% ethanol extracted PEE showed significant effect on enzyme activities in a dose-dependent manner.It could also obviously improve the cell viability and reduce the intracellular ROS level (compared with oxidative stress group,P<0.05 orP<0.01).In addition, 70% ethanol extracted PEE could remarkably enhance the expression of Nrf2 mRNA, a gene that regulates the anti-oxidative signaling pathway.ConclusionThe findings of the present study suggest that 70% ethanol extracted PEE can attenuate H2O2-induced oxidative damage, which functions via the regulation of the Nrf2-related anti-oxidative signaling pathway, enhancement of the antioxidant activity of SOD and CAT, and reduction of ROS level.
Parabarium micranthum; antioxidant mechanism; HaCaT cell
彭璐,女,硕士,助理实验师,研究方向:心血管药理,E-mail:penglu@xmu.edu.cn;夏智波,通信作者,男,硕士,副教授,研究方向:中医药研究,E-mail:xiazhibo@xmu.edu.cn
R965
A
1005-1678(2016)01-0023-05
