HPV—DNA分型检测在宫颈癌筛查中的应用价值分析
2016-07-09程俊
程俊

【摘要】 目的:探讨HPV-DNA分型检测在宫颈癌筛查中的应用价值。方法:选取2014年3月-2015年3月笔者所在医院肿瘤科收治的宫颈癌患者342例作为研究对象,342例患者分别给予宫颈液基细胞学检测(TCT)和HPV-DNA分型检测,所有患者均给予阴道镜下病理活检。比较TCT与HPV-DNA分型检测的检测率。结果:TCT检测为阳性149例,HPV-DNAT检测为阳性174例。HPV-DNA分型检测诊断符合率为87.36%(152/174),TCT检测诊断符合率为69.80%(104/149),TCT与HPV-DNA诊断符合率比较差异有统计学意义(P<0.05);在鳞状细胞(SCC)中检测为高危型100%(20/20),轻度不典型增生(CINⅠ)中检测高危型患者83.33%(65/78),中度不典型增生(CINⅡ)中检测高危型患者48.28%(14/29),重度不典型增生(CINⅢ)中检测低危型患者34.78%(8/23)。结论:HPV-DNA分型检测在宫颈癌筛查中的诊断价值较TCT高,可以显著提高诊断符合率,降低假阳性症状发生,使更多的女性患者可以及早确诊和治疗。
【关键词】 HPV-DNA分型检测; TCT; 宫颈癌; 诊断价值
中图分类号 R737.33 文献标识码 B 文章编号 1674-6805(2016)9-0087-02
doi:10.14033/j.cnki.cfmr.2016.9.048
宫颈癌是临床中常见的妇科恶性肿瘤疾病,其发病率仅次于乳腺癌[1]。临床研究显示,高危型HPV持续感染已成为引起宫颈癌的主要原因,且90%以上宫颈癌患者均伴有高危型HPV感染[2]。由于早期宫颈癌并无明显或异常体征和症状表现,宫颈表现为光滑或常难与宫颈柱状上皮异位进行区分,因此,颈管型患者常因宫颈外观并无异常而误诊或漏诊。在临床中常用的检测方法包括传统的宫颈涂片、宫颈液基细胞学检测(TCT)、HPV-DNA分型检测等[3]。随着医疗技术的发展,传统的宫颈涂片已经被TCT所代替,近年来关于TCT检测的相关文献较多,但HPV-DNA检测报告严重不足,就此本文将TCT与HPV-DNA诊断结果与病理活检结果进行比较,旨在探讨HPV-DNA分型检测在宫颈癌病变程度中的诊断价值。
1 资料与方法
1.1 一般资料
选取2014年3月-2015年3月笔者所在医院肿瘤科收治的宫颈癌患者342例作为研究对象,年龄22~65岁,平均(35.56±13.83)岁。排除标准:乙肝表面抗原为阳性患者和乙肝DNA阳性患者。纳入标准:经阴道检查发现有乳头样增生、宫颈糜烂、慢性宫颈炎、接触性溃疡、肥大或出血,无子宫切除史、宫颈切除史及盆腔放射治疗史。
1.2 诊断标准
1.2.1 TCT检测 用棉球将患者宫颈表面分泌物进行拭擦,如黏液、血液等,将分泌物放入液基细胞保存液中采用高精滤过膜进行过滤,将过滤后的细胞制成薄片,给予浓度为95%的酒精将其固定。细胞学诊断标准根据伯塞斯达宫颈细胞分类法(TBS)进行诊断,分为鳞状细胞癌(SCC)、正常范围内(WNL)、低度鳞状上皮内病变(LSIL)、非典型鳞状细胞(ASCUS)、高度鳞状上皮内病变(HSIL)[4]。
1.2.2 HPV-DNA分型检测 HPV-DNA收集标本与TCT相同,所有患者均给予潮州凯普生物化学有限公司生产的核酸分子快速杂交仪进行检测[5]。高危型HPV分型可分为8种,分别为16、18、31、33、45、51、52、58;低危型HPV分型可分为5种,分别为6、11、42、43、44;临床中将两种类型合并感染称为混合感染。
1.2.3 阴道镜下活检 阴道镜下多点活检可分为无上皮内病变或肿瘤细胞(NLM)、鳞状细胞(SCC)、CINⅢ、CINⅡ、CINⅠ。
1.3 统计学处理
所得数据使用SPSS 17.0进行处理,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
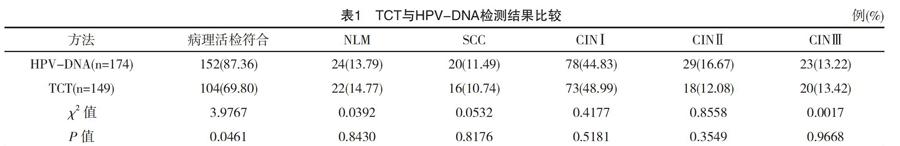
2.1 阴道镜活检、TCT与HPV-DNA检测结果比较
TCT检测为阳性149例,HPV-DNAT检测为阳性174例。HPV-DNA分型检测阳性诊断符合率为87.36%(152/174),TCT检测的阳性诊断符合率为69.80%(104/149),TCT与HPV-DNA诊断符合率比较差异有统计学意义(P<0.05),见表1。
2.2 阴道镜活检阳性与HPV分型检测比较
阴道镜活检鳞状细胞(SCC)中检测为高危型100%(20/20),轻度不典型增生(CINⅠ)中检测高危型患者83.33%(65/78),中度不典型增生(CINⅡ)中检测高危型患者48.28%(14/29),重度不典型增生(CINⅢ)中检测以低危型患者34.78%(8/23),见表2。
3 讨论
宫颈癌在早期并无明显临床症状和生命体征变化,宫颈癌病变是经过长期发展形成,在临床医学研究中,宫颈炎要从量变发展成为质变需要10年左右[6]。随着医疗事业的快速发展,宫颈癌筛选技术的迅速发展和普遍应用,宫颈癌病变和宫颈癌前病变得到了及时的诊断和有效治疗,大大降低了宫颈癌的发病率和死亡率。当前对于宫颈癌筛选的检测主要采取的是TCT,该检测方法具有较高的准确率,可以从患者宫颈深处取得细胞,但是该种诊断方式具有采样不够深入,容易出现遗留或漏诊等现象 [7],其诊断结果不太理想。
据临床医学研究资料显示,引发宫颈癌病变产生的主要因素与高危型HPV感染因素有密切联系,而90%左右的宫颈癌与HPV感染有关[8]。HPV-DNA分型检测具有杂交信号放大法、直接核酸探针法和靶DNA扩增法三种核酸杂交法,可有效提高宫颈癌筛选的准确性,降低假阳性情况的发生。在本研究中HPV-DNA分型检测在阴道镜下病理活检诊断的准确率为75.29%(131/174),明显高于TCT检测诊断准确率69.80%(104/149),表明其诊断价值较TCT检测高。
综上所述,HPV-DNA分型检测在宫颈癌筛选中的应用,可以明显提高诊断的准确率。但是本研究样本量较少,对于HPV-DNA分型检测和TCT检测之间的问题分析还存在不足,需要扩大量本进一步探讨。
参考文献
[1]闫琛,杨广英.郑州市女性HPV感染状况及基因型的分布情况调查[J].中外医学研究,2012,10(5):64-66.
[2]王学才,汤俊明.HPV联合TCT检测在宫颈疾病筛查中的应用[J].中外医学研究,2011,9(32):38-39.
[3]黄川英.液基细胞学与人乳头瘤状病毒联合检测分析对宫颈癌筛查的临床价值[J].中外医学研究,2011,9(35):6-8.
[4]周建风.外阴HPV感染患者中宫颈HPV分型检测分析[J].中外医学究,2012,10(2):52-53.
[5]王诗卓,王宁,魏恒,等.辽宁地区人乳头瘤病毒的感染状态及其高危基因型的分布情况[J].中国医科大学学报,2012,41(2):146-147.
[6]蔡玉品,张瑞芬,李源,等.采用PCR-测序法对北京地区325例妇女官颈脱落细胞样品中人乳头瘤病毒进行检测和基因分型[J].生物工程学报,2011,27(10):1482-1489.
[7]周娟,王泳晓,何志群,等.导流杂交HPV-DNA分型检测联合宫颈液基细胞学对宫颈癌前病变筛查的临床应用研究[J].实用中西医结合临床,2014,14(7):58-60.
[8]姚时贤,冯华英.HPV-DNA分型及SCCA在宫颈上皮内瘤样病变与宫颈癌中的检测和临床意义[J].中国妇幼保健,2013,28(11):1743-1746.
(收稿日期:2015-11-26)
