2-烷氧基-3-芳基-5-甲基-6-(1H-1,2,4-三唑-1-基)噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物的合成及其抑菌活性
2016-07-08章平平唐传球
章平平,唐传球,孙 勇
(汉江师范学院生物化学与环境工程系,湖北 十堰 442000)
2-烷氧基-3-芳基-5-甲基-6-(1H-1,2,4-三唑-1-基)噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物的合成及其抑菌活性
章平平,唐传球,孙勇
(汉江师范学院生物化学与环境工程系,湖北 十堰 442000)
摘要:以自制2-氨基-4-甲基-5-(1H-1,2,4-三唑-1-基)-噻吩-3-甲酸乙酯、三苯基膦、芳基异氰酸酯、伯醇为原料,合成了6种新型的2-烷氧基-3-芳基-5-甲基-6-(1H-1,2,4-三唑-1-基)噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物,其结构经1HNMR、MS和元素分析表征,并用6种常见农作物病菌对目标化合物的抑菌活性进行了测试。结果表明,在用药浓度为5×10-5g·L-1时,目标化合物均表现出一定的抑菌活性,其中以2-甲氧基-3-对氯苯基-5-甲基-6-(1H-1,2,4-三唑-1-基)噻吩并[2,3-d]嘧啶-4(3H)-酮的活性最高,对小麦赤霉病菌的抑菌率达到75%。
关键词:2-烷氧基;1,2,4-三氮唑;噻吩并[2,3-d]嘧啶-4(3H)-酮;合成;抑菌活性
噻吩并[2,3-d]嘧啶酮类杂环化合物的化学结构多变,表现出良好的抗菌、抗病毒、抗肿瘤、消炎、抗过敏、抗疟疾[1-7]等作用,因此,在有机化学、药物学和农药学等方面有着广阔的应用前景。许多1-取代的三氮唑类杂环化合物也表现出较好的生物活性[8-10],且三氮唑取代噻吩并嘧啶酮在农药和医药方面的潜在价值引起了研究者的关注,但目前相关研究报道不多。鉴于此,作者通过Gewald反应合成噻吩衍生物,将1H-1,2,4-三唑-1-基引入噻吩环上,利用自制噻吩衍生物与三苯基膦、芳基异氰酸酯和伯醇合成了6种2-烷氧基-3-芳基-5-甲基-6-(1H-1,2,4-三唑-1-基)噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物,采用1HNMR、MS和元素分析对其结构进行了表征,并初步测试了其抑菌活性。
1实验
1.1试剂与仪器
乙醇、乙醚、乙腈、石油醚、二氯甲烷、三乙基胺、六氯乙烷、三苯基膦、伯醇、芳基异氰酸酯等均为市售分析纯,使用前经常规纯化处理。
X4型熔点仪,北京第三光学仪器厂;Mercury400型核磁共振波谱仪(TMS为内标,CDCl3为溶剂),美国Varian公司;FinniganTrace型质谱仪(70eV),美国ThermoFinnigan公司;VarioELⅢ型元素分析仪,德国Elementar公司。
1.2方法[9]
1.2.1目标化合物的合成
以Ⅲa的合成为例:向装有40mL乙腈的圆底烧瓶中依次加入2.02g自制的2-氨基-4-甲基-5-(1H-1,2,4-三唑-1-基)-噻吩-3-甲酸乙酯、3.14g三苯基膦、2.84g六氯乙烷,在室温搅拌下缓慢滴加2.42g三乙基胺,继续室温搅拌4h后过滤,沉淀依次用水和20mL无水乙醇各洗涤2次,最后用无水乙醇∶石油醚=20∶1的混合溶剂重结晶,得到3.32g浅黄色针状晶体膦亚胺(Ⅰ);在室温氮气保护下,取1.02g中间体Ⅰ溶于10mL二氯甲烷中,再加入2mmol芳基异氰酸酯,在0~5 ℃下静置6~12h,待中间体Ⅰ反应完后,减压脱去二氯甲烷,加入20mL乙醚-石油醚(1∶2),过滤除去三苯氧磷副产物,脱去乙醚-石油醚混合溶剂,得到黄色油状碳二亚胺(Ⅱ),无需分离直接用于目标化合物的合成;在中间体Ⅱ的反应瓶中加入15mL绝对无水甲醇,再加入催化剂量醇钠的甲醇溶液,室温搅拌2~4h,过滤,滤液脱去部分无水甲醇,残余物用无水乙醇重结晶,得到浅黄色(或白色)的目标化合物(Ⅲ)。合成路线如图1所示。
1.2.2抑菌活性测试
1.2.2.1培养基的制备
将10 g去皮马铃薯切碎,加入蒸馏水,煮烂,滤去固体,在滤液中加入0.75 g葡萄糖和0.9 g琼脂,加蒸馏水至50 mL,即制成培养基,灭菌备用。
1.2.2.2抑菌实验
取10 mg目标化合物Ⅲa~Ⅲf,溶解在1 mL二甲基亚砜中,再加入1滴吐温-80,得到浓度为100 μg·L-1的溶液,取10 mL该溶液,加入10 mL培养基,即制成50 μg·L-1的试样。
用直径为5 mm的打孔器取含有不同菌种的琼脂片,放入上述试样的培养皿内,菌丝面朝下,置于无菌培养箱中于27 ℃培养48~72 h,每种菌种做3组平行。以不加待测试样作为空白对照,按下式计算抑菌率:

2结果与讨论
2.1合成条件探索
中间体Ⅰ的合成需在较低温度下进行,同时要进行搅拌;合成中间体Ⅱ时,控制反应温度在0~5 ℃,产物无需分离可直接用于目标化合物的合成;合成目标化合物Ⅲ时,由于醇钠的碱性较强,所以只能加入催化剂量醇钠的醇溶液,同时反应时间不能过长,否则副反应增多,目标化合物Ⅲ难以分离且收率下降,反应时间一般在2~4 h。
2.2目标化合物的波谱特征
Ⅲa:浅黄色,收率81%,m.p.194~196 ℃;1HNMR,δ:8.38(s,1H,triazolyl-3-H),8.15(s,1H,triazolyl-5-H),7.54~7.23(m,5H,Ph-H),3.98(s,3H,CH3O),2.46(s,3H,CH3);MS,m/z,%:339(M+,36),311(22),283(29),251(6),151(20),134(26),119(100),91(61),77(68);Anal.calcd for C16H13N5O2S:C 56.63,H 3.86,N 20.64;found C 56.81,H 4.01,N 20.86。
Ⅲb:浅黄色,收率78%,m.p.145~147 ℃;1HNMR,δ:8.36(s,1H,triazolyl-3-H),8.15(s,1H,triazolyl-5-H),7.53~7.22(m,5H,Ph-H),4.46(q,J=7.2 Hz,2H,CH2),2.45(s,3H,CH3),1.27(t,J=7.2 Hz,3H,CH3);MS,m/z,%:353(M+,34),325(9),297(8),270(12),233(19),205(22),178(34),152(29),118(49),91(59),77(100);Anal.calcd for C17H15N5O2S:C 57.78,H 4.29,N 19.82;found C 57.79,H 4.49,N 20.01。
Ⅲc:浅黄色,收率85%,m.p.202~204 ℃;1HNMR,δ:8.38(s,1H,triazolyl-3-H),8.15(s,1H,triazolyl-5-H),7.42~7.05(m,4H,Ar-H),3.98(s,3H,OCH3),2.46(S,3H,CH3),2.44(S,3H,CH3);MS,m/z,%:353(M+,37),325(15),298(14),133(100),104(49),91(74),77(51);Anal. calcd for C17H15N5O2S:C 57.78,H 4.28,N 19.82;found C 57.88,H 4.35,N 20.01。
Ⅲd:浅黄色,收率80%,m.p.141~143 ℃;1HNMR,δ:8.37(s,1H,triazolyl-3-H),8.15(s,1H,triazolyl-5-H),7.42~7.02(m,4H,Ar-H),4.46(q,J=6.8 Hz,2H,OCH2),2.46(s,3H,CH3),2.44(s,3H,CH3),1.27(t,J=6.8 Hz,3H,CH3);MS,m/z,%:367(M+,67),339(10),311(13),283(9),232(44),205(92),178(61),91(100);Anal. calcd for C18H17N5O2S:C 58.84,H 4.66,N 19.06;found C 59.05,H 4.87,N 19.22。
Ⅲe:浅黄色,收率78%,m.p.184~186 ℃;1HNMR,δ:8.37(s,1H,triazolyl-3-H),8.15(s,1H,triazolyl-5-H),7.52~7.18(m,4H,At-H),3.98(s,3H,CH3O),2.46(s,3H,CH3);MS,m/z,%:373(M+,14),318(9),152(100),124(29),111(44),90(37);Anal.calcd for C16H12ClN5O2S:C 51.41,H 3.24,N 18.73;found C 51.44,H 3.33,N 18.91。
Ⅲf:浅黄色,收率73%,m.p. 148~150 ℃;1HNMR,δ:8.36(s,1H,triazolyl-3-H),8.15(s,1H,triazolyl-5-H),7.51~7.17(m,4H,Ar-H),4.45(q,J=6.8 Hz,2H,CH2),2.45(s,3H,CH3),1.28(t,J=6.8 Hz,3H,CH3);MS,m/z,%:387(M+,30),359(12),330(13),232(21),206(100),178(40),153(52),111(44),90(47);Anal. calcd for C17H14ClN5O2S:C 52.65,H 3.64,N 18.06;found C 52.69,H 3.55,N 18.11。
从1HNMR结果可知,1,2,4-三唑-1-基的3位和5位上氢质子吸收峰的化学位移值分别在8.38~8.34和8.15~8.13之间,各自表现为一单峰;芳香环上氢质子吸收峰的化学位移值在7.90~6.89之间,表现为较复杂的多重峰;芳环上甲基氢质子吸收峰的化学位移值均在2.48~2.36之间,表现为一单峰;侧链烷基上氢质子吸收峰的化学位移与分子结构一致。
从MS结果可知,目标化合物的分子离子峰都很强,有的达到了100%:卤素、烷基、三唑基及芳香环的特征碎片离子峰都很明显;噻吩环和嘧啶环破裂碎片离子峰都得到了满意的解释,与预期结构相符。
从元素分析数据可以看出,其理论计算值与实验测试值接近。
综上表明,合成的目标化合物的波谱特征与其化学结构一致。
2.3反应机理
目标化合物的反应机理可能是:首先碳二亚胺中间体与伯醇反应生成类胍中间体,再在RONa的催化下发生分子内的成环反应生成目标化合物,如图2所示。
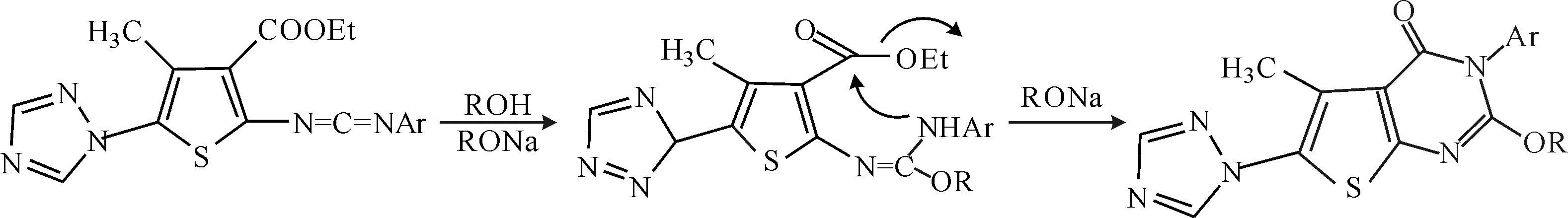
图2目标化合物的反应机理
Fig.2Reaction mechanism of target compound
2.4目标化合物的抑菌活性
采用含毒介质法初步测试了目标化合物Ⅲa~Ⅲf对棉花枯萎病菌(Fusariumoxysporum,A)、水稻纹枯病菌(Rhizoctoniasolani,B)、黄瓜灰霉病菌(Botrytiscinereapers,C)、小麦赤霉病菌(Gibberellazeae,D)、苹果轮纹病菌(Dothiorellagregaria,E)及棉花炭疽病菌(Colletotrichumgossypii,F)等6种常见农作物病菌的抑菌活性,试样浓度为5×10-5g·L-1,测试结果为3次测定平均值,如表1所示。
从表1可知,6种目标化合物对测试病菌均有一定的抑菌活性,其中以Ⅲe活性最高,对小麦赤霉病菌的抑菌率达到75%。
表1目标化合物的抑菌活性
3结论
采用操作简便、反应条件温和的aza-Wittig反应合成了6种新型的2-烷氧基-3-芳基-5-甲基-6-(1H-1,2,4-三唑-1-基)噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物,收率较高。抑菌活性测试表明,在用药浓度为5×10-5g·L-1时,目标化合物对6种常见农作物病菌有较好的抑菌作用,其中以2-甲氧基-3-对氯苯基-5-甲基-6-(1H-1,2,4-三唑-1-基)噻吩并[2,3-d]嘧啶-4(3H)-酮的抑菌活性最高,对小麦赤霉病菌的抑菌率达到75%。
参考文献:
[1]NARASIMHAN B,KUMARI M,JAIN M,et al.Correlation of antibacterial activity of someN-[5-(2-furanyl)-2-methyl-4-oxo-4H-thieno[2,3-d]pyrimidin-3-yl]-carboxamide and 3-substituted-5-(2-furanyl)-2-methyl-3H-thieno[2,3-d]pyrimidin-4-ones with topological indices using Hansch analysis[J].Bioorg Med Chem Lett,2006,16(18):4951-4958.
[2]HAFEZ H N,HUSSEIN H A R,EL-GAZZAR A R B A,et al.Synthesis of substituted thieno[2,3-d]pyrimidine-2,4-dithiones and theirS-glycoside analogues as potential antiviral and antibacterial agents[J].Eur J Med Chem,2010,45(9):4026-4034.
[3]ALAGARSAMY V,MEENA S,RAMSESHU K V,et al.Synthesis,analgesic,anti-inflammatory,ulcerogenic index and antibacterial activities of novel 2-methylthio-3-substituted-5,6,7,8-tetrahydrobenzo(b) thieno[2,3-d]pyrimidin-4(3H)-ones[J].Eur J Med Chem,2006,41(11):1293-1300.
[4]WANG Y D,JOHNSON S,POWELL D,et al.Inhibition of tumor cell proliferation by thieno[2,3-d]pyrimidin-4(1H)-one-based analogs[J].Bioorg Med Chem Lett,2005,15(16):3763-3766.
[5]MAVROVA A T,VUCHEV D,ANICHINA K,et al.Synthesis,antitrichinnellosis and antiprotozoal activity of some novel thieno[2,3-d]pyrimidin-4(3H)-ones containing benzimidazole ring[J].Eur J Med Chem,2010,45(12):5856-5861.
[6]KIKUCHI H,YAMAMOTO K,HOROIWA S,et al.Exploration of a new type of antimalarial compounds based on febrifugine[J].J Med Chem,2006,49(15):4698-4706.
[7]COHEN A,SUZANNE P,LANCELOT J C,et al.Discovery of new thienopyrimidinone derivatives displaying antimalarial properties toward both erythrocytic and hepatic stages ofPlasmodium[J].Eur J Med Chem,2015,95:16-28.
[8]MAVROVA A T,WESSELINOVA D,TSENOV J A,et al.Synthesis and antiproliferative activity of some new thieno[2,3-d] pyrimidin-4(3H)-ones containing 1,2,4-triazole and 1,3,4-thiadiazole moiety[J].Eur J Med Chem,2014,86:676-683.
[9]孙勇,丁明武.2-二烷氨基-3-苯基-5-甲基-6-(1H-1,2,4-三唑-1-基)-噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物的合成及其杀菌活性[J].合成化学,2009,17(5):548-552.
[10]孙勇,潘坤,曾沽琼.新型的2-烷氨基-3-苯基-5-甲基-6-(1H-1,2,4-三唑-l-基)-噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物的合成及其抑菌活性[J].合成化学,2010,18(6):721-724.
Synthesis of 2-Alkoxyl-3-aryl-5-methyl-6-(1H-1,2,4-triazol-1-yl)-thieno[2,3-d] pyrimidin-4(3H)-ones and Their Fungicidal Activities
ZHANG Ping-ping,TANG Chuan-qiu,SUN Yong
(DepartmentofBiochemicalandEnvironmentalEngineering,HanjiangNormalUniversity,Shiyan442000,China)
Keywords:2-alkoxyl;1,2,4-triazole;thieno[2,3-d]pyrimidin-4(3H)-one;synthesis;fungicidalactivity
Abstract:Sixnovel2-alkoxyl-3-aryl-5-methyl-6-(1H-1,2,4-triazol-1-yl)-thieno[2,3-d]pyrimidin-4(3H)-onesweresynthesizedbyusingself-made2-amino-4-methyl-5-(1H-1,2,4-triazol-1-yl)-thiophene-3-ethylformate,triphenylphosphine,arylisocynateandprimaryalcoholasrawmaterials.Theirstructureswerecharacterizedby1HNMR,MSandelementalanalysis.Andtheirfungicidalactivitieswerealsotestedbysixkindsofcommoncropsbacteria.Resultsshowedthat,alltargetcompoundswithaconcentrationof5×10-5g·L-1hadcertainfungicidalactivities.Amongthem,2-methoxy-3-(4-chlorophenyl)-5-methyl-6-(1H-1,2,4-triazol-1-yl)-thieno[2,3-d]pyrimidin-4(3H)-onedisplayedthehighestfungicidalactivityof75%againstGibberella zeae.
基金项目:湖北省教育厅自然科学基金资助项目(Q20135001)
收稿日期:2016-01-28
作者简介:章平平(1980-),女,安徽安庆人,讲师,研究方向:现代分离分析技术,E-mail:zpp34@163.com;通讯作者:孙勇,博士,教授,E-mail:sunyong376111@yahoo.com.cn。
doi:10.3969/j.issn.1672-5425.2016.06.007
中图分类号:O 621.3
文献标识码:A
文章编号:1672-5425(2016)06-0035-04
