间充质干细胞对干燥综合征模型小鼠治疗效应的研究
2016-07-07阮光峰黄家树黄琬雪汤建平
阮光峰, 黄家树, 黄琬雪, 汤建平
(同济大学附属同济医院风湿免疫科,上海 200065)
·基础研究·
间充质干细胞对干燥综合征模型小鼠治疗效应的研究
阮光峰, 黄家树, 黄琬雪, 汤建平
(同济大学附属同济医院风湿免疫科,上海 200065)
目的 探讨MSCs对晚期干燥综合征(Sjögren’s syndrome, SS)模型小鼠的治疗效果及血清中细胞因子浓度的影响。方法 16只雌性NOD/Ltj小鼠随机分为疾病对照组和MSCs治疗组,8只雌性C57BL/6小鼠作为健康对照组。监测各组小鼠饮水量和血糖;MSCs治疗组小鼠26周龄时进行连续2周的尾静脉MSCs注射;测算小鼠唾液流率;计算小鼠的下颌下腺淋巴细胞灶积分;ELISA检测小鼠血清中IL-2、IL-6、HGF、IFN-γ、IL-10、PGE2、TGF-β1、TNF-α的水平。结果 从第16周龄开始,NOD小鼠饮水量及血糖水平显著增加;治疗后,MSCs治疗组唾液流率下降幅度明显小于同时期的疾病对照组;MSCs治疗组下颌下腺淋巴细胞灶积分明显小于疾病对照组;3组间多种与SS发病或MSCs免疫抑制功能相关的细胞因子差异有统计学意义。结论 MSCs对晚期干燥综合征模型小鼠有一定的治疗效果,其可能通过改变血清中多种细胞因子浓度达到治疗效应。
干燥综合征; 间充质干细胞; 细胞因子
干燥综合征(Sjögren’s syndrome, SS)是一种以侵犯泪腺和唾液腺等外分泌腺、具有高度的淋巴细胞浸润为特征的弥漫性结缔组织病,最常见的表现是口、眼干燥症,且常伴有内脏损害而出现多种临床表现[1]。非肥胖型糖尿病(non-obese diabetic, NOD)小鼠具有淋巴细胞异常浸润唾液腺导致唾液腺破坏和分泌功能下降及淋巴细胞破坏胰腺导致高血糖等特点[2]。雌性NOD小鼠因具有类似于SS患者的唾液腺淋巴细胞浸润导致分泌功能下降及血清中存在多种自身抗体等特点而被认为是理想的SS模型小鼠[3-4]。
间充质干细胞(mesenchymal stem cells, MSCs)是一类具有多向分化潜能的组织干细胞,因其具有免疫抑制的功能和无免疫原性等特点,被认为有可能用于治疗多种自身免疫性疾病[5]。研究[6-8]显示,MSCs可改善NOD小鼠唾液腺功能,减轻唾液腺淋巴细胞浸润,但这些实验使用的NOD小鼠周龄为7~16周,代表了SS早期的阶段(NOD小鼠于7~8周龄开始发生SS)。本实验通过对26周龄的NOD小鼠进行MSCs的治疗,研究MSCs对晚期干燥综合征模型小鼠的治疗效应。
1 材料与方法
1.1 实验动物及分组
16只6周龄的雌性NOD/Ltj小鼠和8只6周龄的雌性C57BL/6小鼠购买于上海斯莱克实验动物有限公司,饲养于同济大学SPF级实验动物中心。将NOD/Ltj小鼠随机分为疾病对照组8只,MSCs治疗组8只,将C57BL/6小鼠作为健康对照组。
1.2 MSCs的来源与鉴定
MSCs从同济大学附属同济医院新生儿脐带中分离获得,其具体步骤参照文献[9]。MSCs培养至3~5代时用于本实验。使用人MSC鉴定试剂盒(美国BD公司)流式鉴定MSCs纯度。
1.3 小鼠饮水量、血糖和唾液流率的测定
间隔24h测量小鼠饲养笼盒中水瓶的重量,其差值即为该笼中小鼠当日的总饮水量。使用血糖仪测量小鼠血糖。具体方法为用75%的酒精消毒后的刀片切割小鼠尾静脉,将流出的血液滴到血糖仪试纸上,用血糖仪读取并记录结果。测量小鼠唾液流率前,以10ml/kg体质量的剂量使用4%的水合氯醛使小鼠麻醉,以0.5mg/kg体质量的剂量皮下注射毛果芸香碱刺激唾液分泌。将称重后的棉条塞入小鼠口中,10min后取出棉条再次称质量,其两次体质量之差即为小鼠该时段内分泌的唾液量。
1.4 MSCs的治疗
MSCs治疗组小鼠在其26周龄时接受注射MSCs治疗,将0.4ml含有5×105个MSCs的磷酸盐缓冲液通过尾静脉注射入小鼠体内,每周2次,连续2周。
1.5 下颌下腺淋巴细胞灶积分
30周龄时处死全部3组小鼠,取出其下颌下腺,放入多聚甲醛中,置于4℃固定24h,用乙醇脱水和二甲苯透明后用石蜡包埋,将组织切成 10mm 薄片后H-E染色。显微镜下观察切片,进行淋巴细胞灶计数,4mm2腺泡组织内淋巴细胞聚集数在50个以上记为一个病灶,计算淋巴细胞灶积分。
1.6 ELISA检测血清细胞因子
心脏穿刺法取出小鼠血液,离心获得血清,用ELISA试剂盒(上海西唐生物科技有限公司)分别检测血清中IL-2、IL-6、HGF、IFN-γ、IL-10、PGE2、TGF-β1、TNF-α的水平。
1.7 统计学处理

2 结 果
2.1 MSCs流式细胞仪鉴定结果
流式鉴定结果显示: FITC抗人CD90(+),PerCP-CyTM5.5抗人CD105(+),APC抗人CD73(+),而PE抗人CD45、PE抗人CD34、PE抗人CD11b、PE抗人CD19、PE抗人HLA-DR(-)。MSCs阳性率为97.5%,表明分离培养得到的MSCs纯度较高(图1)。

图1 人脐带来源MSCs流式鉴定结果Fig.1 Flow cytometric analysis of human umbilical cord mesenchymal stem cells
2.2 NOD小鼠的饮水量和血糖变化
本研究监测了NOD小鼠从10~25周龄饮水量及从10~24周龄血糖的变化情况。NOD小鼠日饮水量和血糖在其16周龄后呈现明显的上升趋势(图2)。饮水量和血糖一定程度上反映了NOD小鼠疾病的严重程度,以上结果显示NOD小鼠16周龄后病情不断地加重。

图2 不同周龄的NOD小鼠的饮水量和血糖Fig.2 Water consumption and blood glucose levels of NOD mice at different ages
2.3 NOD小鼠唾液流率的下降
测量各组小鼠的26周龄时(MSCs治疗前)和30周龄时(MSCs治疗结束2周后)的唾液流率。健康对照组小鼠在其26周龄和30周龄的唾液流率几乎没有变化(P=0.933);疾病对照组小鼠的唾液流率明显下降(P=0.001);而MSCs治疗组小鼠唾液流率在这一期间下降较为缓慢(P=0.039),见图3。
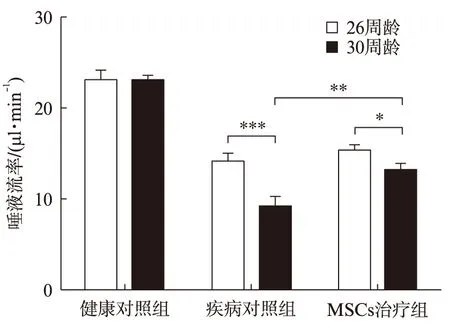
图3 三组小鼠在26、30周龄时的唾液流率Fig.3 Salivary flow rates of the three groups inat 26 weeks and 30 weeks of age*P<0.05,**P<0.01,***P<0.001
2.4 MSCs治疗组小鼠与疾病对照组小鼠下颌下腺淋巴细胞浸润情况
MSCs治疗结束2周后,取下颌下腺进行H-E染色,显微镜下观察腺体淋巴细胞浸润情况。健康对照组小鼠下颌下腺几乎无淋巴细胞浸润,而疾病对照组和MSCs治疗组小鼠下颌下腺则均有明显的淋巴细胞浸润(图4)。健康对照组、疾病对照组和MSCs治疗组小鼠下颌下腺淋巴细胞灶积分分别为0±0、2.44±0.48和1.52±0.66,MSCs治疗组较疾病对照组明显下降(P<0.05)。
2.5 三组小鼠血清中可溶性因子水平
与健康对照组相比,疾病对照组IL-2、IL-6、IFN-γ、TGF-β1表达上调,而HGF、IL-10表达下调,差异有统计学意义(P<0.05);与疾病对照组相比,MSCs治疗组IL-6、HGF、IL-10、PGE2、TGF-β1表达上调,而IL-2、IFN-γ表达下调,差异有统计学意义(P<0.05),见表1。
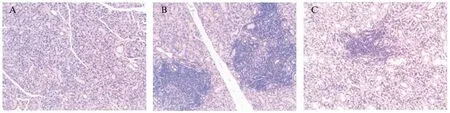
图4 三组小鼠下颌下腺淋巴细胞浸润情况Fig.4 Lymphocyte infiltration in submandibular glands in three groupsA: 健康对照组;B: 疾病对照组;C: MSCs治疗组

组别IL-2IL-6HGFIFN-γIL-10PGE2TGF-β1TNF-α疾病对照组5.11±2.8736.62±27.11115.49±50.547.00±2.33117.23±50.37819.12±235.89904.89±66.59211.49±32.40健康对照组2.48±1.44*19.77±7.97*279.32±138.65**2.25±0.83***164.16±80.83**739.27±137.52697.72±54.54**159.11±36.51MSCs治疗组1.78±0.94*168.36±68.37***343.95±76.63**3.68±1.50*248.82±51.93*1465.91±220.51***1044.14±41.78*171.71±41.56
与疾病对照组相比,*P<0.05,**P<0.01,***P<0.001
3 讨 论
MSCs具有免疫抑制功能,可能被用以治疗多种自身免疫性疾病。研究[6-8]显示,MSCs可改善NOD小鼠SS的临床和病理学表现。然而这些研究使用的NOD小鼠均在其SS早期的阶段就接受了MSCs的治疗。SS的眼干、口干的症状是淋巴细胞浸润及破坏泪腺和唾液腺导致的[10]。MSCs通过抑制淋巴细胞的活化和增殖从而发挥其治疗作用[6]。随着SS病情的发展,越来越多的泪腺及唾液腺细胞被破坏,在病情发展到一定程度后MSCs的治疗是否仍然有效尚不清楚。本研究监测NOD小鼠饮水量和血糖,发现其在小鼠16周龄后均出现明显的上升趋势,表明NOD小鼠在这期间病情不断的加重。本研究将26周龄的NOD小鼠作为晚期SS模型小鼠接受MSCs的注射治疗。在治疗前及治疗结束两周后,检测MSCs治疗组和相同周龄的健康对照组及疾病对照组小鼠的唾液流率,结果显示26周龄和30周龄的健康对照组小鼠唾液流率明显高于其对应周龄的MSCs治疗组和疾病对照组小鼠。在 26~30周龄,疾病对照组小鼠唾液流率下降明显,而MSCs治疗组小鼠唾液流率下降幅度则较小。下颌下腺淋巴细胞灶积分结果也显示MSCs治疗组小鼠积分明显低于疾病对照组小鼠。以上结果表明,MSCs治疗对相对晚期SS的NOD小鼠仍有一定作用。之前几个相对早期SS的NOD小鼠接受MSCs治疗的实验显示MSCs治疗可逆转NOD小鼠下降的唾液流率,其疗效优于本实验结果(只能延缓唾液流率的下降)。原因可能是由于在SS早期,唾液腺浸润的淋巴细胞仅仅影响了唾液腺细胞的状态,注射MSCs抑制了淋巴细胞后唾液腺细胞又可恢复其功能。而在SS晚期,相当部分的唾液腺细胞已经死亡,此时注射MSCs只能延缓疾病进程。这一结果也提示SS患者早期接受MSCs的治疗可能会有更好的疗效。
本研究测量了小鼠血清中与SS发病或MSCs治疗效应有关的一些细胞因子水平,如IL-10、HGF、PGE2和TGFβ1等[11]。这些细胞因子在MSCs治疗组中较疾病对照组均有所升高,表明MSCs在NOD小鼠中较好地发挥了免疫抑制作用。INF-γ、TNF-α和IL-6等促炎因子在SS患者体内高表达[12-14]。在本研究中,INF-γ、TNF-α和IL-6在疾病对照组小鼠血清中的浓度均高于健康对照组(TNF-α在各组中的差异无统计学意义),证明了动物模型的可靠性。MSCs治疗组血清中INF-γ和TNF-α的浓度低于疾病对照组。MSCs治疗组IL-6浓度显著高于疾病对照组,这一结果与Jurewicz等[15]的报道结果一致。IL-6一般被认为是一种可促进T细胞增殖和活化及B细胞分化的促炎因子[16],然而也有报道[17]显示IL-6与MSCs抑制单核细胞向树突细胞的分化有关,所以IL-6在MSCs免疫抑制功能中所发挥的整体作用仍有待进一步的研究。IL-2是一种多效性细胞因子,低剂量的IL-2可通过促进调节性T细胞增殖而抑制炎症反应,而高剂量的IL-2则可通过促进效应性T细胞的分化而促进炎症反应[18-19]。在本研究中,疾病对照组小鼠血清中IL-2水平高于健康对照组和MSCs治疗组,然而本实验各组间不同的IL-2水平在SS发生发展及缓解中发挥的作用仍不清楚,值得进一步研究。
综上所述,MSCs对较晚期的SS模型小鼠有一定疗效,但其疗效不如较早期接受MSCs治疗的SS模型小鼠显著。多种细胞因子可能在MSCs治疗SS的过程中发挥了作用,但这些细胞因子在这一过程中发挥作用的机制仍有待进一步研究。
[1] Mavragani CP, Moutsopoulos HM. The geoepidemio-logy of Sjögren’s syndrome[J]. Autoimmun Rev, 2010,9(5): A305-310.
[2] Tran SD, Kodama S, Lodde BM, et al. Reversal of Sjogren’s-like syndrome in non-obese diabetic mice[J]. Ann Rheum Dis, 2007,66(6): 812-814.
[3] Roescher N, Lodde BM, Vosters JL, et al. Temporal changes in salivary glands of non-obese diabetic mice as a model for Sjögren’s syndrome[J]. Oral Dis, 2012,18(1): 96-106.
[4] Soyfoo MS, Steinfeld S, Delporte C. Usefulness of mouse models to study the pathogenesis of Sjögren’s syndrome[J]. Oral Dis. 2007,13(4): 366-375.
[5] Klinker MW, Wei CH. Mesenchymal stem cells in the treatment of inflammatory and autoimmune diseases in experimental animal models[J]. World J Stem Cells, 2015,7(3): 556-567.
[6] Xu J, Wang D, Liu D, et al. Allogeneic mesenchymal stem cell treatment alleviates experimental and clinical Sjögren syndrome[J]. Blood, 2012,120(15): 3142-3151.
[7] Khalili S, Liu Y, Sumita Y, et al. Bone marrow cells are a source of undifferentiated cells to prevent Sjögren’s syndrome and to preserve salivary glands function in the non-obese diabetic mice[J]. Int J Biochem Cell Biol, 2010,42(11): 1893-1899.
[8] Khalili S, Liu Y, Kornete M, et al. Mesenchymal stromal cells improve salivary function and reduce lymphocytic infiltrates in mice with Sjögren’s-like disease[J]. PLoS One, 2012,7(6): e38615.
[9] Sun L, Wang D, Liang J, et al. Umbilical cord mesenchymal stem cell transplantation in severe and refractory systemic lupus erythematosus[J]. Arthritis Rheum, 2010,62(8): 2467-2475.
[10] Jonsson R, Vogelsang P, Volchenkov R, et al. The complexity of Sjögren’s syndrome: novel aspects on pathogenesis[J]. Immunol Lett, 2011,141(1): 1-9.
[11] Ben-Ami E, Berrih-Aknin S, Miller A. Mesenchymal stem cells as an immunomodulatory therapeutic strategy for autoimmune diseases[J]. Autoimmun Rev, 2011,10(7): 410-415.
[12] Roescher N, Tak PP, Illei GG. Cytokines in Sjogren’s syndrome: potential therapeutic targets[J]. Ann Rheum Dis, 2010,69(6): 945-948.
[13] Sada PR, Isenberg D, Ciurtin C. Biologic treatment in Sjögren’s syndrome[J]. Rheumatology (Oxford), 2015,54(2): 219-230.
[14] Coursey TG, de Paiva CS. Managing Sjögren’s Syndrome and non-Sjögren syndrome dry eye with anti-inflammatory therapy[J]. Clin Ophthalmol, 2014,8: 1447-1458.
[15] Jurewicz M, Yang S, Augello A, et al. Congenic mesenchymal stem cell therapy reverses hyperglycemia in experimental type 1 diabetes[J]. Diabetes, 2010,59(12): 3139-3147.
[16] Hunter CA, Jones SA. IL-6 as a keystone cytokine in health and disease[J]. Nat Immunol, 2015,16(5): 448-457.
[17] Jiang XX, Zhang Y, Liu B, et al. Human mesen-chymal stem cells inhibit differentiation and function of monocyte-derived dendritic cells[J]. Blood, 2005,105(10): 4120-4126.
[18] Ballesteros-Tato A. Beyond regulatory T cells: the potential role for IL-2 to deplete T-follicular helper cells and treat autoimmune diseases[J]. Immunotherapy, 2014,6(11): 1207-1220.
[19] Bayer AL, Pugliese A, Malek TR. The IL-2/IL-2R system: from basic science to therapeutic applications to enhance immune regulation[J]. Immunol Res, 2013,57(1-3): 197-209.
Therapeutic effect of mesenchymal stem cells on mice with Sjögren’s syndrome
RUANGuang-feng,HUANGJia-shu,HUANGWan-xue,TANGJian-ping
(Dept.of Rheumatology, Tongji Hospital, Tongji University, Shanghai 200065, China)
Objective To investigate the therapeutic effect of mesenchymal stem cells (MSCs) on mice with Sjögren’s syndrome. Methods Sixteen female NOD/Ltj mice were randomized into disease group and MSC treated group, and 8 female C57BL/6 mice served as normal control group. The mice in MSC treated group received MSCs injection at 26 weeks of age for 2 consecutive weeks. Water intake, blood glucose and salivary flow rate were measured; the lymphocyte infiltration score of submandibular glands was calculated; serum levels of IL-2, IL-6, HGF, IFN-γ, IL-10, PEG2, TGF-β1 and TNF-α were measured by ELISA. Results Water consumption and blood glucose of NOD mice were increased rapidly after 16 weeks of age. MSCs treatment prevented the decline of salivary flow rate and lymphocytes infiltration in submandibular glands of NOD mice. There were significant differences in serum concentrations of cytokines among 3 groups. Conclusion MSCs treatment is effective for NOD mice with Sjögren’s syndrome, which may be associated with the alteration of cytokines levels.
Sjögren’s syndrome; mesenchymal stem cells; cytokines
10.16118/j.1008-0392.2016.01.002
2015-10-12
国家自然科学基金(81273295)
阮光峰(1989—),男,硕士研究生.E-mail: ruan1989.ok@163.com
汤建平.Email: tangjp6512@126.com
R 593
A
1008-0392(2016)01-0007-05
