豆蔻明对TLR4/MyD88/NF-κB/iNOS信号通路的调节作用
2016-07-07任改艳孙阿宁罗晓平王峥涛
邓 超,任改艳,孙阿宁,罗晓平,王峥涛,窦 薇
(上海中医药大学中药研究所中药标准化教育部重点实验室暨上海市复方中药重点实验室,上海 201203)
豆蔻明对TLR4/MyD88/NF-κB/iNOS信号通路的调节作用
邓超,任改艳,孙阿宁,罗晓平,王峥涛,窦薇
(上海中医药大学中药研究所中药标准化教育部重点实验室暨上海市复方中药重点实验室,上海201203)
摘要:目的探讨豆蔻明(cardamonin,CDN)对RAW264.7小鼠巨噬细胞Toll样受体4(toll-like receptor 4, TLR4)/MyD88/NF-κB/iNOS信号通路的调节作用。方法利用脂多糖(lipopolysaccharide, LPS)处理RAW264.7细胞建立炎性细胞模型并分组:正常对照组(Vehicle组)、模型组(LPS组)和药物处理组(LPS+CDN组);CCK-8方法检测细胞活力,Griess法检测细胞培养上清一氧化氮(nitric oxide,NO)含量,RT-PCR检测诱导型NO合成酶(inducible nitric oxide synthase,iNOS)、环氧化酶-2(cyclooxygenase-2, COX-2)、单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)、肿瘤坏死因子(tumor necrosis factor,TNF)-ɑ、白介素(interleukin,IL)-1β和IL-6的mRNA表达,Western blot检测iNOS、TLR4、髓样分化因子88(myeloid differentiation factor 88,MyD88)、核因子-κB(nuclear factor κB, NF-κB)phosphorylated(p)-p65、inhibitor κBα(IκBα)和p-IκBα的蛋白表达。结果1~50 μmol·L-1豆蔻明对RAW264.7细胞没有毒性,但可以剂量依赖性抑制LPS诱导的NO分泌和iNOS、COX-2、MCP-1、TNF-α、IL-1β及IL-6的mRNA表达,25 μmol·L-1豆蔻明可下调LPS诱导的iNOS、TLR4、MyD88、p-NF-κB p65和p-IκBα蛋白表达及抑制IκBα降解。结论豆蔻明通过抑制TLR4/MyD88/NF-κB/iNOS信号通路从而抑制NO的产生。
关键词:RAW264.7细胞;TLR4;MyD88;NF-κB;iNOS;豆蔻明
Toll样受体4(toll-1ike receptor 4,TLR4)是介导天然免疫的一类重要的跨膜蛋白受体,与宿主细胞对各种微生物致病原的识别有关[1]。TLR4能特异性地识别病原相关分子模式(pathogen associated molecular patterns,PAMPs),通过跨膜信号转导将病原相关分子刺激信号转导入细胞内,通过髓样分化因子88(myeloid differentiation factor 88,MyD88)触发信号级联,使核因子-κB(nuclear factor kappa-B,NF-κB)抑制单位IκBα(inhibitor of κBα)发生磷酸化并降解,NF-κB与IκBα解离进入细胞核,与下游基因的启动子或增强子中的κB转录调控序列发生特异性结合,导致炎症相关基因的转录表达,最终引起炎症因子大量释放和炎症反应[2]。
豆蔻明(cardamonin,CDN),结构为2′, 4′-二羟基-6′-甲氧基查尔酮,主要存在于姜科植物草豆蔻(AlpiniakatsumadaiHayata)的种子中[3]。豆蔻明具有抗血小板聚集、抗肿瘤、抗诱变、抗炎、抗氧化和抗菌等多种生物活性[4]。大量研究表明,豆蔻明对炎症介质前列腺素E2(prostaglandin E2,PGE2)、一氧化氮(nitric oxide,NO)、肿瘤坏死因子(tumor necrosis factor,TNF)-ɑ、白介素(interleukin,IL)-1β和IL-6的抑制作用与抑制NF-κB信号通路有关[5]。TLR4是NF-κB的上游调控基因,有关豆蔻明对TLR4/NF-κB信号通路的调节作用仅见于我们前期的研究报道:豆蔻明对小鼠结肠黏膜炎性损伤的保护作用,可能与下调结肠组织的TLR4表达、抑制NF-κB及丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)活性和减少炎症介质释放有关[6]。本研究拟以LPS诱导的RAW 264.7细胞作为模型,进一步探讨豆蔻明对TLR4/NF-κB信号通路的调节作用,为豆蔻明的抗炎分子机制研究提供依据。
1材料与方法
1.1材料
豆蔻明(C16H14O4, MW 270.28)购于上海纯优生物科技有限公司(纯度≥98%,批号P0242);RAW264.7小鼠单核/巨噬细胞购于中科院上海细胞所;DMEM、胎牛血清、TRIzol、DMSO和Tween-20购于美国Life Technologies公司;LPS购于美国Sigma公司;CCK-8试剂盒(Cell Counting Kit-8)购于上海前尘生物科技有限公司;Griess试剂盒购于南京建成生物工程研究所;蛋白酶抑制剂(protease inhibitor cocktail)和RIPA裂解液购于美国Thermo Fisher Scientific公司;反转录试剂盒及荧光定量PCR试剂盒购于日本TaKaRa公司;BCA蛋白定量试剂盒购于美国Thermo Fisher Scientific公司;iNOS、TLR4、MyD88、IκBα、p-p65、P-IκBα和β-actin抗体购自美国Cell Signaling Technology公司;ECL显影试剂盒购于美国Millipore公司。
1.2方法
1.2.1细胞培养及化学品处理RAW264.7细胞用含10%胎牛血清的DMEM培养基于37℃,5% CO2培养箱中培养,2 d换液1次,取对数期细胞用于实验。用 DMSO 溶解豆蔻明,配成0.1 mol·L-1储液,-20℃避光保存。使用前取出融化,漩涡振荡后按一定浓度加入到细胞,使加入细胞的DMSO终浓度为0.1%。空白/溶剂对照组DMSO浓度为0.1%。
1.2.2细胞活力检测RAW264.7细胞悬液按照1×105每孔接种于96孔板,每组4个复孔。除溶剂对照孔外,其余每孔用CDN(0、1、5、15、25、50 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育12 h和24 h。去培养基,每孔加入100 μL细胞培养液,再加入10 μL试剂盒自带CCK-8溶液,37℃孵育1 h,酶标仪测定吸光度值(A=450 nm)。实验结果以细胞存活率表示,细胞存活率/%=给药组/溶剂对照组×100%。
1.2.3NO的测定采用Griess试剂法测定细胞培养上清液中总NO的含量。RAW264.7细胞悬液按照1×105每孔接种96孔板,每组6个复孔。除溶剂对照孔外,其余每孔用CDN(0、1、5、15、25、50 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育24 h。按照Griess试剂盒操作步骤检测上清NO的含量。
1.2.4RT-PCRRAW264.7细胞悬液按照2×106每孔接种6孔板,每组3个复孔。除溶剂对照孔外,其余每孔用CDN(0、5、15、25 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育24 h。培养结束后,用TRIzol试剂提取总RNA并定量。按TaKaRa逆转录试剂说明书,取1 μg RNA反转录为cDNA。采用SYBR Green PCR试剂,在ABI 7300荧光定量PCR仪上进行PCR扩增和检测,PCR反应条件为95 ℃ 1 min预变性,95 ℃ 5s变性,60 ℃ 34 s退火,共40个循环。按照标准荧光定量PCR引物设计原则,使用Primer 5.0软件设计引物,引物由上海捷瑞生物工程有限公司合成(Tab 1)。每次扩增设置β-actin基因为内参照,用PCR仪自带软件进行荧光定量分析,得出Ct值,统计△△Ct值以比较各组mRNA的表达。

Tab 1 The primer sequence for RT-PCR

2结果
2.1CDN 对RAW264.7细胞活力的影响
如Fig 1所示,RAW264.7细胞经CDN(0~50 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育12 h和24 h后,与未经处理的细胞相比,细胞活力差异无显著性(P>0.05)。提示本研究所用CDN浓度剂量(0~50 μmol·L-1)及处理时间(12、24 h)对细胞无毒性。
2.2CDN抑制LPS刺激的RAW264.7细胞NO分泌
如Fig 2所示,与正常对照组相比,LPS诱导的RAW264.7细胞上清中NO含量明显升高(P<0.01),CDN(0~50 μmol·L-1)可剂量依赖性抑制NO的产生,其中25 和50 μmol·L-1CDN明显抑制LPS诱导的RAW264.7细胞上清液中NO的积累(P<0.01)。

Fig 1 Effects of CDN on cell viability of RAW264.7 cells(n=4)

Fig 2 Effects of CDN on production of
##P<0.01vsvehicle-treated cells;**P<0.01vsLPS-treated cells
2.3CDN下调RAW264.7细胞炎症介质mRNA的表达
正常对照组RAW264.7细胞中环氧合酶-2(COX-2)、诱导型NO合成酶(iNOS)、单核细胞趋化蛋白-1(MCP-1)、TNF-ɑ、IL-1β和IL-6的mRNA表达水平都很低,LPS刺激后表达量均明显升高(P<0.01),CDN(5、15、25 μmol·L-1)可剂量依赖性抑制上述基因的表达(Fig 3)。
2.4CDN抑制RAW264.7细胞TLR4/MyD88/NF-κB/iNOS通路蛋白的表达
Western blot显示(Fig 4),CDN(25 μmol·L-1)可明显抑制LPS 诱导的RAW264.7细胞TLR4(P<0.01)、MyD88(P<0.01)、p-p65(P<0.01)、p-IκBα(P<0.05)和iNOS蛋白的表达(P<0.05),抑制LPS诱导的IκBα蛋白的降解(P<0.01)。

Fig 3 Effects of CDN on mRNA
##P<0.01vsvehicle-treated cells;*P<0.05,**P<0.01vsLPS-treated cells
3讨论
LPS诱导的RAW264.7小鼠巨噬细胞模型,被广泛用于研究炎症反应,产生的过量NO会导致细胞损伤和组织坏死[7]。NO由iNOS催化合成,NO还可促进炎症介质前列腺素E2(PGE2)合成的限速酶COX-2的生成[8]。本研究表明,豆蔻明可剂量依赖性抑制RAW264.7细胞NO的产生,同时抑制iNOS、COX-2 mRNA的表达及iNOS蛋白的表达。据报道炎症细胞因子TNF-α、IL-1β、IL-6和化学因子MCP-1主要由单核巨噬细胞分泌,是早期炎症的标志物,在机体损伤、感染、免疫反应等情况下大量合成和释放,是炎症反应的促发剂[2]。本研究发现豆蔻明可剂量依赖性抑制RAW264.7细胞TNF-α、IL-1β、IL-6和MCP-1 mRNA表达。
NF-κB是启动机体免疫应答及炎性细胞因子表达的关键转录因子,静息状态下NF-κB以非活性的NF-κB/IκBα复合物形式存在于细胞质中,当细胞受到LPS刺激后,IκBα发生磷酸化并降解,NF-κB与IκBα解离后转移至核内,参与调节各种炎症介质基因的转录表达,如髓过氧化物酶(myeloperoxidas,MPO)、NO、TNF-α、IL-1β和IL-6等[2,6]。目前已发现多种因素可以诱导NF-κB活化,包括细胞因子、LPS、蛋白激酶C和理化因素(X射线、氧化剂及化疗药物)等[9]。本研究发现豆蔻明可明显抑制LPS诱导的RAW264.7细胞p-p65和p-IκBα的表达及IκBα的降解,提示豆蔻明对NF-κB活性具有抑制作用,这与文献报道一致[4-5]。
迄今人类TLRs家族成员至少已发现10种,TLR4是TLRs家族的一个重要亚型,在人体多种细胞中广泛表达,主要分布于内皮细胞、巨噬细胞、中性粒细胞、星形胶质细胞等[10]。TLR4的配体包括细菌脂多糖LPS、硫酸乙酰肝素、纤连蛋白-EDA、透明质酸和纤维蛋白原等,受损组织和坏死细胞也可以释放出TLR4的内源性激活物[2]。RAW264.7细胞表面具有TLR4病原模式识别受体,能识别外源性同源配体LPS,刺激信号通过TLR4转导至RAW264.7细胞内,激活转录因子NF-κB,进而启动炎症级联效应基因的表达。MyD88属于衔接蛋白家族成员,TLR4一旦被激活,可募集胞内段的衔接蛋白MyD88触发信号级联,激活NF-κB[6]。本研究发现豆蔻明可明显抑制LPS诱导的RAW264.7细胞TLR4和MyD88蛋白表达,提示豆蔻明可能通过下调RAW264.7细胞TLR4的蛋白表达,抑制其衔接蛋白分子MyD88,进而抑制NF-κB活化和iNOS蛋白表达,最终抑制NO的产生。
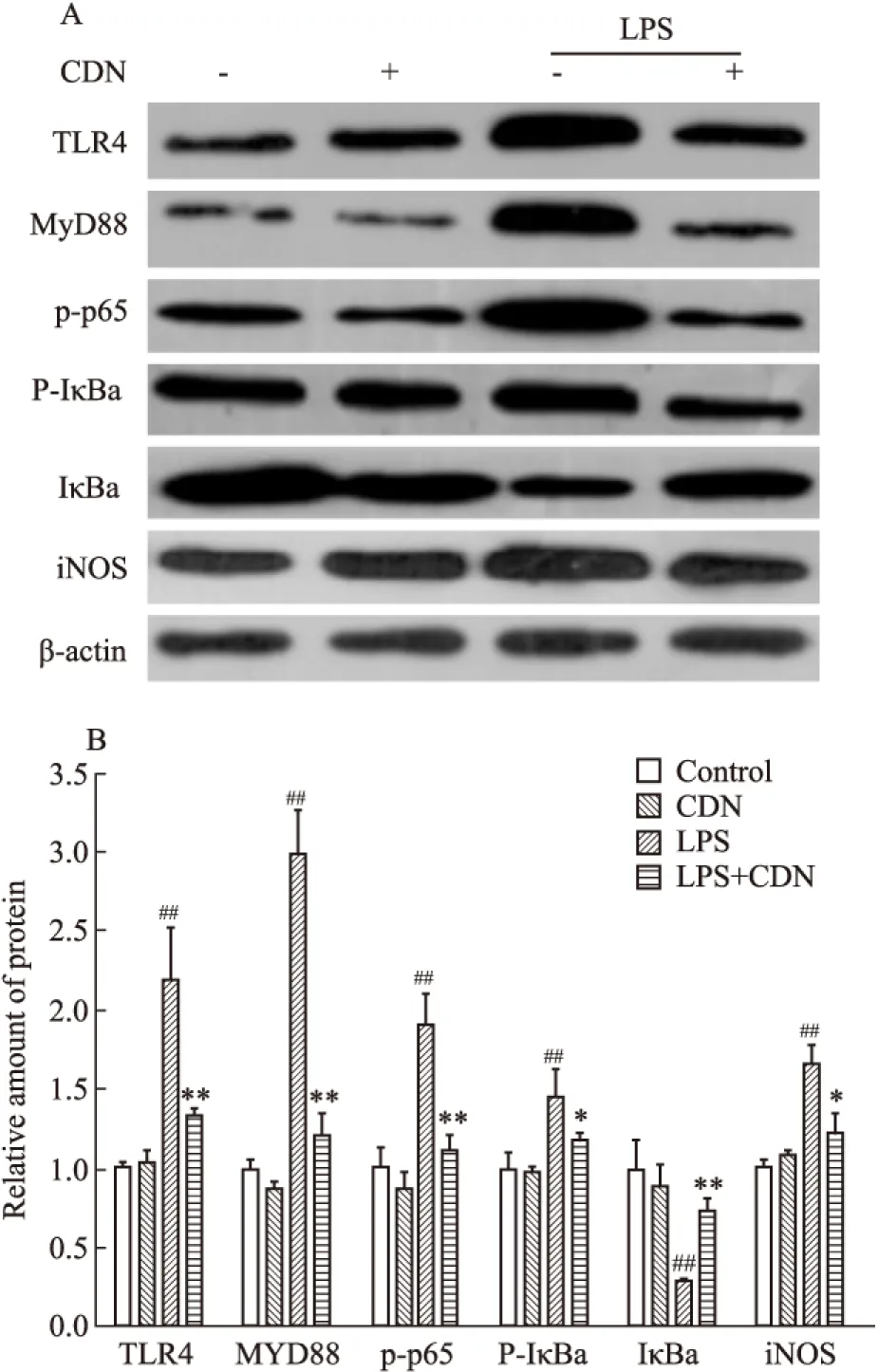
Fig 4 Effects of CDN on signaling molecules expression of TLR4/MyD88/NF-κB/iNOS pathway in LPS-stimulated RAW264.7 cells(n=4)
A:Western blot was performed and one representative experiment from three independent experiments was shown;B:Blots were quantified by densitometric analysis.##P<0.01vsvehicle-treated cells;*P<0.05,**P<0.01vsLPS-treated cells.
综上所述,豆蔻明通过抑制TLR4/MyD88/NF-κB/iNOS信号通路,进而抑制炎性介质NO的生成,从而减轻炎症反应。进一步研究应探讨其他的炎症信号通路。
(致谢:本文所有实验均在上海中医药大学中药研究所药理实验室完成,邓超、任改艳、孙阿宁和罗晓平负责细胞培养和检测,任改艳负责数据处理和统计分析,王峥涛和窦薇负责实验设计和论文撰写。)
参考文献:
[1]Fort M M,Mozaffarian A,Stöver A G,et al. A synthetic TLR4 antagonist has anti-inflammatory effects in twomurine models of inflammatory bowel disease[J].JImmunol, 2005, 174(10):6416-23.[2]Zhang J, Dou W, Zhang E, et al. Paeoniflorin abrogates DSS-induced colitis via a TLR4-dependent pathway[J].AmJPhysiolGastrointestLiverPhysiol, 2014, 306(1):G27-36.
[3]乔春峰,徐珞珊,王峥涛,等.山姜素和豆蔻明的研究概况[J].中国野生植物资源, 2002, 20(6):11-5.
[3]Qiao C F, Xu L S, Wang Z T, et al. Progress in studies of alpinetin and cardamonin[J].ChinWildPlantRes, 2002, 20(6):11-5.
[4]Gonçalves L M,Valente I M,Rodrigues J A. An overview on cardamonin[J].JMedFood,2014,17(6): 633-40.
[5]Kim Y J,Ko H,Park J S, et al. Dimethyl cardamonin inhibits lipopolysaccharide-induced inflammatory factors through blocking NF-kappaB p65 activation[J].IntImmunopharmacol,2010,10(9):1127-34.
[6]Ren G, Sun A, Deng C, et al. The anti-inflammatory effect and potential mechanism of cardamonin in DSS-induced colitis[J].AmJPhysiolGastrointestLiverPhysiol,2015, 309(7): G517-27
[7]李晓红,齐云,蔡润兰,等. 芦荟大黄素对LPS诱导的RAW264.7细胞NO生成及iNOS表达的影响[J].中国药理学通报,2010, 26(4): 488-92.
[7]Li X H, Qi Y, Cai R L, et al. Effect of lipopolysaccharide induced expression of inducible nitric oxide synthase by aloe-emodin in RAW264.7 cells[J].ChinPharmacolBull, 2010, 26(4): 488-92.
[8]杨会军,刘维超,李兆福,等. 痛风消颗粒对RAW264.7巨噬细胞COX-2和iNOSmRNA调控作用的研究[J]. 风湿病与关节炎, 2014, 3(8): 25-42.
[8]Yang H J, Liu W C, Li Z F, et al. On the regulatory effects of gout granule on RAW264.7 macrophage COX-2 and iNOS mRNA[J].RheumArthr, 2014, 3(8): 25-42.
[9]任改艳,孙阿宁,张晶晶,等.NF-κB在细胞凋亡中调节作用的研究进展[J].中国药理学与毒理学杂志, 2015, 29(2): 323-7.
[9]Ren G Y, Sun A N, Zhang J J, et al. Advances in roles of NF-κB in regulating pathways of apoptosis[J].ChinJPharmacolToxicol, 2015, 29(2): 323-7.
[10]Sung M K,Park M Y. Nutritional modulators of ulcerative colitis:clinical efficacies an mechanistic view[J].WorldJGastroenterol, 2013, 19(7): 994-1004.
The regulatory effect of cardamonin on TLR4/MyD88/NF-κB/iNOS pathway
DENG Chao, REN Gai-yan , SUN A-ning, LUO Xiao-ping, WANG Zheng-tao, DOU Wei
(TheMOEKeyLaboratoryforStandardizationofChineseMedicineandShanghaiKeyLaboratoryofComplexPrescription,InstituteofChineseMateriaMedica,ShanghaiUniversityofTCM,Shanghai201203,China)
Abstract:AimTo assess the regulatory effects of cardamonin(CDN) on toll-like receptor(TLR)-4/MyD88/NF-κB/iNOS signaling pathway in lipopolysaccharide(LPS)-stimulated RAW264.7 macrophage cells.MethodsLPS-stimulated RAW264.7 cells were divided into three groups: vehicle-treated group, LPS-treated group and LPS+CDN-treated group. Cell viability was assessed by CCK-8 assay. The concentration of nitric oxide(NO) in cell culture medium was measured by Griess reagent. The mRNA levels of iNOS, COX-2, MCP-1,TNF-α, IL-6 and IL-1β were determined by reverse transcription real-time quantitative PCR(RT-qPCR). The protein levels of inducible nitric oxide synthase(iNOS), TLR4, myeloid differentiation factor 88(MyD88), nuclear factor κB(NF-κB) phosphorylated(p)-p65, inhibitor κBα(IκBα), and p-IκBα were determined by Western blot. Results1~50 μmol·L-1CDN had no cytotoxicity in RAW264.7 cells. However, CDN inhibited the LPS-induced secretion of nitric oxide(NO) and mRNA expressions of iNOS, COX-2, MCP-1,TNF-α, IL-6 and IL-1β in a dose-dependent manner. Moreover, 50 μmol·L-1CDN inhibited the LPS-induced up-regulation of iNOS, TLR4, MyD88, NF-κB p-p65, p-IκBα and down-regulation of IκBα. ConclusionCardamonin inhibits the production of NO via a mechanism associated with the inhibition of TLR4/MyD88/NF-κB/iNOS pathway.
Key words:RAW264.7 cell; TLR4; MyD88; NF-κB; iNOS; cardamonin
收稿日期:2016-01-14,修回日期:2016-03-02
基金项目:国家自然科学基金资助项目(No 81273572);上海市高校一流学科创新研究基金资助项目(No ZYX-CXYJ-023).
作者简介:邓超(1990-),男,硕士生,研究方向:中药药理学,E-mail:1004596075@qq.com;
doi:10.3969/j.issn.1001-1978.2016.06.009
文献标志码:A
文章编号:1001-1978(2016)06-0779-05
中国图书分类号:R-332;R284.1;R329.25;R364.5;R392.11; R392.12;R977.6
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.018.html
窦薇(1969-),女,博士,研究员,硕士生导师,研究方向:中药药理学,通讯作者,E-mail:vivi.dou@yahoo.com
